P16INK4A、Ki-67和HPV DNA16/18在绝经后妇女宫颈鳞状上皮病变中表达的意义
胡俊波,孙 军
(湖北省妇幼保健院病理科,武汉430070)
2008年底,我国60岁以上老年人口已达到1亿5989万人,占总人口的12%,表明已经进入了老龄化社会,老年人的健康日益引起社会的广泛关注。宫颈癌是女性生殖系统常见的恶性肿瘤,和高危HPV感染密切相关[1-2]。老年宫颈癌预后差,病死率高,严重威胁老年妇女身心健康。阴道镜活检做病理检查作为诊断宫颈病变的金标准,降低了宫颈癌的发病率。绝经后妇女因雌激素水平降低常常导致宫颈上皮萎缩,细胞层次减少,部分区核深染,与高级别上皮内瘤变易混淆,成为诊断的陷阱[3-5]。本研究对104例绝经后患者宫颈组织进行总结,以期找出有效的诊断标准。
1 材料与方法
1.1 材料 取自湖北省妇幼保健院病理科2004年12月至2008年12月子宫颈活检及手术切除标本的存档蜡块共104例。其中CINⅠ级43例、CIN Ⅱ~Ⅲ级19例、宫颈浸润癌22例,20例萎缩的宫颈组织为对照组。肿瘤分型按WHO(2003)女性生殖系统肿瘤分类标准进行。本组104例患者年龄55~75岁,平均(58.37±4.82)岁。
1.2 方法 用原位杂交法(ISH)检测 HPV DNA16/18;用免疫组化Envision法检测P16INK4A、Ki-67抗原。地高辛标记的HPV 16/18原位杂交探针、放大系统检测试剂盒(福州泰普公司产品),单克隆抗体P16INK4A及多克隆抗体 Ki-67均购自北京中杉金桥生物技术有限公司。实验步骤严格按照试剂盒说明书进行。HPV检测阳性对照用子宫颈癌阳性片加阳性探针,TBS液代替阳性探针作为阴性对照。Envision检测用TBS代替一抗作为阴性对照,乳腺癌组织作阳性对照。
结果判断:在高倍镜下随机选取3个视野,每个视野计数200个肿瘤细胞或鳞状细胞。HPV原位杂交:以细胞核出现棕黄色颗粒为阳性。P16INK4A蛋白定位细胞核或细胞质内出现有棕黄色颗粒。按其染色有无及强弱程度划分为:阳性细胞数小于5%或无阳性细胞为阴性;6%~25%为弱阳性;26%~50%为阳性;大于50%为强阳性。Ki-67以细胞核出现棕黄色颗粒为阳性,仅基底层细胞有表达为(-);阳性细胞数1%~20%为(+);21%~50%为(++);大于50%为(+++)。
1.3 统计学方法 处理采用SAS 8.12软件分析,计数资料比较使用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 HPV与宫颈病变的关系(表1) HPV16/18在宫颈鳞癌、CIN组中均有阳性表达,在萎缩对照组中无表达(图1)。HPVl6/18型在宫颈鳞癌及CIN组中的表达水平与萎缩对照组比较差异有统计学意义(P<0.05),并且随着CIN组织学分级的增加呈升高趋势,尤其在宫颈CINⅡ/Ⅲ级、鳞癌两组中的表达最明显(图2)。本实验宫颈病变中 HPV总检出率为28.57%(24/84)。
2.2 P16INK4A、Ki-67与宫颈病变的关系 P16INK4A、Ki-67在宫颈鳞癌、CINⅢ/Ⅱ、Ⅰ组的阳性表达率与萎缩对照组比较差异差异有统计学意义(P<0.05)。随着宫颈病变严重程度的增加,P16INK4A、Ki-67的阳性表达率呈增加趋势,尤其在宫颈鳞癌和CIN中的阳性表达率明显增高(表2)。P16INK4A在宫颈鳞癌、CINⅢ、CINⅡ组中,表达以胞核和胞浆强阳性为主(图3);在CINⅠ组中仅为弱阳性表达。Ki-67在宫颈鳞癌和CINⅢ中以强阳性表达为主(图4)。P16INK4A、Ki-67在萎缩对照组中呈阴性表达(图5、6)。

表1 HPV DNA 16/18在不同程度宫颈病变中的表达
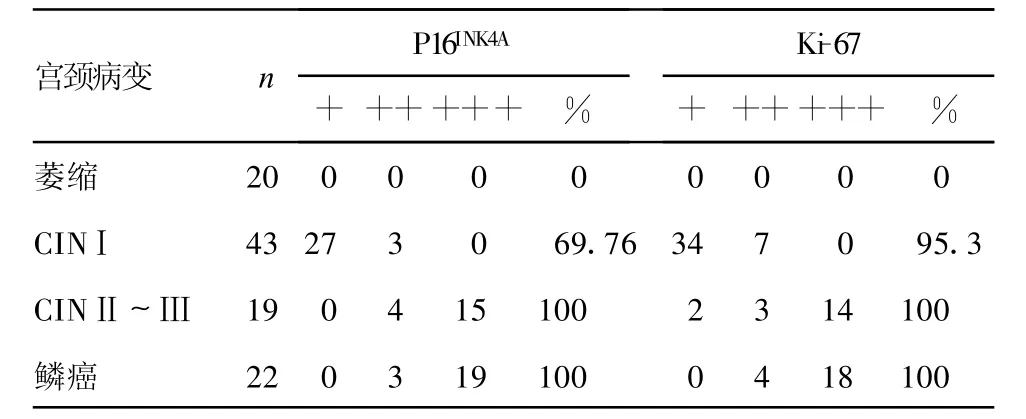
表2 P16INK4A、Ki-67在不同程度宫颈病变中的表达

图1 萎缩性黏膜细胞核HPVl6/18不表达(-)ISH法

图2 CINⅢ中,中、表层细胞核出现散在棕黄色颗粒的细胞为HPVl6/18(+)ISH法
2.3 HPV DNA 16/18感染与P16INK4A表达程度之间的比较见表3。在绝经后妇女子宫颈萎缩病变中,HPV DNA 16/18感染与P16INK4A蛋白表达为阴性,随着CIN组中HPV DNA 16/18阳性率愈高,P16INK4A蛋白表达的强度就愈强。

图3 CINⅢ中,P16INK4A在细胞核及细胞浆中出现弥漫棕黄色颗粒(+)SP法

图4 Ki-67全层细胞核表达呈棕黄色颗粒(+)SP法

图5 萎缩性黏膜细胞浆及细胞核P16INK4A不表达(-)SP法

图6 萎缩性黏膜基底及旁基底层细胞核Ki-67呈散在棕黄色颗粒(-)SP法

表3 HPV DNA 16/18的感染与P16INK4A的关系
3 讨 论
HPV感染是宫颈癌及癌前病变形成的最重要的原因,特别是持续性高危型HPV l6/18感染,如HPVl6型可在差不多50%的宫颈高度上皮鳞状上皮内瘤变(HSIL)和鳞癌中发现,HPV18型与15%的鳞癌有关。老年患者的HPV病毒负荷量是较高的,研究发现,HPV感染在人群中呈U型或S型分布,第1个高峰在25~35岁,第 2个高峰在大于55岁年龄段[6-8]。大多数HR-HPV感染(大于 55岁)与 HSIL及鳞癌密切相关,其中HPV 16/18是最常见的病毒亚型。当HPV16/18感染宫颈时,可将 HPV DNA整合到宿主细胞基因组中,进而病毒DNA上的E6、E7癌基因表达蛋白能引起自身调节和宿主调节基因表达失调,从而影响正常细胞周期调控,导致宫颈上皮细胞发生恶变。本研究结果显示:HPV 16/18 DNA在19例CINⅡ/Ⅲ级和 22例宫颈癌组织中的阳性表达率分别为47.3%、36.4%,与文献[9]报道近似。子宫颈 CINⅡ/Ⅲ级和鳞癌组 HPV16/18DNA阳性表达率明显高于萎缩组(P<0.01),且高于CINⅠ级组,证实子宫颈鳞状细胞癌发生与高危型HPV 16/18感染密切相关。萎缩组表达阴性,表明HPVl6/18 DNA在易误诊为HSIL的萎缩病变时可作为有效的鉴别诊断工具。本研究结果还显示,原位杂交技术是一种检测HPV感染的特异性强、技术成熟的方法,特异性可能比基于液体的方法强,定位准确,阳性预测值高,可直接发现整合到宿主细胞内的HPV核酸[2]。而免疫组化检测HPV不敏感,检出率低;美国Digene公司 HC2检测 HPV是非特异性(部分阳性病例是正常人群,可能为一过性病毒感染)[10]。结果提示原位杂交可作为临床HPV检测有效手段。
HPV与细胞周期的变化有关,特别是高危险性的HPV,所以细胞周期生物标志物能够起HPV感染的替代标志物的作用,而且可以用于促进宫颈前体病变的精确诊断。P16INK4A是一种细胞周期蛋白依赖性激酶抑制剂,在宫颈鳞状上皮非肿瘤性病变中阳性率极低或全部阴性,而在CIN尤其在高级别CIN中阳性率极高,作为辅助的诊断标记物可以有效地区分出CIN病变[11-12]。本研究的结果显示P16INK4A蛋白在老年患者正常或萎缩性宫颈鳞状上皮中均为阴性表达,而在CIN病变中阳性率显著增加,随着CIN级别升高,其表达强度亦相应增加,在CINⅡ/Ⅲ级和鳞癌组阳性率达 100%,与 Qiao等[13]报道相一致。据此可使绝大部分CIN病变区分出来,并客观准确的分级。随着CIN组中HPV DNA 16/18阳性率愈高,P16INK4A蛋白表达的强度就愈强,表明P16INK4A蛋白具有高危HPV的强烈阳性预测值。本研究结果显示Ki-67在萎缩性宫颈鳞状上皮标本中局限于基底及旁基底层,数量较少且散在,为阴性;在低级别鳞状上皮内瘤变中阳性表达可达中层而高级别病变则可达全层;随着病变级别增加,阳性表达也相应增高,可有助于区分萎缩与HSIL。但炎性及修复性病变中Ki-67表达也高,需联合作P16INK4A蛋白(表达阴性),将假阳性病变排除。
综上所述,在绝经后宫颈鳞状上皮瘤变中免疫组化检测P16INK4A蛋白和Ki-67抗原,原位杂交检查高危型HPV感染,作为一种临床病理有效辅助诊断工具,可明确地区分萎缩和CIN病变,并指导CIN分级,有较好的临床应用价值。
[1] Chen S,O′Sullivan H,Tabrizi SN,et al.Prevalence and genotyping of HPV in cervical cancer among Australian women[J].Int JGynaecol Obstet,1999,67(3):163.
[2] Levert M,Clavel C,Graesslin O,et al.Human papillomavirus typing in routine cervical smears.Results from a series of 3778 patients[J].Gynecol Obstet Fertil,2000,28(10):722.
[3] Feng J,Al-Abbadi MA,Bandyopadhyay S,et al.Significance of high-risk human papillomavirus DNA-positive atypical squamous cells of undetermined significance pap smears in perimenopausal and postmenopausal women[J].Acta Cytol,2008,52(4):434.
[4] Johnston EI,Logani S.Cytologic diagnosis of atypical squamous cells of undetermined significance in perimenopausal and postmenopausal women.lessons learned from human Papillomavirus DNA testing[J].Cancer,2007,111(3):160.
[5] Vetrano G,Aleandri V,Ciolli P,et al.Conservative approach to preneoplastic cervical lesions in postmenopause[J].Anticancer Res,2008,28(6B):3941.
[6] Syrjänen K,Kulmala SM,Shabalova I,et al.Epidemiological,clinical and viral determinants of the increased prevalence of high-risk human papillomavirus(HPV)infections in elderly women[J].Eur JGynaecol Oncol,2008,29(2):114.
[7] Eltoum IA,Chhieng DC,Roberson J,et al.Reflex human papilloma virus infection testing detects the same proportion of cervical intraepithelial neoplasia grade 2-3 in young versus elderly women[J].Cancer,2005,105(4):194.
[8] Kutza J,Smith E,Levy B,et al.Use of hormone replacement therapy(Hrt)And detection of human papillomavirus(Hpv)Dna in postmenopausal women[J].Ann Epidemiol,2000,10(7):465.
[9] Smith EM,Johnson SR,Ritchie JM,et al.Persistent HPV infection in postmenopausal age women[J].Int JGynaecol Obstet,2004,87(2).131.
[10]李军果,李力,郭建新,等.375例宫颈病变患者高危型人乳头瘤病毒感染的研究[J].重庆医学,2008,37(9):935.
[11]Bolanca IK,Ciglar S.Evaluation of P16INK4Ain cervical lesion of premenopausal and postmenopausal women[J].Coll Antropol,2007,31(Suppl 2):107.
[12]Engelsen IB,Stefansson I,Akslen LA,et al.Pathologic expression of p53 or p16 in preoperative curettage specimens identifies high-risk endometrial carcinomas[J].Am JObstet Gynecol,2006,195(4):979.
[13]Qiao X,Bhuiya TA,Spitzer M.Differentiating high-grade cervical intraepithelial lesion from atrophy in postmenopausal women using Ki-67,cyclin E,and p16 immunohistochemical analysis[J].J Low Genit Tract Dis,2005,9(2):100.

