牛病毒性腹泻病毒持续感染对后备奶牛的负作用
■ 赵阳 傅小平译 爱德士生物科技股份公司
牛病毒性腹泻病毒(BVD或BVDV)属于黄病毒科瘟病毒属。该病毒是有囊膜的正链RNA病毒,能通过胎盘感染妊娠期为30~150天的怀孕母牛,引起因流产、死产或犊牛未成年死亡造成的大量经济损失。为了研究其对后备奶牛的影响,对BVD进行了如下试验。
试验涉及的904头犊牛为323个牛群中父母关系明确的荷斯坦和娟珊牛杂交后代,这些犊牛都在连续2年内出生,出生后立即集中饲养。群1(C1):389头犊牛生于2000年;群2(C2):515头犊牛生于2001年。
群1和群2中的犊牛在6或9月龄时收集血清样本,并使用爱德士牛病毒性腹泻血清抗原酶联免疫(IDEXX BVD serum antigen ELISA)方法分别进行检测。12头犊牛检测为牛病毒性腹泻抗原阳性,并用Pourquier抗原酶联免疫试剂确认。12个血清样本按1:100的比例在牛病毒性腹泻抗体阳性血清中稀释后,用Genemark牛病毒性腹泻聚合酶链锁反应(PCR)方法检测仍为阳性。犊牛15月龄时,进行第2次采样,上述2种方法均确认12头牛全部处于持续感染状态。群1中8头犊牛为牛病毒性腹泻持续感染牛(PI),感染率为2.1%;群2中仅有4头犊牛为持续感染牛(PI),感染率为0.8%。
1 损害牛群健康
所有试验动物在购买时均经过检察并在试验全程中仔细观察。尽管总体上持续感染犊牛在3周龄时比非持续感染犊牛轻3.6kg,但是所有持续感染犊牛都未表现出牛病毒性腹泻持续感染典型的发育不良症状。
2头持续感染犊牛死于15~16月龄,1头死于胃气胀并发症,1头死于败血症(也可能是黏膜病);另1头在20月龄时流产(并且表现为健康不良)后被淘汰。随后,75%的持续感染牛进入了泌乳群。1头患有肺炎的持续感染牛在38月龄时被实行安乐死,3头持续感染牛因持续感染而被淘汰2头患有乳房炎,1头蹄部感染。3头持续感染牛接受了肺炎治疗,包括唯一幸存的犊牛,但其成年后复发2次肺炎。9头持续感染泌乳牛中的5头患有临床乳房炎,部分牛经历了多次复发。
2 阻碍牛只成长
群1和群2中全部持续感染犊牛至21月龄(即91周)时的生长曲线分别如图1~2所示。
持续感染牛的平均体重大致在牛群体重最低的2.5%之内,第91周龄时,存活的持续感染牛的体重比群内其它非持续感染牛体重平均轻68kg,约轻17%(表1)。
3 降低存活率
仅1头持续感染牛存活(共12头持续感染牛,存活率为8%),期间还曾2次感染肺炎。相比之下,群中同母源非持续感染牛存活率为75%(共4头同母源非持续感染牛,3头存活),总体存活率为71%。从图3可以看出,群中牛病毒性腹泻持续感染牛的存活率大大下降(P<0.01)。
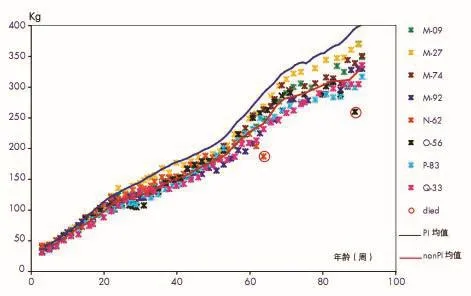
图1 群1中8头持续感染牛3~91周龄个体体重及持续感染牛和非持续感染牛平均体重的比较
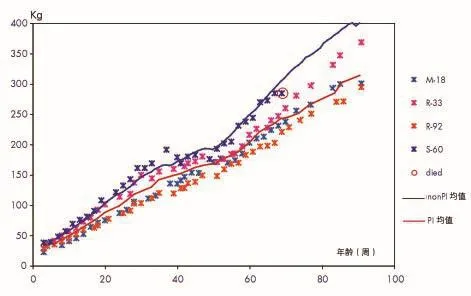
图2 群2中4头持续感染牛3~91周龄个体体重及持续感染牛和非持续感染牛平均体重的比较
9头持续感染牛生存到了其成年期,共产下19头小犊牛。大多数为公犊牛,1头发育不良,2头被饲养,也均被PCR和ELISA方法确认为持续感染牛。
因为试验设计的原由,犊牛并未因与生产相关被淘汰。持续感染牛因乳房炎而遭淘汰的明显多于非持续感染牛(表2),重疾和突然死亡也比较多。
4 降低产奶量
从理论上讲,个体持续感染牛的产奶量应接近于非持续感染牛(表3),然而,对于初乳中乳脂肪、乳蛋白质和产奶量的分析发现,持续感染状态伴随着巨大的产量损失(P<0.01)。牛奶干物质含量仅为非持续感染牛的50%。动物评估单位的产奶量变化证实了这些损失不是简单的由产犊较晚和(或)持续感染牛的较早淘汰造成的。
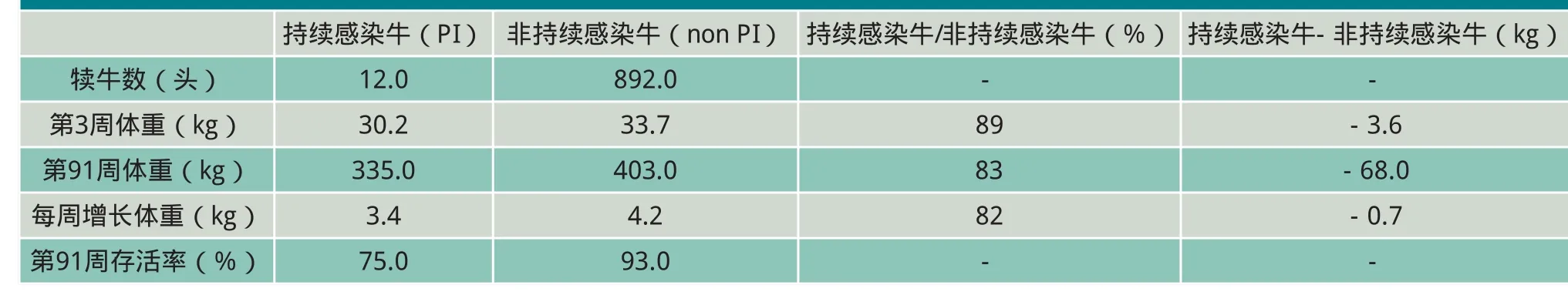
表1 全部育成牛平均活体重统计(根据持续感染状态)
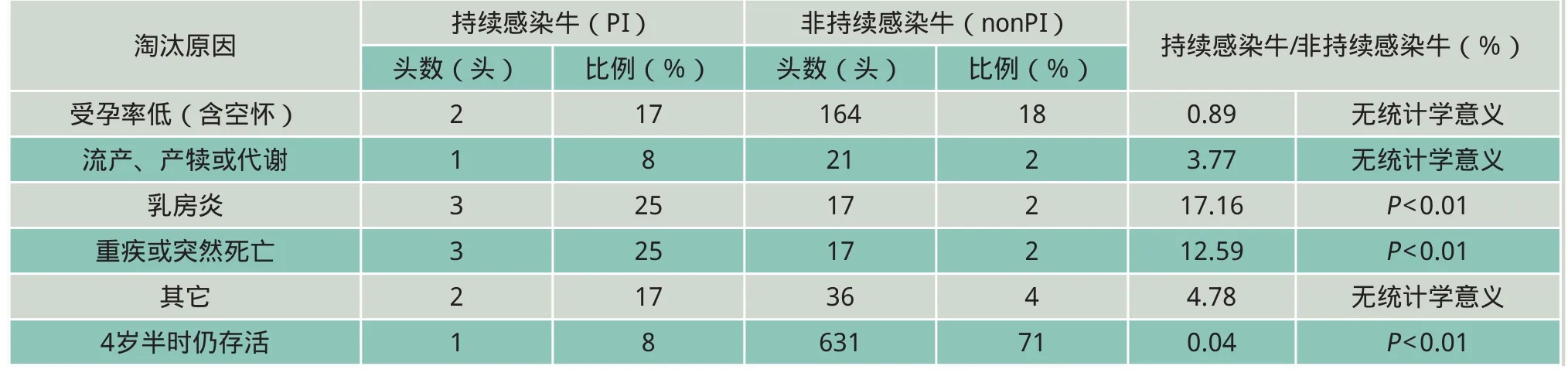
表2 奶牛4岁半时累积的淘汰事件分类及持续感染牛和非持续感染牛比率
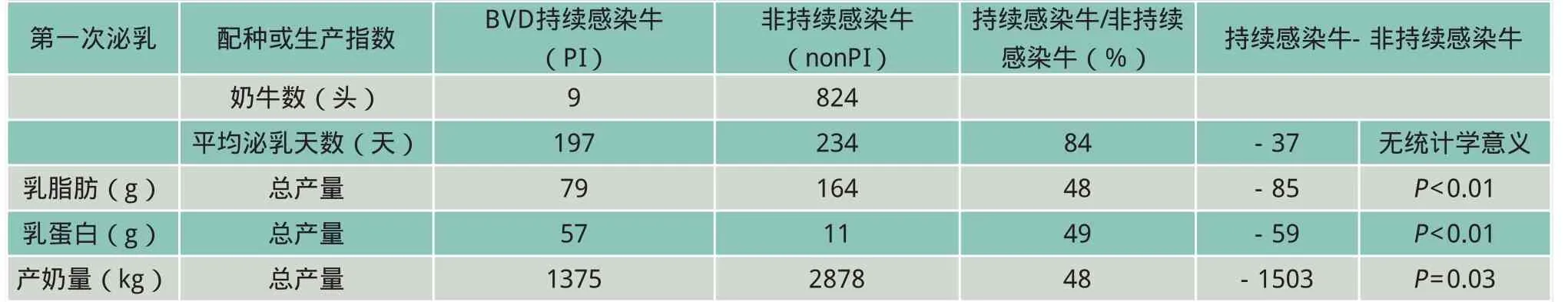
表3 初乳产量数据及分别祖先育种值
5 总结
4头持续感染牛的同胞牛都被测试为牛病毒性腹泻阴性,证明这些持续感染牛是在其母亲怀孕期间由于急性感染而产生的。尽管在群中存在持续感染牛,但是没有证据表明会爆发黏膜病,大多数持续感染牛存活很久直至产犊,进入泌乳群。然而,持续感染牛的生长率和健康状况明显降低,其持续感染状态可导致初乳产量减半;另外,持续感染牛明显缺乏有效的免疫功能,容易并发其它疾病如肺炎等,持续感染牛的生命周期很短并伴随感染导致大量损失。
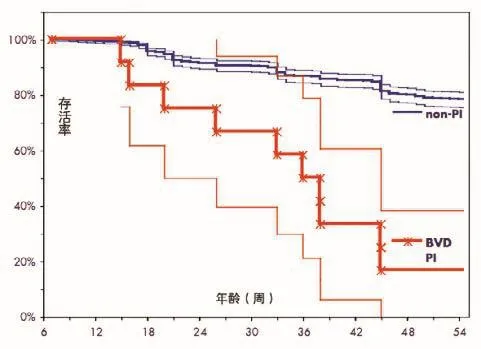
图3 依据持续感染状态分类的904头杂交牛的存活曲线
(摘译自:Hinrich Voges,Suzanne Young,Margaret Nash. Direct adverse effects of persistent BVDV infection in dairy heifers—a retrospective case control study. Bovine Medicine,2006(9):22-25 )

