牛奶产业链中的抗生素残留及预防措施
■ 赵少华 帝斯曼(中国)有限公司
1 食品中存在抗生素残留的风险
近60年来,抗生素是用于人类和兽类疾病治疗的最常用药物。多年来,发表了许多以药物合成为主题的文章,而且牛奶中的抗生素残留也被认为是这个领域中需要优先考虑的事情。基于对药物的检测以及大规模使用药物结果的观察,科学界对牛奶中抗生素残留问题有了非常广泛和深刻的认识。法规的发展也不断要求制药公司进行更多的实验室实验和实践检验,以保证将某药物用于人类和动物时能很好地控制已确认的风险。
1.1 直接毒性
对于抗生素来说,经常被提到的毒性例子可能就是氯霉素作为抗生素残留出现在食品中。当发现再生障碍性贫血与该药物在人类中使用有关后,欧洲就禁止它在兽药中使用。
氯霉素是一种由委内瑞拉链霉菌产生的天然化合物,该霉菌存在于土壤中,并且也从土壤中分离到了氯霉素。在某些国家,比如在中国,直到2002年才被禁用于兽药,但仍可用作人类药物,那么对环境的污染是不可避免的。事实上,环境被不同来源的氯霉素污染已经发生:1999年在德国,在一些地表水和经过处理的污水中检测到了氯霉素。这些结果解释了为什么“零耐受”的概念对于这样一个广泛存在的药物的应用非常困难,特别是当今的检测手段那么有效。尽管氯霉素的内在毒性由于不同的原因被相对地渲染,但这一抗生素确实有免疫毒性,并可能有低生殖毒性。因此,氯霉素的残留违反了所有的预防措施。免疫毒性尽管非常罕见,但对人类却是致命的(再生障碍性贫血)。对于氯霉素可能的生殖毒性,在啮齿动物实验中显示出低生殖毒性反应。
1.2 致癌效应和诱变效应
对于致癌效应和诱变效应,抗生素不像某些抗寄生药物,一般不在危险药物名单之中。
值得注意的是,长时间高剂量使用呋喃妥英的例子,其在动物致诱变性试验中被证实有致癌效应和诱变效应,这种药物在大多数国家中禁用于兽药生产。其它一些被认为有潜在致癌效应的物质分别是喹喔啉、卡巴多和喹乙醇。大多数国家允许使用的抗生素药物中,明确规定不能使用含已知直接致癌效应的物质。
1.3 致畸效应
食品中含有可能影响胎儿(新生儿畸形)的残留是最主要的问题。致畸性可以仅接触一次就发生。对于药物来说,已证明以下药物有致畸效应:某些磺胺类药物、许多有机磷和氨基甲酸盐、抗寄生药、地塞米松和抗真菌药如灰黄霉素等。对于磺胺类药物,必须强调在最初可能的致畸效应剂量就是对人类所用的治疗剂量,而这个剂量完全不同于在食品中可发现的残留量。
1.4 过敏
食品中存在抗生素残留导致过敏的问题已经研究了很多年,可在以下2个层面上陈述:①致敏效应可能是过敏的起因,例如,对个体的第1次抗生素治疗;②对于已经敏感化的个体,起始效应可能与过敏反应相关。
使用抗生素的人产生过敏的案例并不少,抗生素和某些消炎药物可能是药物家族中对人类的过敏效应被观察和研究得最多的。在抗生素中,提到最多的用于人类曾产生过敏的药物是:阿莫西林、trimethoprimesulfamethoxazole、氨比西林、头孢菌素、红霉素、青霉菌G以及strepthomycin;其次是新霉素、硝基呋喃、螺旋霉素、新生霉素以及四环素。这些抗生素中的大多数与对人类治疗的过敏起源相关,因此,如果食用含抗生素的食品,确实存在潜在的过敏风险。实际上,该风险主要存在于青霉素中,青霉素是最易产生免疫抗原的,但又是最常用的。
将过敏反应与食品中的抗生素残留相联系非常困难,与食品中的抗生素残留可能相关的过敏并且做出声明的数量也非常有限,经常提到的是假设或怀疑。这就是为什么需要在青霉素过敏的人类志愿者身上进行测试,以便研究在摄入了含已知量的抗生素残留食品后的结果。由于食品中天然成分而导致的过敏比由于抗生素残留而导致的过敏更常见。
1.5 对菌群的影响
人类肠道中存在的菌群对人类健康起了相当重要的作用。
人类在抗生素治疗后会发生抗生素残留的影响,已被明确无疑地证明了。因此,考虑食品中残留的抗生素对人类肠道中的常见菌群的影响非常重要。这也是在最大残留极限(MRL)设定的研究中包括了抗生素残留量对人类肠道中常见菌株的影响的原因。MRL的另一个目标是保证可测量到的抗生素残留对人类肠道菌群的影响。
1.6 传递的或者获得的抗药性
针对农场中出现的细菌而使用的抗生素,其对于人类药物治疗时抗药性的影响是科学界近几十年来研究的重要课题。随着被发现的新药物数量的增加,耐药菌株的比例也在增加,医生可开处方的趋势在下降,这使得这一课题变得更加重要。由于农场中使用抗生素而导致的耐药性问题,需要从以下3个层面进行考虑。①在农场使用抗生素会促进细菌对抗生素进行选择,抗药性可能会通过动物源食品转移到人类。如果这些菌是人畜共患的致病菌(沙门氏菌等),那么所获得的耐药性就可能产生问题。由于不良使用习惯(特别是不恰当的剂量)而导致的耐药性十分常见。②动物细菌获得的耐药性可以间接地转移到人类细菌中。③食品中含有抗生素残留对于人类耐药菌株的选择的潜在影响看起来几乎为零。
关于抗生素残留对耐药性出现的影响,目前还没有研究表明食品中抗生素残留直接导致了耐药性的增加。确实,MRL保留了残留量水平,该水平很少有机会作为菌株选择性耐药的原因(即使能够导致耐药性的浓度很低)。
2 最大残留极限(MRL)
2.1 法规基础
在抗生素残留被发现后不久,人们就发现它不仅对加工过程(抑制发酵),而且对人类健康有重要影响。因此,抗生素残留导致的相关风险问题在很长一段时间内被逐渐了解。
MRL是在产品中(如牛奶、肉、蛋等)的最大浓度,即对消费者无害又不影响加工过程的浓度。动物源食品一定不能超过这一极限。
2.2 加工产品(黄油、酸奶、干酪、奶粉等)应用MRL的意义
2.2.1 零残留的概念
随着检测方法的发展,从“零残留”的概念转换到MRL变得不可避免。实际上,随着治疗时间的推移,机体会逐渐排出抗生素分子,最终使其降至零,但是这要经过非常长的时间。随着分析方法的进步和成百上千的实验,检测极限也逐渐区分开来。使用适宜的方法,“零残留”的概念使得许多药物由于经济上的原因不可能使用。随着毒理学知识的发展,“零残留”转变为MRL概念成为可能:①证实在低剂量时没有影响;②方法学知识的进步使得保证“无明显反应剂量”的实验得以进行。
2.2.2 一个折衷的概念

MRL是一个非常有意思的概念,因为它是一个在消费者和生产者之间的折衷。在不禁止使用药物前提下,MRL定义了安全条件下的使用规则。
2.3 各国差异很大
即便已经做了很大的努力使得全球范围内的MRL协调一致(在WTO:www.wto.org和食品法典委员会的赞助下),但是必须指出,后者在不同的地理区域间还是存在着非常大的差别的。由于这些MRL上的差别,对于给定的种类,例如同样批准的以金霉素为基础的药物,休药期在加拿大为7天,而在美国则为零。
2.4 毒理学MRL和细菌学MRL
毒理学MRL的设定是为了消费者安全。这个概念包括短期或长期、不论是对个体还是它的后代所观察到的影响的性质,所有与分子毒性相关的要素。
细菌学MRL是针对保证对人类肠道菌群无影响的抗生素残留水平。不论群菌的变化是否对人类有影响,这一水平需单独考虑。
2.5 毒理学MRL依赖无明显反应剂量和可接受日摄入量
MRL的确定依赖以下3个关键概念:①用不同的生物学试验来研究无明显反应剂量(NOEL);②根据这一NOEL和安全系数(100和1000)计算可接受日摄入量(ADI);③根据ADI和每个居民的平均食品摄入量以及在不同组织和器官中的再分配知识计算MRL。
按照这些概念,MRL的确定是基于毒理学研究和与残留量相关的特别研究。
2.6 毒理学研究
对2种动物进行急性毒性实验,其中一种为非啮齿动物。然后是慢性毒理实验,接着进行亚慢性毒性实验(通常为90天),之后,对动物进行检查,并对所有器官做组织分析。然后是遗传毒性实验(例如艾姆斯式实验),如有必要,做致癌能力实验。如果遗传毒性实验显示了有重要影响,则一般不会准许有MRL。最后是生殖毒性和胚胎毒性实验。
2.7 无明显反应剂量的设置
这类实验有助于定义无明显反应剂量,这一剂量没有毒理学和药理学的影响。
2.8 按照毒理学来计算可接受日摄入量
用100、1000或更大的安全系数来确定ADI。安全系数考虑了从动物到人的转变,以及人群的多样性(年龄、性别、体重)。
2.9 毒理学MRL的确定
基于ADI值,并且考虑了个体的平均摄入量,就可以计算每种产品的MRL值。因此,MRL保证了所考虑的ADI极限值。
2.1 0 细菌学MRL的计算
对于抗生素,有必要考虑其对人类菌群的可能影响。对来源于人类肠道的100株菌进行了充分的研究,以确定对这些菌群的无明显反应剂量。这些研究在于寻找对细菌繁殖无影响的最大剂量,并对每一株分离的菌株进行单独培养,将培养的菌置于浓度渐高的抗生素中,被认为有意义的影响是那些最敏感的菌株。一旦建立了最小抑制浓度(MIC),考虑到人类的消化量,应用大约为10的安全系数。这就叫做细菌学MRL,是毒理学MRL的补充。
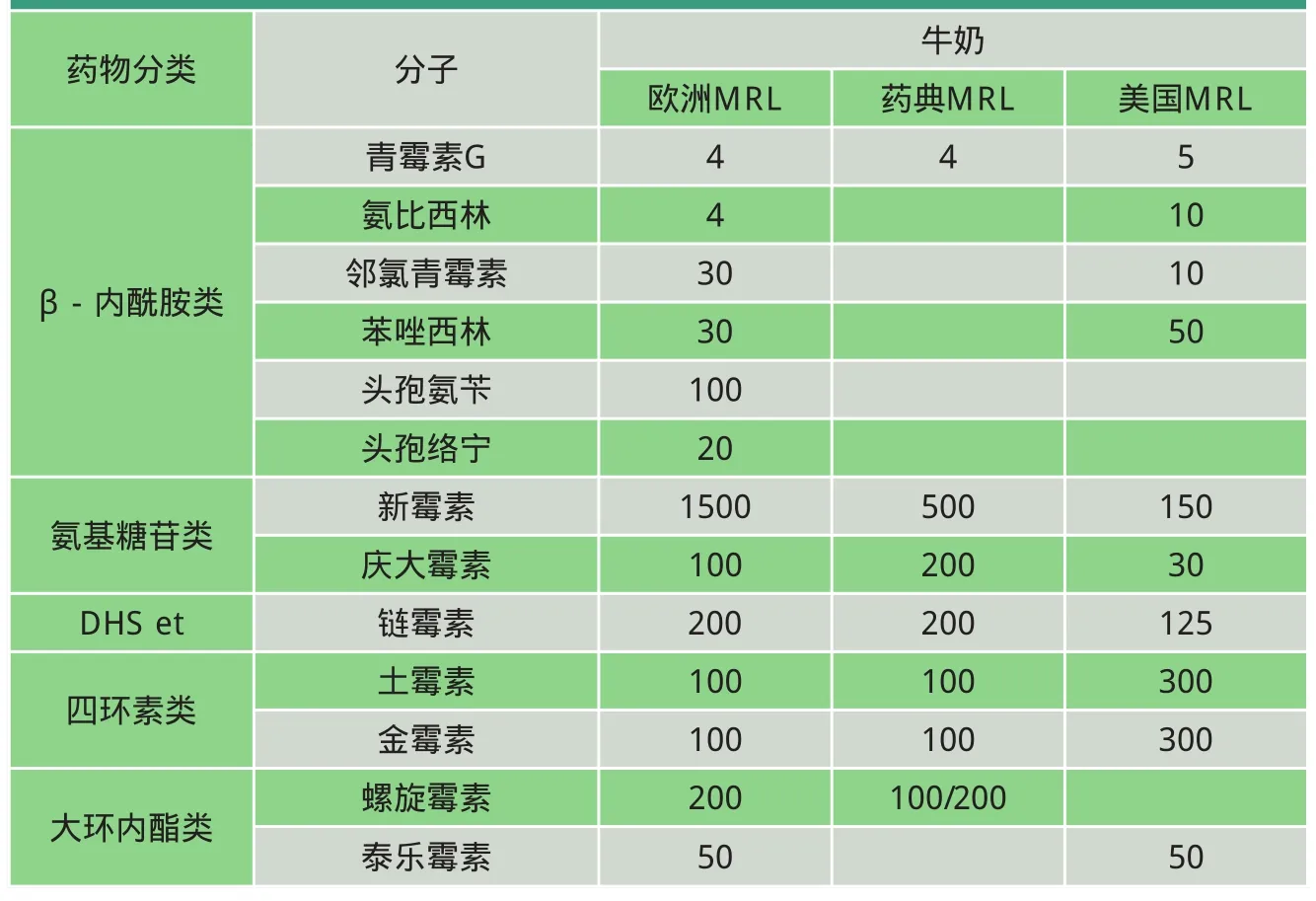
表1 欧洲、美国以及药典中牛奶的MRL举例 单位:μg/kg

表2 按字母排序的兽药类主要抗生素及其MRL 单位:μg/kg
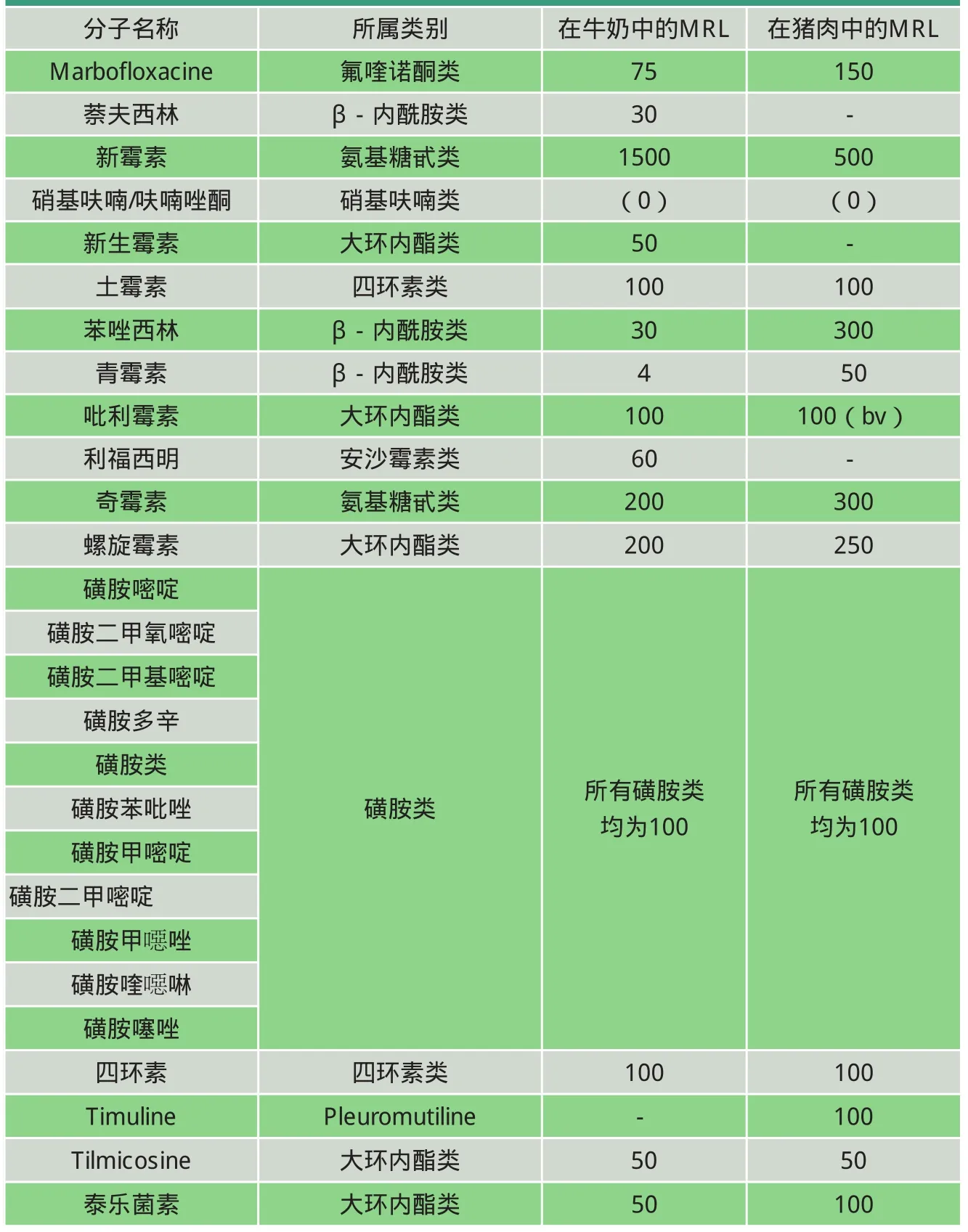
表2 按字母排序的兽药类主要抗生素及其MRL 单位:μg/kg
2.1 1 对分子最终MRL的确定
官方的MRL为所获得的毒理学MRL和细菌学MRL中的最低值。经验表明,对于抗生素,多数情况下细菌学MRL低于毒理学MRL。
2.1 2 不同国家的MRL
每个国家或地区都定义了各自的MRL,如表1~2所示。
2.1 3 相似药物的不同休药期
不同药物间有不同休药期,相同的药物在不同的国家之间休药期不同。要理解这些差异,有必要了解MRL和休药期的应用历史。在1992年以前,欧洲每一个国家都设立了各自的MRL,并同时建立了确定休药期的规则。第一个重大革新是在欧盟内部所有国家中对MRL进行了统一的定义。这些国家都认同的MRL使得内部统一的食品交换变得容易。随着这一法规的执行,政府对这一法规进行了修改。但是,不同国家之间对于休药期的设定却以现行休药期不同而结束。由于这一状况,欧盟于1998年,一方面定义了设定休药期的指南,另一方面建议执行欧洲的立法程序。当休药期的确立需要考虑在分子注射处的残留剂量时,又迈出了新的一步。一系列此类事件解释了为什么现在相同的兽药有完全不同的休药期,因为它们在不同的时间获得了市场许可,而且被提交到了有不同法规的地方。
3 抗生素转移到牛奶中的机理
3.1 新陈代谢和药物代谢动力学
要了解抗生素在体内的代谢结果,在食物(牛奶、鸡蛋、蜂蜜、肉类等)中发现它们的可能性以及其次的MRL形态定义,有必要了解治疗后抗生素在体内代谢相关的基本概念。正如许多年前就证明的,抗生素残留的结果取决于处理的途径。无论何种处理途径,在生物体中抗生素残留的结果都与不同的因素有关。
3.1.1 新陈代谢
药物可以通过不同的主动或被动的化学过程被转运到生物体中,在新陈代谢中,有些可以表现为治疗学或毒性影响,而其它的却没有。
3.1.2 穿越细胞膜的能力
可穿越血管壁、细胞膜等,这个能力一方面与亲水基和疏水基间的分子平衡密切相关,另一方面与分子的大小有关。离子与非离子之间的平衡取决于中性pH值和酸度系数的稳定。
3.1.3 不同的排除形式
排除形式有尿液、粪便、唾液(可循环的)、奶液。
小的分子穿过细胞膜的能力更强,在非离子状态下疏水基比亲水基强。但是某些分子得益于主动传输现象。一旦治疗开始,药物在通过不同途径代谢完之前,会源源不断地扩散到组织的间隔。所以抗生素的一般给药途径或多或少通过不同途径消除:尿液、粪便、唾液(反刍动物中反复利用的胃液)和奶液。体内分子的排出同时强烈地依靠药物的制剂形式,某此“长期效应”药物可以在注射位置和器官处保留很长一段时间,同时也对微生物长期有效。必须要知道,在奶、蛋和肉中,同一种抗生素分子的一种药物跟另一种药物相比,其消除动力学可能不同。无论如何,浓度下降曲线趋向于零,但是可能在给药几天后或几星期内降到可被检测的限度之下。
3.2 哺乳期乳房处理及残留物的持续
在哺乳期对乳房炎的治疗有2种不同的处理机制:生物机制(通过空隙进入血液中)和物理机制(每次挤奶中机械的排除)。个别的抗生素具有很高的扩散性,可以迅速越过不同的物理障碍(细胞壁、血管壁)进入血液循环,代谢后通过不同渠道消除掉(特别是尿液),但它们还可以富集在乳腺组织,会留在乳头或乳房池和葡萄腺,它们主要在挤奶时随着奶液排出体外。多数情况下,牛奶中抗生素残留浓度降到MRL水平的时间为2~5天。
3.3 干乳期乳房处理
干乳期的处理非常特别,因为这段时间不产奶,在最初哺乳期的生理恢复中,药物的本性和制剂的形式对干乳期处理有显著的影响。某些治疗后残留的抗生素可能持续在乳头中2个月(不挤奶),最终在第一次挤奶中随着初乳排出。
4 牛奶中抗生素的检测方法
4.1 四类方法
目前有4类不同的检测抗生素的方法,这些方法相继出现于过去的几十年中。①微生物检测法(例如Delvotest®),其基础是用细菌是否被抗生素抑制来检测抗生素是否存在。这类检测方法通常检测的是多种抗生素的接近于MRL(最大残留极限)的极限值,属于定性检测(根据一个已知的极限值判定有或无抗生素)。②快速检测法,运用了多种不同的技术,在几分钟内就能检测出是否含有某一类抗生素,但不定量。使用最多的是针对β-内酰胺类抗生素的检测法,但是也有类似的针对四环素类或其它类型抗生素的检测方法。③特异性检测法,运用HPLC(高效液相色谱)等技术,检测特定的分子并进行定量。这类方法有可能同时检测几种预定的分子。④鉴定并定量的方法,目前正在出现,基于LC-MSMS(液相色谱和质谱)等原理。这类方法通常是作为快速筛选检测后的验证手段。
4.2 微生物检测法
微生物检测法与某些快速检测法一样,可以由非专业人士操作(农场主、货运司机等),而其它检测方法都只能在相应的实验室由专业的技术员操作。微生物检测或快速检测法成本只有几欧元,而其它方法检测一个待测分子的成本需要100欧元左右。
这类微生物检测方法非常容易使用,已经“工业化”并已大规模地应用于各种场合,如在分析原料奶的实验室,在乳品企业的实验室,甚至在农场中。
这些检测方法具有如下特点:①具备检测到多种分子存在的能力,其反应是基于这种物质对细菌繁殖的影响;②从一种分子到另外一种分子具有不同的灵敏度,这个灵敏度(检测极限)也依赖于所选择的细菌对不同抗生素的灵敏性;③可能的“附加”作用,不同的抗生素同时存在可能导致对测试细菌有附加(甚至是协同)作用。
到目前为止,使用最普遍的微生物检测法是Delvotest®(DSM)和BrTest。几乎所有这些方法都是使用同一种细菌:嗜热脂肪芽孢杆菌(Bacillus stearothermo-philus) 。也有几种方法用的是其它细菌,如Valio’s T101使用的是乳酸链球菌(Lactic Streptococci)。某些国家为了提高某些分子的灵敏度,使用一“组”菌,每一种菌对不同的待测抗生素敏感性不同,在不同的培养皿中同时使用,可以检测到更多的分子并能够提供一个初步的方向。但是在非正常奶中存在的天然抑制剂可能会导致阳性结果,对于来源于患有乳腺炎的奶牛的牛奶或初乳尤其如此。
4.3 快速检测法
对这类检测方法的定义是从其性能角度出发的,而不是根据其所用的各种技术。事实上,所有这些检测方法都可以在几分钟内出具结果(有或无),一般都是针对某一类抗生素。这类测试通常在其它测试之前使用,用于“卸载测试”:收奶车卸载之前进行测试,结果为阴性才可以卸载,结果为阳性则一般截住奶车并进行新的测试。
大多数情况下,这类测试仅用于检测β-内酰胺类抗生素,这主要有2个原因:①这一类抗生素是养殖场中最经常使用的抗生素;②这类抗生素能够污染大量的牛奶。
最常用的快速检测β-内酰胺类抗生素的方法是,① Penzym:酶比色法,酶(DD羧肽酶)的活性被存在的β-内酰胺类抗生素抑制;②Delvo-X-Press BL:免疫-酶法,基于比色法测量多余的特定试剂的含量,在有β-内酰胺类抗生素存在的情况下,形成“β-内酰胺-示踪剂”复合物,因此,能够在反应管壁上沉积的游离示踪剂的数量就相应下降;③Betastar:该测试是基于利用与金粒子相联的特异性受体,受体在条带上的迁移情况各不相同,这取决于其是否与β-内酰胺类抗生素结合;④Snap:利用免疫酶法,受体可以与抗生素(如果存在的话)结合,或者与固定在测试管表面的抗生素结合;⑤Charm II:一种运用介于待测分子和C14或H3标记分子之间的竞争性免疫反应的分析仪,这是一种通过测量放射能的竞争性测试,需要较大的投资。
4.4 物理化学检测法
4.4.1 色谱、紫外-可见和荧光检测法
这类检测法在20世纪80年代借助电子学和信息技术的进步发展起来,使得性能越来越好的高效液相色谱(HPLC)、紫外-可见检测系统和荧光检测系统得以发展。这类方法的检测限非常低:得到的结果可以决定样品与最大残留极限(MRL)的一致性。这些方法的局限就是它们的测量范围太小,有多少类抗生素就需要多少种方法。某些抗生素在紫外区没有吸收,因此难以鉴定。
4.4.2 液相色谱和质谱联用
20世纪90年代初,液相色谱(LC)和质谱(MS)联用整合了液相色谱的分离能力和质谱的结构信息分析能力,这些新技术(“热喷雾”、“质子束”)使得没有紫外吸收的分子(如红霉素)也能够定量。液相色谱和质谱检测器联用技术在20世纪90年代中期得到了进一步提高。新技术的出现大大拓宽了液质联用技术的应用领域。LC-MS和LCMS-MS技术的优势可以证明官方的兽药残留控制实验室的常规分析是可靠的。
4.4.3 官方方法、跨行业方法和专有方法
重要的是根据目的而不是性质来区分这些方法。官方方法指的是被一个或一些国家为实现食品监管认定的用于检验或监督目的的方法。比如,法国检测牛奶中抑制剂的官方方法包含2个步骤:首先用酸化试验(用嗜热链球菌)筛选,再用3种培养皿(蜡状芽孢杆菌、嗜热脂肪芽孢杆菌、巨大芽孢杆菌)的验证筛选。跨行业方法指的是被一组供应商(牛奶生产商)和一组购买商(乳品企业)同时认可的方法。因此它们属于协议方法,以此可以调整检测极限与最大残留极限(MRL)之间的差异。这些分析最主要的是确定牛奶的价格。专有方法是一个公司内部或者一个供应商和一个客户之间使用的方法(如控制原料接收、终点控制等)。
4.5 抗生素残留检测和天然抑制剂
上述微生物检测方法包含了对细菌在待测基质(牛奶、肉、鸡蛋)上的繁殖能力的衡量,而这些细菌可能对这些待测样品中天然存在的一些抑制剂敏感。
对于牛奶来说,当牛奶中含有天然抑制剂时有必要考虑以下2种情况。一是初乳。在小牛出生后最初几天内分泌的牛乳,含有与牛奶大不相同的成分:高含量的免疫球蛋白,存在多种白细胞。一些研究表明,对于初乳的测试可能导致假阳性结果。然而,这种情况主要是对于某一头奶牛而不是整个牛群。因此,对于残留量检测,最好是采用小牛出生4天后的牛奶。需要提醒的是,在法国,初乳期是7天。对于干乳疗法,在短干乳期或流产的情况下,抗生素残留的现象会持续几天,甚至几个星期。这就是为什么在短干乳期的情况下,小牛出生后奶牛必须要有至少14天的停药期。
二是乳腺炎。在这种情况下,分泌的乳汁确实含有大量的来源于血液的细胞(白细胞)和其它物质,这也会导致假阳性结果(不存在抗生素)。常常被问及的问题是,存在抗生素的情况或者乳腺炎临床症状不明显的奶牛的牛奶不呈现假阳性结果。研究表明,除非细胞变异程度很高,否则假阳性的情况是极其少见的。对于牛奶,由天然抑制剂导致的不正确结果不能错当成是由保存不当的样品导致的。
5 牛奶污染风险分析
5.1 污染力
一种抗生素与另一种抗生素的最大残留极限(MRL)相差很大。因此,对于牛奶,兽药上常用的2种抗生素青霉素和四环素的比例是1:25(分别是4μg/kg和100μg/kg)。这意味着等量的青霉素在相同的MRL水平,能够污染的牛奶是四环素的25倍。因此,1g青霉素能够污染最多250吨牛奶,而相同量的四环素只能最多污染10吨牛奶。然而乳房内或常规途径治疗所用的不同抗生素的剂量都差不多。也就是说,MRL很低的抗生素,如青霉素,比 MRL高的抗生素能够污染的牛奶要多得多。
5.2 最常用的抗生素
如前所述,牛奶中最主要的抗生素风险是由乳房内治疗和常规治疗(注射)导致的,主要是β-内酰胺类抗生素,尤其是对于干乳疗法。在某些国家,如法国,乳腺炎治疗使用“非β-内酰胺类”药物的比例很高,这意味着非β-内酰胺类分子残留的风险较高,因此,仅仅检测β-内酰胺类的策略非常危险(最常用的抗生素会检测不到)。然而,根据前面的叙述(“非β-内酰胺类”治疗污染大量牛奶的几率很小),首先检测大罐奶中的β-内酰胺类抗生素也是合理的。不同抗生素在乳品工业风险极限水平上能够污染的牛奶数量的比较如表3所示。不同乳房内抗生素治疗的理论污染力如表4所示。
5.3 奶牛养殖场残留来源的主要问题
5.3.1 意外或者不遵守规则
将由于意外导致的和不遵守规则导致的问题区分开来是可能的。意外是指错把治疗中或停药期的奶牛的牛奶倒入了农场的储奶罐。这类意外的发生提出了对可能含有高于MRL抗生素的“危险”奶牛的标识和管理问题。不遵守规则是指对相关知识的缺乏(信息缺乏)或者操作不当(农场主常常低估这样做的后果)。
5.3.2 乳房内治疗的主要风险
所有的研究都证明,大多数牛奶中抗生素残留的情况都与乳房内治疗有关。在这种情况下,高浓度的抗生素直接注入到了乳房内。
哺乳期内临床乳腺炎的乳房内治疗风险最高(根据大多数调查,风险大于50%)。抗生素残留很高,事故发生的可能性很大,因为患病奶牛和其它正常泌乳的奶牛是在一起的。
干乳疗法也是危险的。治疗时使用的剂量很高,因为为了保住乳房,4个乳头都同时用高剂量的抗生素治疗。如果在晚上不小心挤了早上干奶治疗过的奶牛,可能会导致污染成百上千吨牛奶。而且,农场主有时候会忘了某些抗生素在整个干乳期间(通常是8周)是持续存在的,并且会转移到初乳中,然后转移到一段时间内分泌的牛奶中,这段时间的长短取决于所用的药物,对于短干乳期尤其如此。对某些抗生素来说,已证明在短干乳期(4周以内),牛奶中的抗生素含量在小牛出生10~15天后仍然高于MRL值。
5.3.3 任何抗生素治疗,不论哪种给药途径都能够成为污染的来源
调查和科学研究证明,不论哪种治疗途径,抗生素都可能转移到牛奶中。因此,常规途径的给药(皮下、肌肉和静脉内)是牛奶污染的一个重要起因。因而预防的途径就是要考虑所有类型的治疗方法。注意一次简单的皮下治疗可能是牛奶中抗生素残留的来源。
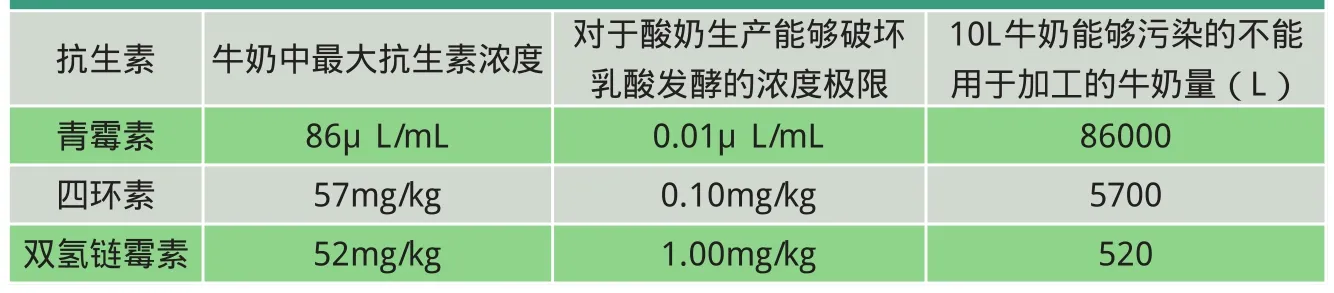
表3 不同抗生素在乳品工业风险极限水平上能够污染的牛奶数量的比较

表4 不同的乳房内抗生素治疗的理论污染力
6 通常的预防措施和抗生素的控制使用
6.1 控制抗生素的使用
抗生素是养殖场健康管理中治疗疾病时优先使用的一种工具,在任何情况下,抗生素都不能代替不完全的养殖措施,卫生和畜牧措施依然是首要的。最有效的降低抗生素风险的方法是降低抗生素的使用,尤其是要尽可能用好的预防措施来避免使用抗生素。当将患病的和健康的动物分开是不可能的时候,可以运用大规模治疗,它是对同一批中的所有动物进行治疗。只有进行了专门的风险分析,对相关的动物群、风险期和传染性都做好了精确的标记,预防性的抗生素使用才是可接受的。必须在细菌感染被初步猜测或进一步诊断(比如发展成病毒感染)之后,抗生素才能使用。兽医必须在察访农场的时候收集临床信息,以便于确定使用哪种抗生素。分析农场记录、收集流行病学信息,进行补充检查有助于更好地了解养殖场的情况,这也有助于兽医推测细菌感染情况并确定措施,只有当真正需要时,才会运用相应的抗生素治疗。细菌鉴别是一种可选的补充性检查,可以确认抗生素治疗的必要性,并有助于选择合适的抗生素。抗菌谱能够指明哪一种分离的细菌对抗生素敏感,这样就可以调整紧急治疗的方法并可以运用到其它养殖场。这是选择抗生素的因素之一,但不是仅此一个。而且,突出可能产生的抗生素耐药现象,能为流行病监管网络提供宝贵的信息。兽医选择的抗生素必须对致病细菌有药效,含有抗生素的药物必须以足够的浓度注入到感染部位。这些数据能给兽医提供重要而切实的见识,因此对于他们来说是最基本的知识。兽医们通过在合适的时间选择合适的抗生素,努力减少抗生素使用,以此降低残留的风险。
实际操作中,建议使用抗菌谱较窄的抗生素,以保证较高的效力,并降低对共生菌的选择压力。新一代的抗生素必须合理有效且用量小,例如,青霉素G,一种老式的抗生素,但对乳房链球菌(Streptococcus Uberis)这样的细菌仍非常有效。抗生素联用必须适度并符合协同和附加作用规则。
6.2 使用抗生素并避免残留的风险
必须遵照产品上市许可所规定的使用说明。该文件是针对作用对象、适应症和剂量的。必须小心地按照剂量、治疗频率、治疗期和治疗途径使用。只要有一个参数被改变,如果没有预先咨询兽医的话,就不可能正确地应用停药期。兽医可以根据“层叠”法则,在标准停药期的基础上,重新固定一个新的停药期(对于重复用药的情况),并能够科学地维持这个新选择,以保证动物源食品不含有抗生素残留。在任何情况下,兽医都得负起责任。遵守治疗途径对于保证抗生素的良好扩散和控制残留风险是十分重要的。
抗生素标签外的使用(也就是说修改了权威机构提供的使用条件)只有在例外的情况下才能发生。实际上,例外的情况应该仅限于所谓的“罕见“微生物(这表示市场有限,实验室不会去为此开发一个专门的方案)和零星的使用说明(因为有些感染的发生几率很小,所以不是整个范围的抗菌谱都被测试过,这造成了相关的官方使用说明的缺失)。在任何情况下,标签外的使用都必须符合“层叠”决策树,使用决策树时要按照时间顺序排列所描述的步骤。在欧洲,使用的物质必须是记载在2377/90(MRL)法规的附录I、II、III中的,并且必须遵守标准的停药期(对牛奶和鸡蛋至少7天,对肉而言至少28天)。在这方面尤其要注意不要偏离规定的停药期,否则对于风险预防可能是有害的。
处方单会列出相关药品并告知农场主施用方法,而且会修改停药期,在修正过的停药期内,动物源的食品都不能上市。处方以处方单的形式开出,必须要跟养殖人员解释清楚,以保证遵守治疗方法和停药期。另外,可追踪性也是一个关键因素,很多国家规定农场主必须保留处方,如在法国,养殖户需保留处方5年,兽医需保留处方10年。
6.3 农场记录:监控药物使用的关键要素
在大多数国家,农场主和兽医都必须在农场记录簿上记录他们对动物的处置。起初这一要求被看作是一种束缚,但现在正逐渐成为许多农场主和兽医们的一个不可替代的牧群健康指标。符合法规要求的记录要包含农场主的预先评估和兽医的医学评估。治疗方案的实施、警示限值的定义和必要的跟踪查访都要基于上述记录。显然数据的电脑化可以使分析变得更简单,相关性和精确性也会更好。

