人心肌肌钙蛋白I的原核表达与纯化
孙牧男,刘 磊,许淑芬,方艳秋,谭 岩
(吉林大学第一医院中心实验室,吉林长春130021)
心肌肌钙蛋白作为诊断急性心肌梗死(AMI)及心肌损伤两类重要心血管疾病的重要指标[1,2]成为近些年国内外研究的热点,相关研究发现心肌肌钙蛋白在鉴定急性心肌梗塞(AMI)溶栓治疗后再灌注是否成功、非ST段抬高急性冠脉综合征危险分层,病毒性心肌炎诊断,预测心衰死亡,识别具有短期内死亡和不良事件的高危急性肺梗死患者等临床领域具有重要作用。
人心肌肌钙蛋白(human cardiac troponin,hcTn)是一种与心肌收缩有关的调节蛋白,由TnI、TnT、TnC 3个亚单位组成。cTnI为可编码209个氨基酸的蛋白质[3],相对分子量约29 kD,等电点9.87。cT-nI分子质量比较小,对心肌损伤很敏感,当心肌细胞膜的完整性受破坏,cTnI先从胞浆内释放,“微型心肌损伤”cTnI即可出现阳性结果,而与cTnT及cTnC亚单位结合的cTnI相对分子质量大,从心肌细胞缓慢持续的释放,持续时间可达7-10 d[4]。由于cTnI可以较早出现在血中,且持续时间长,故检测心肌型肌钙蛋白I(cTnI)可以作为早期监测急性心肌损伤的标志性蛋白[5]。
尽管cTnI对心肌细胞有高度特异性,但由于难以找到通用的校准品,各厂家的cTnI检测不一致。本研究用基因工程方法在原核表达系统中获得高效表达的人重组cTnI蛋白,为进一步制备高质量抗体及建立相关临床检测方法奠定了实验基础。
1 材料与方法
1.1 试剂 大肠杆菌JM109、M15[pREP4]、原核表达质粒pQE30由本室保存。pGEM-T easy载体购于美国promega公司,各种内切酶和T4 DNA连接酶均为TAKARA公司产品。质粒提取试剂盒、DNA凝胶回收试剂盒均为Vitagene公司产品。镍离子亲和层析柱(Ni2+-NTA)购自Qiagen公司。生物素标记的马抗小鼠IgG及辣根过氧化物酶标记的亲和素均购自北京鼎国生物公司。BCA蛋白检测试剂盒购自PIERCE公司。抗hcTnI单克隆抗体购自Santa Cruse公司。化学试剂均为国产分析纯。
1.2 方法
1.2.1 RT-PCR扩增hcTnI基因 TRIZOL试剂从人心肌组织中提取总RNA。紫外分光光度计测RNA的OD值并计算含量,根据promega公司AMV逆转录酶使用说明书操作逆转录合成单链cDNA,以人心肌基因组 cDNA为模板进行PCR。上游引物P1:5′-TAAGGA TCCATG GCGGACGGTAGCAGC-3′;下游引物 P2:5′-GCGTCGACCTAGCTCTCAAACTTCTTC-3′,其中上游和下游引物分别加入BamHⅠ和SalⅠ酶切位点(划线部分)。94℃预变性5 min;94℃变性1 min,55℃退火1 min,72℃延伸 1 min,共 35个循环 ;72℃延伸10 min。1%琼脂糖凝胶电泳鉴定并回收PCR产物。
1.2.2 hcTnI基因测序鉴定 将回收的PCR产物与pGEM-T easy载体4℃过夜连接后转化大肠杆菌感受态JM109,进行蓝白筛选。挑选白色单菌落,在LB(Amp+)培养液中扩增后提取质粒,用BamHⅠ和SalⅠ双酶切和 PCR鉴定初筛阳性克隆菌株,TAKARA公司测序。
1.2.3 重组表达载体的构建和鉴定 将测序正确的重组克隆质粒pGEM-hcTnI与原核表达质粒pQE30均用BamHⅠ和SalⅠ双酶切和凝胶回收处理,切取的目的基因片段通过T4 DNA连接酶插入pQE30构建重组表达质粒pQE30-TnI,并转化大肠杆菌感受态M15,挑选单菌落,在 LB(Amp+,Kana+)培养液中扩增后提取质粒,进行PCR鉴定,筛选带有插入片段的克隆。
1.2.4 hcTnI重组蛋白的诱导表达 将转化的大肠杆菌M15接种于LB(Amp+、Kana+)固体培养基37℃过夜培养,挑选4个振摇重组菌单菌落分别接种于5 ml LB(Amp+、Kana+)液体培养基,37℃、160 r◦min-1振摇过夜 ,次日以 1∶50 接种于 1 L LB(Amp+、Kana+)液体培养基中,37 ℃,230 r◦min-1振荡培养至A600=0.6左右,加入终浓度为1.0 mmol◦L-1的IPTG,继续振摇诱导表达5 h,收集少量菌液并同高速离心后菌液沉淀进行SDS-PAGE电泳确定稳定表达菌株。
1.2.5 hcTnI蛋白的免疫鉴定 选择高表达目的蛋白的菌株,诱导表达hcTnI蛋白,进行SDS-PAGE及Western blot。用半干式转移电泳仪电转硝酸纤维素膜2 h,3%BSA 封闭液 4℃过夜,1×PBS洗膜 ,加入鼠抗人TnI单抗(1∶1 000),37℃结合 2 h,洗膜 ,加入马抗小鼠 IgG(1∶1 000),37℃结合 2 h,洗膜,加入辣根过氧化物酶标记的亲和素(1∶1 000),37℃结合2 h,充分洗涤后DAB显色鉴定表达产物。
1.2.6 重组TnI包涵体的提取及纯化 诱导1 000 mL阳性表达菌液,离心收集菌体沉淀,超声裂解菌体,离心得到的蛋白包涵体用变形裂解缓冲液重悬,4℃过夜变性至溶液清亮后经镍凝胶亲和层析法纯化,SDS-PAGE电泳鉴定。
1.2.7 BCA法测定重组TnI表达量 变性后的包涵体上清SDS-PAGE电泳图像经凝胶电泳图像分析仪扫描得到TnI相对含量。应用BCA蛋白检测试剂盒在562 nm可见光下测定标准蛋白(BSA)和纯化的hcTnI的OD值,绘制BSA蛋白标准曲线,确定其纯品浓度。
2 结果
2.1 RT-PCR获得目的基因 将PCR产物进行琼脂糖凝胶电泳,可见约633 bp的片段,大小与(GeneBank M64247)公布的人心肌肌钙蛋白基因一致。

图1 TnI PCR产物的琼脂糖凝胶电泳
2.2 hcTnI的测序鉴定 重组质粒pGEM T-hcTnI经BamHⅠ和SalⅠ双酶切后可见约3 000 bp和633 bp大小的片段,PCR产物大约为633 bp与预期的大小一致。测序结果显示与GeneBank上基因序列一致。
2.3 重组表达载体的构建和鉴定 以重组表达质粒pQE30-hcTnI为模板进行PCR鉴定,可获得大小约为633 bp基因片段,证明hcTnI基因已连接到表达载体pQE30中。
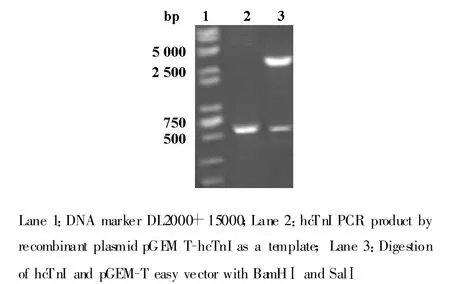
图2 pGEM T-hcTnI质粒酶切和PCR鉴定
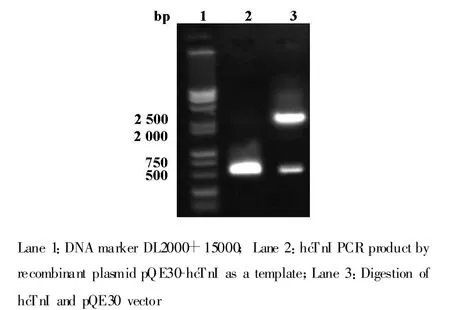
图3 pQE30-hcTnI 质粒酶切和PCR鉴定
2.4 重组蛋白的表达及纯化 含重组表达质粒pQE30-hcTnI的大肠杆菌M15经1 mmol◦L-1IPTG诱导后可表达一条相对分子量约29 KD的蛋白,表达量约占菌体总蛋白的28.7%,主要以包涵体形式存在,SDS-PAGE结果见图4。镍柱亲和层析后获得纯度较高的hcTnI蛋白结果见图5。
2.5 Western blot杂交 将纯化的蛋白进行SDSPAGE电泳后进行Western blot印迹,在相对分子量约为29 KD处可见特异性着色带,初步证实所表达的蛋白是带六个组氨酸的融合蛋白,结果如图6。
2.6 BCA法蛋白定量 BCA法测定纯化后的hcT-nI蛋白在562 nm下吸光度为0.223 7,根据标准曲线可知蛋白含量为233.5 mg◦L-1,结果如图7。
3 讨论
cTnI为心肌损伤敏感性和特异性最强的标志物之一,但是,目前临床检测cTnI的试剂盒多为进口产品,价格昂贵。采用传统的方法,获取人心肌样品,从心肌组织中分离、纯化cTnI过程非常复杂且产量有限,而基因工程技术提供了方便高效的蛋白制备方法。

图4 hcTnI蛋白在大肠杆菌M15中的表达

图5 hcTnI蛋白纯化的 SDS-PAGE分析

图6 hcTnI蛋白的 Western blot ting印记分析
本实验通过Qiagen的pQE蛋白表达系统成功构建了原核表达载体pQE30-hcTnI,在大肠杆菌M15中经IPTG诱导后高效表达相对分子量约为29 KD的hcTnI蛋白,hcTnI蛋白约占菌体蛋白的25%左右。该蛋白主要以包涵体形式存在,所表达的融合蛋白带有6个组氨酸标签,这6个组氨酸没有免疫原性,在pH8.0时最小,不带电荷,一般不影响分泌或融合蛋白的折叠。一般情况下,组氨酸不干扰重组蛋白的结构和功能,并且有利于应用镍凝胶亲和层析对重组蛋白进行纯化。
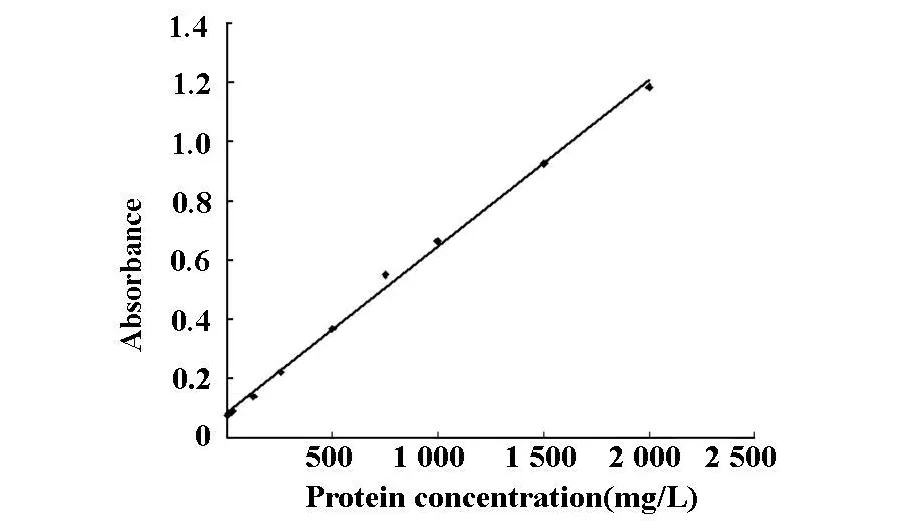
图7 BCA法蛋白定量分析
天然cTnI很不稳定,易被蛋白水解酶迅速降解[6]。我们的研究发现,重组蛋白在表达时,即使形成了结构致密的包涵体,也会有部分降解,即使在下游的处理过程中加入蛋白酶抑制剂,低温条件下重组cTnI蛋白在一周以后依然出现降解现象。提示对于重组cTnI蛋白制备需要在纯化过程保持低温环境条件,定时补充PMSF、DTT等蛋白酶抑制剂和纯化后蛋白及时用于免疫。
本实验获得的大量纯化hcTnI蛋白主要以包涵体形式存在,经Western blotting检测证明抗体特异性良好。重组人心肌肌钙蛋白的成功克隆、高效表达与纯化将为下一步制备单克隆抗体,研制cTnI检测试剂和早期诊断AMI奠定基础。
[1]Chang AM,Maisel AS,Hollander JE.Diagnosis of heart failure[J].Heart Fail Clin,2009,5(1):25.
[2]McDonough JL,Van Eyk JE.Developing the next generation of cardiac markers:disease-induced modifications of troponin I[J].Prog Cardiovasc Dis,2004,47(3):207.
[3]靳彩宁,徐国宾,朱立华,等.人心肌TnI的生物学特性测定及其在临床诊断中的应用[J].临床检验杂志,2002,20(2):18.
[4]Maynard SJ,Menown IB ,Adgey AA.Troponin T or troponin I as cardiac markers in ischaemic heart disease ,2000 ,83(4):371.
[5]Di Serio F,Trerotoli P ,Serio G,et al.Analytical evaluation of an automated immunoassay for cardiac troponin I:the Vidas Troponin I assay[J].Clin Chem Lab Med ,2003 ,41(10):1363.
[6]Panteghini M,Bunk DM,Christenson RH,et al.Standardization of troponin I measurements:an update[J].Clin Chem Lab Med,2008,46(11):1501.
- 中国实验诊断学的其它文章
- Caspase-8信号事件对免疫反应的活化调节作用

