水剂法提取花生油中的破乳研究
章绍兵,吕燕红,胡 玥,汪 乔
(河南工业大学粮油食品学院,河南郑州 450052)
水剂法提取花生油中的破乳研究
章绍兵,吕燕红,胡 玥,汪 乔
(河南工业大学粮油食品学院,河南郑州 450052)
对于水剂法提取花生油过程中形成的乳状液,分别采取酶法和化学方法进行破乳研究.结果发现,碱性蛋白酶 2709和 NaCl都可以有效破乳.碱性蛋白酶 2709的最佳破乳条件是:温度 55℃,pH 8.5,加酶量 1 120 I U/g,时间 1 h;NaCl的最佳破乳条件是:温度 55℃,添加量5%(W/W),时间 1 h.在此条件下,乳状液的破乳率均可达到或超过 95%.
水剂法;花生;破乳;蛋白酶
0 前言
花生富含油脂和蛋白质,是世界食用油、蛋白质及食品原料的重要来源.我国是世界上重要的花生生产国之一,2008年全国花生总产量约为1 360万 t,花生油的年产量约为 188.6万 t,约占全球花生油年产量的 37%[1].目前,工业制取花生油的主要手段是压榨 (以热榨为主)或溶剂浸出.由热榨和浸出法得到的花生粕目前主要作为饲用.在植物蛋白质中花生蛋白质营养价值仅次于大豆蛋白质,但抗营养因子含量要比大豆的少[2].因此,充分开发和利用花生蛋白质,对于弥补当前食品蛋白质资源的不足具有重要意义.由现行制油工艺无法直接得到花生蛋白质,而通过花生粕提取蛋白质往往也因为粕曾受过高温处理,难以获得理想的得率.
水剂法 (也称为水溶法)制油工艺研究从上世纪 50年代开始于花生[3],之后又发展到其他各种含油原料[4-6].该法最大的特点是可以同时从油料中提取油和蛋白质.但由于在制油过程中会形成大量的乳状液 (O/W),严重影响到游离油的分离,这也是制约该工艺推广应用的“瓶颈”.为提高水剂法制油工艺的油脂得率,对乳状液进行破乳是必需而且可行的,目前已报道的破乳手段主要有加热[7]、冷冻解冻[8]、转相法[9]和高速离心[10]等.这些方法尽管可以有效破乳,但因为能耗大难以在大规模生产中推广应用.酶法破乳是美国爱荷华州立大学正在研究的一种新型生物破乳方法,对于大豆水剂法制油过程中形成的乳状液,已发现碱性内切蛋白酶 Protex 6L具有良好的破乳作用[11-12].此外,Zhu等[13]发现食盐和乙醇也能不同程度地破坏水剂法制取海胆性腺油形成的乳状液.为了完善水剂法制油技术以及加快其工业化应用进程,对这些新型低耗能破乳方法进行研究,无疑具有重要的意义.
作者以花生水剂法制油过程中产生的乳状液为研究对象,筛选适合花生乳状液破乳的酶种,优化酶法破乳的工艺条件,同时还对花生乳状液进行了无机盐破乳试验.
1 材料与方法
1.1 材料
花生仁 (水分 3.77%,蛋白质 29.64%,粗脂肪 46.80%):市售.
Protex 6L碱性蛋白酶:杰能科 (无锡)生物工程有限公司赠送,最适 pH 7.0~10.0,最适温度30~70℃,实测酶活 265 882 I U.Alcalase 2.4L碱性蛋白酶:诺维信 (中国)生物技术有限公司,最适 pH 8.0~10.0,最适温度 40~60℃,实测酶活280 800 I U.2709碱性蛋白酶:北京东华强盛生物技术有限公司,最适 pH 9.0~12.0,最适温度 40~50℃,实测酶活 112 000 I U.1398中性蛋白酶:北京东华强盛生物技术有限公司,最适 pH 6.5~7.5,最适温度 35~45℃,实测酶活 89 411 I U.
氯化钠、无水氯化钙 (分析纯):天津市科密欧化学试剂有限公司;其他试剂均为分析纯.
1.2 主要仪器与设备
A—88组织均浆机:江苏金坛医疗仪器厂;胶体磨:温州市天宏轻工机械有限公司;SHA—C水浴恒温振荡器:巩义市予华仪器有限责任公司;LD5—10离心机:北京医用离心机厂;DW—1恒速搅拌器:巩义市予华仪器有限责任公司;GL—20G离心机:上海安亭科学仪器总厂.
1.3 方法
1.3.1 水剂法提取花生油的工艺流程
工艺流程如图 1所示.
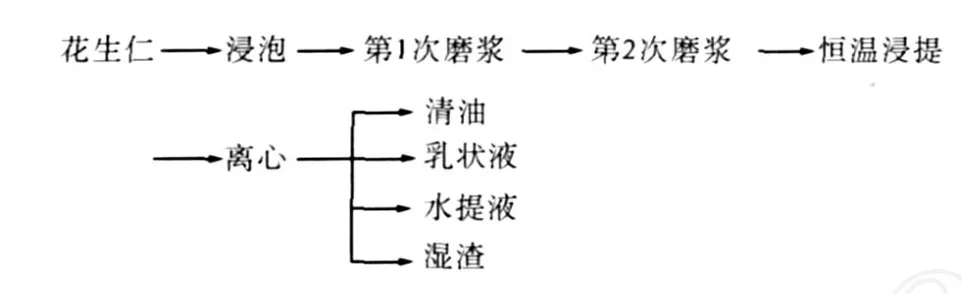
图1 水剂法提取花生油的工艺流程
具体操作方法:
浸泡:将适量花生仁和蒸馏水按 1︰ 10浸泡12 h.
第 1次磨浆:使用组织均浆机对花生进行初步粉碎.
第 2次磨浆:使用胶体磨对花生进一步粉碎,调节磨头间隙为 50μm.
浸提:将适量花生浆转移至具塞锥形瓶中,用4 mol/L NaOH调节体系 pH值为 10.5,放入水浴恒温振荡器中,55℃下振荡 1 h.
离心:将物料转移至离心机中进行离心(4 000 r/min,15 min).
取乳状液:用吸管吸出上层少量清油;再用小勺取出乳状层,放入烧杯中 4℃冷藏备用.
1.3.2 乳状液破乳
取适量乳状液放入 50 mL离心管中,再将其置于恒温水浴锅中 (55℃),调节好相应 pH后添加酶制剂或无机盐,使用恒速搅拌器搅拌一定时间后,再进行离心分离 (4 000 r/min,10 min),用吸管吸出上层清油,称重.
破乳率 =清油质量∕乳状液含油量 ×100%.
1.3.3 测定方法
花生仁和乳状液水分含量的测定:直接干燥法,参照 GB/T 5009.3-2003;花生仁和乳状液粗蛋白含量的测定:凯氏定氮法,参照 GB/T 5009.5-2003;花生仁和乳状液粗脂肪含量的测定:索式抽提法,参照 GB/T 5009.6-2003.先将乳状液真空干燥后再进行脂肪含量测定.
1.4 数据统计与分析
在蛋白酶的筛选和无机盐破乳试验中,结果以两次以上试验的平均值表示,并使用 SPSS 13.0 forW indows软件进行单因素方差分析,P<0.05代表差异显著.
2 结果与讨论
对于水剂法提油工艺,原料研磨是非常重要的工序.采用干法研磨虽然可以显著减少乳状液的形成,但若磨细花生耗能较高;采用湿法研磨则容易达到提油的粒度要求,但乳化程度严重,需要配套适合的破乳技术.蛋白质被认为是贡献该种乳状液稳定性的关键因素[14].油料细胞中的油小体在天然状态下表面被油体蛋白膜覆盖,虽然经过研磨后部分油体蛋白膜被破坏,但在搅拌浸取过程中水相中游离的蛋白质分子,也趋于吸附到油水界面上,从而形成稳定的乳状液.通过对本试验条件下形成的多批花生乳状液成分进行分析,发现其中油的比例占 55%~66%,RSD值为6.50%;蛋白质含量为 0.9%~1.7%,RSD值为29.69%;水分含量为 28%~37%,RSD值为11.65%.
2.1 蛋白酶的破乳效果
为了能够显著降低蛋白质分子质量,选择的均是细菌内切蛋白酶,不同蛋白酶的破乳效果见图2.
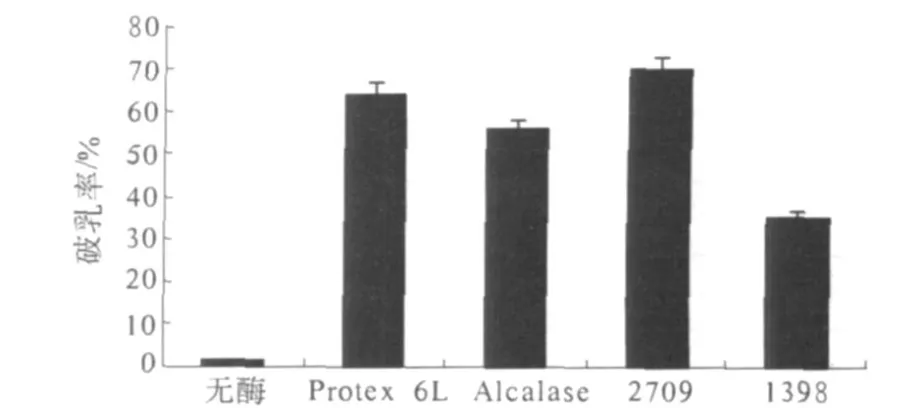
图2 不同蛋白酶的破乳率
由图 2可以看出,与对照组相比,往花生乳状液中添加不同种类的内切蛋白酶均可在不同程度上破乳.其中碱性蛋白酶 2709破乳率最高(70%),对大豆乳状液有很好破乳效果的碱性蛋白酶 Protex 6L[11-12]也可以较好地破坏花生乳状液,而中性蛋白酶 1398的破乳率相对较低.
蛋白酶能够有效破乳的原因应归功于吸附在油水界面的长链蛋白质分子,经酶解后分子质量迅速变小而容易从界面脱吸.Wu等[11]分析了不同处理条件下大豆乳状液的油滴粒径,发现随蛋白酶添加浓度的增加,油滴粒径显著增大.这说明蛋白质经酶解从油水界面脱吸后,原先细小的乳状液油滴由于蛋白质界面膜发生变化而容易相互聚并,油滴数量减少而直径增大,从而有利于破乳.鉴于不同蛋白酶对花生乳状液的破乳效果存在差别,只选择蛋白酶 2709进一步进行破乳研究,期望获得更高的破乳率.
2.2 碱性蛋白酶 2709的破乳条件优化
2.2.1 pH对破乳率的影响 (图 3)
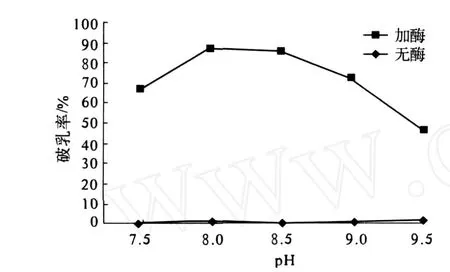
图3 pH对破乳率的影响
如图 3所示,在乳状液体系的 pH为 8和 8.5时,碱性蛋白酶 2709的破乳效果最好 (约 86%).而在不加酶的情况下,pH的改变 (7.5~9.5)几乎不影响乳状液的稳定性.这说明乳状液的破乳确实是因为酶的作用,而和 pH的变化无关.我们进一步研究了蛋白质等电点条件下乳状液的稳定性,发现将 pH调至 4和 5时,乳状液也不能破乳(不加任何酶 ).Chabrand等[12]和 Wu等[11]都曾报道在 pH4.5时,不加蛋白酶时大豆乳状液也可以较好地破乳.分析其原因,可能是因为他们在提油过程中添加了蛋白酶,乳状液的界面蛋白质分子质量较小,乳状液的稳定性由此易受 pH的影响.而在当前的提油过程中未加任何酶,乳状液的界面蛋白质分子质量大,乳状液的稳定性不易受到体系 pH的影响.考虑到碱性蛋白酶的活性,选择 pH8.5作为酶法破乳的最适 pH.
2.2.2 加酶量对破乳率的影响 (图 4)
由图 4可知,随着乳状液中酶量的增加,破乳率增加很明显,但也并非加酶越多越好.当 2709的添加量超过 1%(W/W)时,酶越多破乳效果却越差.这有可能是因为:酶本身也是蛋白质,在乳状液中添加过量,起到了增强乳化的作用,使破乳率下降.当碱性蛋白酶 2709的添加量为 1%(W/W)时,即相当于每克乳状液添加 1 120 I U活力的蛋白酶,破乳率约为 90%.

图4 加酶量对破乳率的影响
2.2.3 酶解时间对破乳率的影响 (图 5)
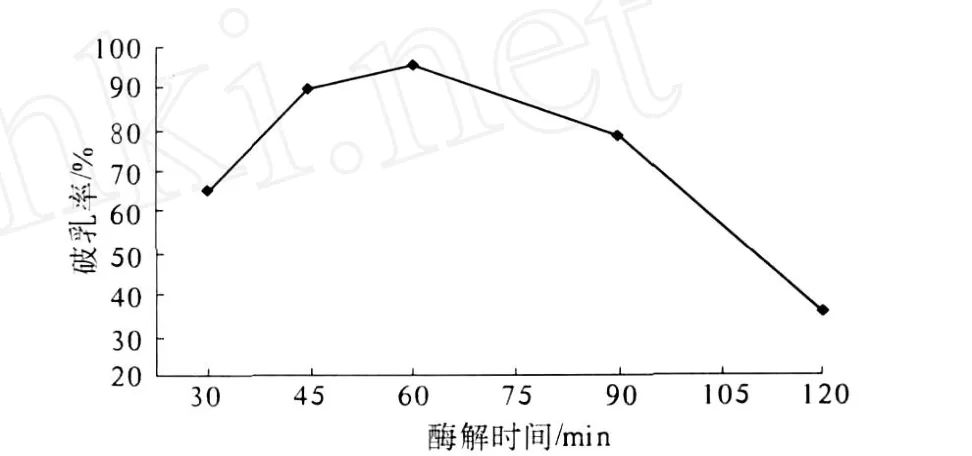
图5 酶解时间对破乳率的影响
图 5表明酶解时间为 1 h时,乳状液的破乳率最高 (95.2%).随着酶解时间进一步延长,破乳率急剧下降.说明过长时间的搅拌可能会使已脱吸的蛋白质分子重新吸附到油水界面上,从而增加了乳状液的稳定性.所以在采用 2709蛋白酶进行破乳时,时间以 1 h左右为宜.
2.3 无机盐对乳状液的破乳
乳状液的稳定性和界面电势也有关系.一般油水界面上有电荷存在时,界面两边皆有双电层和电位降.对于由蛋白质稳定的水包油型乳状液,当油滴接近到表面上的双电层发生相互重叠时,静电排斥作用将使油滴分开,乳状液保持稳定[15].而在乳状液中加入某些无机盐后,将可能会破坏稳定的蛋白质双电层结构,促使油滴之间发生聚并和破乳.为此,我们尝试了在花生乳状液中分别添加 NaCl和 CaCl2,结果发现 CaCl2几乎无破乳能力而 NaCl破乳明显.NaCl添加量对破乳率的影响见图 6.
如图 6所示,随着 NaCl添加量的增加,乳状液破乳率呈线性增加,当 NaCl添加量达到 5%(W/W)时,破乳率超过 95%.
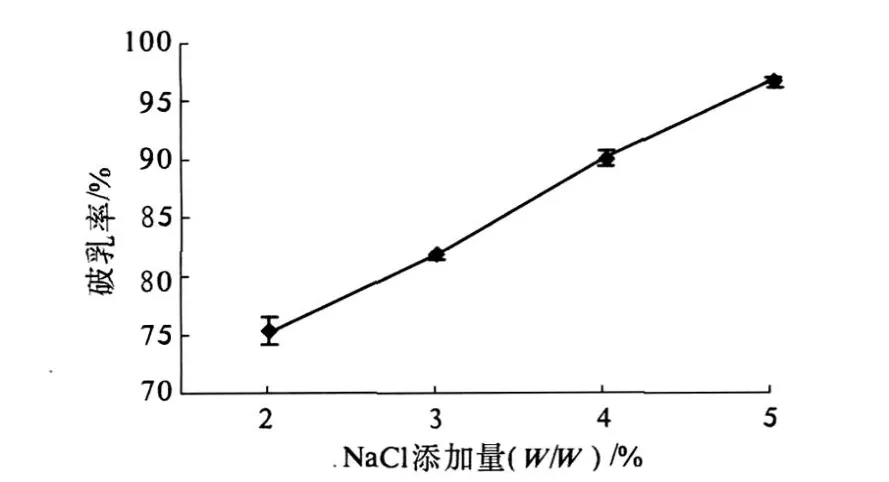
图6 NaCl添加量对破乳率的影响
搅拌时间对破乳率的影响如图 7所示,说明在乳状液中添加 NaCl后,仍需要足够的搅拌时间以保证其发挥破乳作用.与我们得到的试验结果不同,Jung等[16]在大豆水酶法提油过程中添加不同量的NaCl,结果发现游离油的得率没有获得提高.
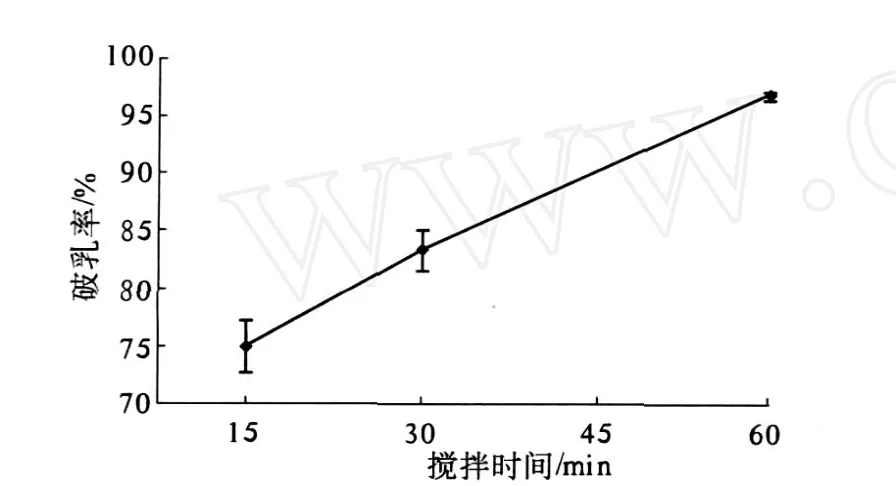
图7 搅拌时间对破乳率的影响
3 结论
对于水剂法提取花生油过程中形成的乳状液,碱性蛋白酶 2709和 NaCl都可以有效破乳.碱性蛋白酶 2709的最佳破乳条件是:温度 55℃、pH 8.5、加酶量 1 120 I U/g、时间 1 h;NaCl的最佳破乳条件是:温度 55℃、添加量 5%(W/W)、时间1 h.在此条件下,乳状液的破乳率均可达到或超过 95%.这两种低能耗破乳方法的开发将会有力助推水剂法提取花生油的工业化进程.
[1] 蒋新正.植物油料产量与消费 (3):花生和花生油[EB/OL].(2009-04-17)[2010-07-01].http://www.sciencenet.cn/m/user_content.aspx?id=226688.
[2] 刘阳,邢福国.花生蛋白的开发和利用现状[J].食品科技,2008,33(12):173-176.
[3] Sugarman N.Process for si multaneously extracting oil and protein from oleaginous materials:U.S,2762820[P].1956.
[4] Hagenmaier R.Aqueous processing of fullfat sunflower seeds:yields of oil and protein[J].J Am Oil Chem Soc,1974,51:470-471.
[5] 李瑚传,周瑞宝,钱向明,等.水剂法制取菜籽油和饲用菜籽蛋白的研究报告[J].郑州粮食学院学报,1986(2):6-15.
[6] Hanmoungjai P,Pyle L,Niranjan K.Extraction of rice bran oil using aqueousmedia[J].J Chem TechnolBiotechnol,2000,75:348-352.
[7] 李瑚传.水剂法加工花生的工艺及设备的探讨[J].中国油脂,1984(9):506-511.
[8] 王瑛瑶,王璋,罗磊.水酶法提花生油中乳状液性质及破乳方法[J].农业工程学报,2008,24(12):259-263.
[9] Dominguez H,NunezM J,Lema J M.Aqueous processing of sunflower kernelswith enzymatic technology[J].Food Chem,1995,53:427-434.
[10] Shah S,Sharma A,Gupta M N.Extraction of oil from Jatropha curcas L.Seed kernels by combination of ultrasonication and aqueous enzymatic oil extraction[J].Bioresour Technol,2005,96:121-123.
[11] Wu J,Johnson L A,Jung S.Demulsification of oil-rich emulsion from enzyme-assisted aqueous extraction of extruded soybean flakes[J].Bioresour Technol,2009,100:527-533.
[12] Chabrand R M,Glatz C E.Destabilization of the emulsion formed during the enzymeassisted aqueous extraction of oil from soybean flour[J].EnzMicrob Technol,2009,45:28-35.
[13] Zhu B W,Qin L,Zhou D Y,et al.Extraction of lipid from sea urchin(Strongylocentrotus nudus)gonad by enzyme-assisted aqueous and supercriticalcarbon dioxide methods[J].Eur Food Res Technol,2010,230:737-743.
[14] RosenthalA,Pyle D L,Niranjan K.Aqueous and enzymatic processes for edible oil extraction[J].EnzMicrob Technol,1996,19:402-420.
[15] 夏立新.油水界面膜与乳状液稳定性关系的研究[D].大连:中国科学院大连化学物理研究所,2003:3-4.
[16] Jung S,MaurerD,JohnsonL A.Factors affecting emulsion stability and quality of oil recovered from enzyme-assisted aqueous extraction of soybeans[J].Bioresour Technol,2009,100:5340-5347.
STUDY ON DEMULSIFICATI ON OF EMULSI ON FORMED DUR I NG AQUEOUS EXTRACTI ON OF PEANUT O I L
ZHANG Shao-bing,LV Yan-hong,HU Yue,WANGQiao
(School of Food Science and Technology,Henan University of Technology,Zhengzhou450052,China)
We studied the demulsification of an emulsion for med during aqueous extraction of peanut oil by enzymatic and chemicalmethods,respectively.The results indicated that alkaline protease 2709 and NaCl could effectively demulsify the formed emulsion.The opti mal demulsification conditionsof the alkaline protease 2709 were as follows:temperature 55℃,pH 8.5,enzyme concentration 1 120 I U/g and hydrolysis time 1 hour.The optimal demulsification conditions of NaCl were as follows:temperature 55℃,NaCl concentration 5%(W/W),and time 1 hour.Under these conditions,the demulsification ratio of the emulsion reached or exceeded 95%.
aqueous extraction;peanut;demulsification;protease
TS201.2
B
1673-2383(2010)05-0001-04
2010-07-08
河南工业大学博士基金项目(150339)
章绍兵 (1975-),男,安徽无为人,讲师,博士,主要从事与食品生物技术相关的教学和科研工作.

