农杆菌介导的紫色红曲霉遗传转化体系的建立和优化
蔡琪敏,蒋冬花,嵇 豪,蓝丽精
(浙江师范大学化学与生命科学学院,浙江金华 321004)
农杆菌介导的紫色红曲霉遗传转化体系的建立和优化
蔡琪敏,蒋冬花3,嵇 豪,蓝丽精
(浙江师范大学化学与生命科学学院,浙江金华 321004)
通过优化各种转化因素,建立了根癌农杆菌 (Agrobacterium tumefaciens)介导红曲霉 (M onascus)的高效转化体系:红曲霉在 PDA培养基培养 21 d后收集孢子,制备红曲霉孢子悬浮液,浓度为 106个 /mL,根癌农杆菌浓度为 OD600值 0.5,诱导剂AS浓度为 100μmol/L,农杆菌与红曲霉在 25℃共培养 3 d。采用此转化体系构建了含有 530多个转化子的红曲霉 T2DNA插入突变体库。随机选取 50株转化子菌株进行分子验证和稳定性检测,证明 T2DNA成功插入红曲霉基因组 DNA中,并能稳定遗传。最后,通过形态观察筛选出 8株变异较大的菌株,为以后的红曲霉基因功能研究奠定了一定的基础。
红曲霉;根癌农杆菌;T2DNA;突变体库
红曲霉又名红曲、红糟、红大米,真菌界、真菌门、子囊菌亚门、不整子囊菌纲、散囊菌目、红曲科[1],是我国重要的微生物资源。红曲霉在生长代谢过程中能产生很多生理活性物质,如红曲色素、Monacolin K、γ2氨基丁酸、麦角固醇、各种酶类物质等,国内外研究者对此关注较多[223]。近年来,红曲霉的研究除了集中在菌种选育及发酵工艺条件优化等方面外,分子生物学研究也逐渐起步,尤其是根癌农杆菌介导 T2DNA转化技术的引入对红曲霉相关功能基因的研究产生了巨大的推动作用。De2Groot等[4]利用根癌农杆菌转化了黑曲霉 (Aspergillus niger)、里氏木霉 (Trichodem a ree2 sei)、链孢霉 (N eurospora crassa)等 6种真菌,为根癌农杆菌介导丝状真菌的遗传转化开创了先河。根癌农杆菌介导真菌遗传转化的机理与植物相似:根癌农杆菌将T2DNA转移进植物细胞主要依赖 Ti质粒上一系列V ir基因的表达。VirA基因编码的蛋白A结合植物伤口释放的单糖和酚类物质后自身激化,其保守的组氨酸残基被磷酸化。磷酸化的蛋白A将其上的磷酸盐转化到 VirG蛋白的天冬氨酸残基上,激活 VirG蛋白。激活的VirG结合到 V ir基因启动子的特定区域,打开VirB、C、D、E、H等几个基因的表达。其中 V irD1/VirD2共同切开 T2DNA的边界区域,VirD2蛋白在切割后结合在 T2DNA的 5′端,其 C2端的 NLSs序列将 T2DNA导向植物细胞。VirC基因通过结合在 RB附近的非 T2DNA区域以增强V irD对 RB的切割效率。单链结合蛋白 VirE结合到 T2DNA单链上形成 T2DNA复合体,在 Vir B的作用下此复合体通过农杆菌细胞膜进入植物细胞后整合到植物的基因组[5]。目前,农杆菌介导转化技术在植物上应用较为广泛,但在真菌中的应用还不是很多,农杆菌介导红曲霉转化的相关研究更是鲜有报道。对红曲霉进行遗传转化和基因突变,从分子水平研究基因功能,探讨作用机理是红曲霉研究领域的发展趋势。本研究以微生物实验室保存的高产色素的红曲霉菌种 S为实验材料,通过对根癌农杆菌浓度、红曲霉培养时间、红曲霉分生孢子液浓度、诱导剂乙酰丁香酮 (AS)浓度、农杆菌与红曲霉的共培养温度、共培养时间、共培养膜类型等转化因素的优化,建立根癌农杆菌介导红曲霉的高效转化体系,构建 T2DNA插入突变体库,获得了 530株转化子菌株。随机选取 50株转化子菌株进行了分子验证和稳定性检测,证明 T2 DNA成功插入红曲霉基因组 DNA中,并能稳定遗传。最后,筛选出 8株变异较大的菌株,以期为深入研究红曲霉的基因功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 ①紫色红曲霉 (M onascus purpu2 reus)S菌株:由实验室自主分离纯化筛选得到,具有高产色素能力;②根癌农杆菌菌株 AGL1:由浙江大学农业与生物技术学院生物技术研究院王政逸教授惠赠,此菌含有卡那霉素抗性基因和潮霉素基因,双元载体为含高效启动子 trpC的 pAT2 MT1,由表达质粒 pCAMB IA 1300改造而成,其中pCaMV35S2Hph被替换为 TrpC2Hph。
1.1.2 主要试剂 乙酰丁香酮 (AS)、22(N2吗啉)乙磺酸钠 (MES)、卡那霉素、头孢霉素、链霉素、潮霉素 B均为分析纯,购于北京科百奥生物科技有限责任公司。
1.1.3 培养基 马铃薯葡萄糖培养基 (PDA)、LB培养基、诱导培养基 ( IM)、共培养诱导培养基(Co2 IM)。
1.2 方法
1.2.1 农杆菌转化红曲霉的基本步骤 根癌农杆菌介导的红曲霉遗传转化方法主要参照 De2Gro2 ot[4]和 Covert等[6]的报道进行,并做少许修改。
1.2.2 紫色红曲霉 S菌株对潮霉素的敏感性检测挑取 S菌株菌丝接种于含不同浓度潮霉素 B的PDA培养基 ,浓度分别为 0、100、150、200、250μg/mL,30℃培养 7 d后观察记录,实验重复3次。
1.2.3 各种因素对转化率影响的研究 ①根癌农杆菌浓度:在不同时间测定 IM培养基中农杆菌的 OD600值 ,使其分别为 0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8,进行转化实验 ,研究农杆菌浓度对转化率的影响;②红曲霉培养时间:将红曲霉接种于PDA培养基 ,30 ℃分别培养 7、14、21、28 d,制备分生孢子液,研究红曲霉培养时间对转化率的影响;③红曲霉分生孢子液浓度:用无菌水将红曲霉孢子分别稀释至 104、105、106、107个 /mL,进行转化实验,研究红曲霉分生孢子液浓度对转化率的影响;④诱导剂乙酰丁香酮 (AS)浓度:将 IM与 Co2 IM培养基中的 AS浓度分别增加至 60、80、100、120、140、160μmol/L,研究诱导剂乙酰丁香酮 (AS)浓度对转化率的影响;⑤共培养温度:将农杆菌与红曲霉孢子混合液均匀涂于 Co2 IM培养基上的硝酸纤维素膜 (NC膜 )表面,于 20、25、30、35 ℃共培养,研究共培养温度对转化率的影响;⑥共培养时间:将农杆菌与红曲霉孢子分别共培养 2、3、4、5 d,研究共培养时间对转化率的影响;⑦共培养膜类型:分别将农杆菌与红曲霉孢子混合液共培养在硝酸纤维素膜 (NC膜)、定性滤纸、普通纸表面,研究膜类型对转化率的影响。
1.2.4 转化子的遗传稳定性分析 将 530株转化子接种到 PDA培养基上,随机挑选 50株突变株接种到不含潮霉素 B的 PDA培养基上,30℃培养 7 d。连续转接 6次后,再转接到含 200μg/mL潮霉素 B的 PDA培养基上,同时接种出发菌株 S作为对照,30℃培养,观察菌落生长情况,计算其稳定性。计算公式如下:转化子稳定性 (%)=(潮霉素 B抗性平板上菌落数 /第 1次接种到PDA平板上的菌落数)×100%。
1.2.5 转化子的 PCR鉴定 红曲霉基因组 DNA采用 CTAB[7]法提取。根据 pAT MT1上的潮霉素基因序列设计引物 HygS1和 HygA1,序列为:5′2 ATGCCTGAACTCACCGCGAC23′,5′2CTATTCCTTT GCCCTCGGAC23′,进行 PCR扩增。反应体系 (50 μL):模板 1μL,dNTP(10 mmol/L)1μL,Mg2+(25 mmol/L)3μL,10×Taq缓冲液 5μL,引物(10μmol/L)各 1μL,Taq酶 (5 U/μL)1μL,ddH2O 37μL。扩增条件:94℃ 3 min,94℃ 20 s,58℃60 s,72℃2 min,35个循环,72℃延伸10 min。产物经 1%琼脂糖凝胶电泳检测。
1.2.6 转化子的形态学观察 将 530多株转化子接种到 PDA培养基上,30℃培养 7 d,比较突变株与出发菌株在菌落形态、颜色等方面的差异。
2 结 果
2.1 紫色红曲霉 S菌株对潮霉素的敏感性检测
将 S菌株的菌丝接种于含不同浓度潮霉素B的 PDA培养基上,30℃培养 7 d。结果显示,当潮霉素 B浓度为 150μg/mL时,红曲霉菌丝生长明显受到抑制,而当潮霉素 B浓度达到 200μg/mL时,菌丝完全不能生长。因此,本实验选择潮霉素 B的最佳筛选浓度为 200μg/mL。
2.2 各种因素对转化率的影响
2.2.1 根癌农杆菌浓度 从理论上讲,农杆菌浓度越高,接触并附着到红曲霉孢子的机会就越多,其转化效率也就越高。如图1所示,随着农杆菌浓度的升高,转化子数目相应增加。但有研究表明,农杆菌浓度越高,后续操作中农杆菌的生长不易控制,而且转化子中 T2DNA的拷贝数越高[8]。为了降低转化子中 T2DNA的拷贝数,使后续实验更易控制,选择了 OD600值 0.5为农杆菌的最适浓度。
2.2.2 红曲霉培养时间 红曲霉培养得越久,其孢子成熟度也越高,真菌孢子成熟度对转化有很大的影响。实验结果见图2,红曲霉在 PDA培养基上培养到 21天时,转化子数目最多,达到 28个 /平皿,而 28天时只有 23个 /平皿,其原因可能是红曲霉孢子过于老化,活力不够。

图1 根癌农杆菌浓度对转化率的影响Fig.1 Effect of concentration ofAgrobacterium

图2 红曲霉培养时间对转化率的影响Fig.2 Effect of culture time ofM onascus purpureus
2.2.3 红曲霉分生孢子液浓度 由图3可知,不同浓度的红曲霉孢子对转化效率有显著影响。当孢子液浓度为 106个 /mL时,转化子数目达到 25个 /平皿,因此,选择红曲霉孢子液的最佳浓度为106个 /mL。
2.2.4 诱导剂乙酰丁香酮 (AS)浓度 与农杆菌介导植物遗传转化相似,只有在农杆菌与受体细胞的共培养基中含有诱导剂 AS时,转化才能发生[5]。图4结果表明,诱导剂 AS浓度越高,转化子数目越多,尤其是 100μmol/L和 120μmol/L时,转化子数目都达到了 26个 /平皿。但是 AS价格较高,考虑到经济问题,选择了 AS最佳浓度为 100μmol/L。
2.2.5 共培养温度 选择 4个共培养温度进行研究,结果如图5所示。当共培养温度为 25℃时,每个平皿上能得到 24个转化子,而 30℃时,转化子数目略有下降。分析原因可能是,对本实验所用的红曲霉和农杆菌菌株而言,两者都适合的温度为 25℃,此时最有利于转化。
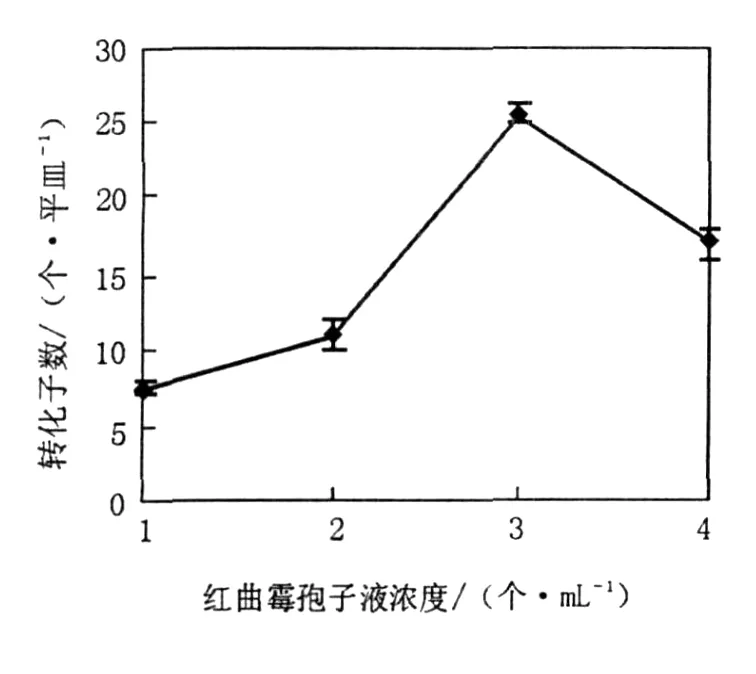
图3 红曲霉孢子液浓度对转化率的影响Fig.3 Effect of concentration ofMonascusspores 1、2、3、4分别代表104、105、106、107个 /mL 1、2、3、4 respectivelymeans 104、105、106、107spores/mL
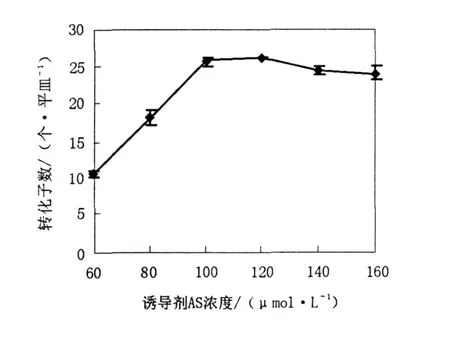
图4 诱导剂 AS浓度对转化率的影响Fig.4 Effect of concentration of inducerAS
2.2.6 共培养时间 图6结果表明,共培养时间越长,得到的转化子越多。但在共培养的第 3天,红曲霉菌丝顶端开始有分生孢子长出,到第 4天、第 5天分生孢子明显增多。在转化实验的操作中,孢子易被培养基冲散,如果延长共培养时间就会导致假阳性结果。因此,本实验选择的最佳共培养时间为 3 d。
2.2.7 共培养膜类型 实验时,分别将农杆菌与红曲霉孢子混合液共培养在硝酸纤维素膜 (NC膜)、定性滤纸、普通纸表面,研究膜的类型对转化率的影响。结果表明,膜类型对转化的影响较大,在普通纸表面,转化子长不出来,而定性滤纸较薄,孔隙较大,共培养后不容易转膜。只有在硝酸纤维素膜(NC膜)上,转化子能顺利长出,而且也不影响转膜,具体原因可能与孔径大小、膜厚度等因素有关。

图5 共培养温度对转化率的影响Fig.5 Effect of co2culture temperature

图6 共培养时间对转化率的影响Fig.6 Effect of co2culture time
2.3 转化子的遗传稳定性分析
将 530多株转化子接种到 PDA培养基上,随机挑选 50株突变株进行稳定性研究。结果显示,除 1株外,其余 49株均能在含有 200μg/mL潮霉素B的 PDA培养基上正常生长,其遗传稳定性高达 98%,表明潮霉素抗性基因已经整合到红曲霉基因组中,并能稳定遗传。
2.4 转化子的 PCR鉴定
如果根癌农杆菌 Ti质粒中的 T2DNA成功转移到红曲霉基因组 DNA中,就可以在 900 bp附近扩增出潮霉素基因特征条带,据此可以鉴定 T2 DNA是否成功插入到红曲霉基因组中。随机挑选 8株转化子菌株进行 PCR鉴定,并与出发菌株S比较,结果如图7所示。8株供试菌株在 900 bp左右均有条带,且条带清晰,无杂带,说明 T2DNA已经插入到红曲霉基因组DNA中。
2.5 转化子的形态学观察
将 530多株转化子接种到 PDA培养基上,30℃培养 7 d,比较突变株与出发菌株在菌落形态、颜色等方面的差异。结果表明,大部分突变株与出发菌株差别不大,只有少数突变株发生较大变化。选取有代表性的 8株转化子菌株与出发菌株S一起观察,其菌落特征见表1,菌落形态见图8。
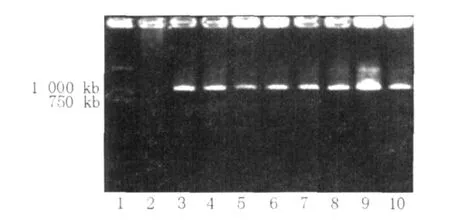
图7 转化子总基因组中 hph基因的 PCR扩增结果Fig.7 PCR analysis ofhphgene in hygromycin B2resistant transformants of S

表1 野生型菌株与部分转化子的形态特征Table 1 Characteristics ofwild2type strain S and partial transformants

图8 部分转化子的菌落形态(30℃,PDA,7 d)Fig.8 Colonymorphology of partial transfor mants(30℃,PDA,7 d)
3 讨 论
与其他转化方法相比,农杆菌介导转化技术具有转化效率高[4]、材料多样、来源简单[9]、操作简单[10]、单拷贝 T2DNA随机插入、转化子稳定性高等优点,是一种很有前途的真菌遗传转化方法。本实验利用根癌农杆菌介导的转化技术,通过对红曲霉孢子悬浮液浓度等因素的探讨,得到了根癌农杆菌介导红曲霉的高效转化体系:红曲霉在PDA培养基上培养 21 d后收集孢子,制备红曲霉孢子液,浓度为 106个 /mL,根癌农杆菌浓度 OD600为 0.5,诱导剂 AS浓度为 100μmol/L,农杆菌与红曲霉在 25℃共培养 3 d。采用此转化体系成功获得了 530个具有潮霉素抗性的红曲霉转化子。随机选取 50株转化子菌株进行了分子验证和稳定性检测,证明 T2DNA成功插入红曲霉基因组DNA中,并能稳定遗传。最后,通过形态观察等方法初步筛选出了 8株变异较大的转化子,用于后续研究。
在研究中发现,真菌原材料、根癌农杆菌和真菌种类、共培养的筛选环境等多种因素会影响农杆菌介导转化的效率。不同根癌农杆菌菌株、不同的双元载体、不同真菌都会影响根癌农杆菌介导的真菌遗传转化。方卫国等[5]曾以含有pB I121为基本骨架、潮霉素为选择标记的双元表达载体的农杆菌菌株 LBA4404转化黑曲霉,但未获得转化子,曾用另外 1株红曲霉菌株作为原材料进行转化,效果很不理想。
诱导剂乙酰丁香酮 (AS)是农杆菌介导真菌遗传转化的关键因素。在共培养过程中,没有 AS诱导就不能获得转化子,随着 AS浓度的增加,转化效率也相应提高[11212]。对于农杆菌在预培养时是否需要 AS的诱导,不同的研究者有不同的看法[13214]。本实验研究结果表明,在预培养和共培养过程中加入 AS均能提高转化效率,但浓度过高不仅浪费药品,转化效率也提高不大。
共培养温度和时间也是影响转化效率的关键因素。Campoy等[15]的研究表明,当共培养温度和受体最适生长温度一致时,能得到最多的转化子。本实验中,采用 25℃共培养能得到最多的转化子,可能因为在此条件下农杆菌最适合生长,从而有利于农杆菌的侵染,还可以降低菌丝的生长速度,以便 T2DNA区的整合。共培养时间的长短会影响农杆菌的吸附和 T2DNA转移,本实验中共培养 3 d比较适合,时间过长可能会导致假阳性克隆的产生。
红曲霉等真菌的代谢过程较为复杂,要确切地阐明不同代谢途径基因的功能及其相互关系需要大量的基因组信息。本实验研究的根癌农杆菌介导红曲霉遗传转化方法能够高效快速地获得转化子,使红曲霉在遗传功能方面得到不同的改造,从而为后续实验奠定基础。
[1] 张纪忠.微生物分类学[M].上海:复旦大学出版社,1990:246.
[2] Shimizu T,Kinoshita H,Ishihara S,et al.Polyketide synthase gene responsible for citrinin biosynthesis inM onascus purpereus[J].Applied and Environmental Microbiology,2005,71(7):345323457.
[3] Chen F S,Hu X Q.Study on red fermented rice with high con2 centration ofmonacolin K and low concentration of citrinin[J].International Journal of FoodMicrobiology,2005,103(3):3312 337.
[4] De2GrootM J A,Bundock P,Hooykaas P J J et al.Agrobacteri2 um tumefaciens2mediated transformation of filamentous fungi[J].Nature Biotechnology,1998,16:8392842.
[5] 方卫国,张永军,杨星勇,等.根癌农杆菌介导真菌遗传转化的研究进展[J].中国生物工程杂志,2002,22(5):40244.
[6] Covert S F,Kappor P,Lee M,et al.Agrobacterium tumefaciens2 mediated transfor mation ofFusarium circinatum[J].Mycologi2 cal Research,2001,105(3):2592264.
[7] Stevens R.Mycology Guidebook[M].Seattle:University of Washington Press,1974.
[8] 王杰,林俊芳,郭丽琼.影响农杆菌介导草菇遗传转化的因素研究[J].华南农业大学学报,2010,31(1):38241.
[9] 张震,杜新法,柴荣耀,等.根癌农杆菌介导丝状真菌遗传转化因素的研究进展[J].微生物学杂志,2007,27(6):88291.
[10]刘朋娟,王政逸,王秋华,等.农杆菌介导的稻瘟病菌转化及致病缺陷突变体筛选[J].中国水稻科学,2006,20(3):2312 237.
[11]HanifM,Pardo A G,GorferM,et al.T2DNA transfer and inte2 gration in the ectomycorrhizal fungusSuillus bovinususing hy2 gromycin B as a selectable marker[J].Current Genetics,2002,41(3):1832188.
[12]Leclerque A,Wan H,Abschutz A,et al.Agroba2cterium2media2 ted insertional mutagenesis(A IM)of the entomopathogenic fungusBeauveria bassiana[J].Current Genetics,2004,45(2):1112119.
[13]Combier J P,Melayah D,Raffier C,et al.Agrobacterium tumefa2 ciens2mediated transformation as a tool for insertionalmutagene2 sis in the symbiotic ectomycorrhizal fungusHebeloma cylindros2 porum[J].FEMS Microbiology Letters,2003,220(1):1412 148.
[14]Takahara H,Tsuji G,Kubo Y,et al.Agrobacterium tumefaciens2 mediated transformation as a tool for random mutagenesis of Colletotrichum lagenarium[J].Journal of General Plant Pathol2 ogy,2004,70(2):93296.
[15]Campoy S,Perez F,Martin J F,et al.Stable transfor mants of the azaphilone pigment2producingM onascus purpereusobtained by protoplast transformation andAgrobacterium2mediated DNA transfer[J].Current Genetics,2003,43(6):4472452.
Establishment and Optim ization ofAgrobacterium2mediated Transformation System s forM onascus purpureus
CA IQi2min,J IANGDong2hua,J IHao,LAN Li2jing
(Coll.of Chem.and Life Sci.,Zhejiang No rmal Uni.,Jinhua321004)
A high2effectiveAgrobacterium tum efaciens(A t)2mediatedM onascustransformation system was established through optimizing various transferring factors in this study.Spores ofM onascuscultured on PDA were collected 21 d after cultivation and prepared forM onascusspore suspension at 106/mL,and concentration of At wasOD600value at 0.5 with inducing agent concentration at100μmol/L.ThenA tandM onascuswere cultured together for 3 d in 25℃.Adopted this transformation system an insertmutant library containing over 530 transfor mants ofM onascusT2DNA was established.50 transformant strainswere randomly selected to carry out theirmolecular verification and stability,the results showed that T2DNA had successfully inserted to genome DNA ofM onascus purpureusand could be steadily in2 herited.Finally,eight strains of large variation were selected through morphological observation thus establish a cer2 tain foundation for further study onM onascusgene function.
M onascus;Agrobacterium tumefaciens;T2DNA;mutant library
Q933
A
1005-7021(2010)05-0068-06
国家自然科学基金(31070008);浙江省自然科学基金(Y3090343)
蔡琪敏 女,硕士。研究方向为应用微生物学。
3通讯作者。Tel:0579282283832,E2mail:jdh@zjnu.cn
2010208218;
2010209212

