钙调蛋白结合蛋白通过调节细胞骨架稳定性影响肿瘤细胞运动能力
江奇峰,蔡绍皙,晏小清
1.重庆大学生物工程学院,“生物流变科学与技术”教育部重点实验室(重庆大学),重庆400044;
2.波士顿生物医学研究所,波士顿02472,美国
钙调蛋白结合蛋白通过调节细胞骨架稳定性影响肿瘤细胞运动能力
江奇峰1,2,蔡绍皙1,晏小清1
1.重庆大学生物工程学院,“生物流变科学与技术”教育部重点实验室(重庆大学),重庆400044;
2.波士顿生物医学研究所,波士顿02472,美国
轻链钙调蛋白结合蛋白(light-chain Caldesmon,l-CaD)是一种重要的肌动蛋白结合蛋白,普遍存在于众多非肌肉细胞中。体外研究证明,l-CaD能通过与肌动蛋白的结合起到促进原肌动蛋白(G-actin)聚合、稳定肌动蛋白纤维(F-actin)结构的作用。在磷酸化作用下,l-CaD能从肌动蛋白纤维上脱离并促进肌动蛋白纤维的解聚。该研究拟考察l-CaD在细胞内对细胞肌动蛋白骨架的调节作用,阐明l-CaD对细胞运动能力的影响,作者将天然低表达l-CaD的人源性乳腺癌细胞MCF-7作为细胞模型,在MCF-7胞内以基因转染的方式高表达外源野生型l-CaD及其磷酸化突变株A1234-CaD(不可磷酸化CaD)、D1234-CaD(完全磷酸化CaD)。首先,通过激光共聚焦扫描,探讨了l-CaD对细胞骨架重排的调节;其次,通过细胞迁移transwell阵列,检测了l-CaD对细胞迁移能力的影响;最后,在单细胞层次上测定了细胞基底牵张力、胰酶刺激下的细胞基底脱附能力,并进一步检测了l-CaD对细胞迁移子过程中细胞伸张、收缩的影响。研究结果显示,l-CaD在胞内对细胞骨架的形成有显著的调控作用。非磷酸化l-CaD主要富集在细胞骨架上,增强了细胞骨架的强度,导致细胞基底牵张力以及对胰酶的耐受性增强,但对细胞的迁移能力有显著的抑制作用;磷酸化l-CaD跟细胞骨架结合能力很弱,对细胞的运动能力没有显著影响。通过磷酸化,l-CaD起到了一个“蛋白开关”的作用,通过控制细胞骨架的解聚、重排来调节细胞的运动能力。
钙调蛋白结合蛋白;细胞骨架;细胞迁移;细胞基底牵张力
0 引言
细胞的运动能力是组织形成及器官发育的关键因素,细胞运动涉及到生物体众多的生理过程,其中包括组织修复、免疫应答及肿瘤的浸润和转移[1~3]。细胞的肌动蛋白骨架作为胞内信号传递的关键途径,是细胞运动的重要引擎。作为维持细胞正常形态的主要组成部分,细胞骨架通过有序的解聚和重排为细胞提供重要内力,促进细胞运动[4,5]。细胞骨架的有序调整不是仅涉及肌动蛋白重排的单一过程,而是在很多细胞骨架结合蛋白协同参与下进行的复合行为。近些年的研究证实了多种细胞骨架结合蛋白参与了细胞骨架调控[4],其中就包括钙调蛋白结合蛋白(Caldesmon,CaD)[6~8]。
CaD存在于几乎所有脊椎动物细胞中,它有由同一基因通过选择剪接产生的两种亚型[9]:只存在于平滑肌细胞的重链钙调蛋白结合蛋白(h-Caldesmon,h-CaD)和细胞中普遍存在的轻链钙调蛋白结合蛋白(l-Caldesmon,l-CaD)。一般认为,h-CaD是调节平滑肌细胞收缩的重要组件,l-CaD是细胞骨架单位[6~8]。l-CaD以一个类似于订书针结构的方式与肌动蛋白结合,一方面能够稳定胞内应力纤维[10~12],另一方面通过与肌动蛋白结合,抑制肌动球蛋白与肌动蛋白的结合,从而抑制细胞骨架的调整。通过与钙调蛋白(Calmodulin)结合或者在磷酸化作用下,l-CaD能够从肌动蛋白上解离下来,并恢复肌动球蛋白与肌动蛋白的结合。已有研究证明,1-CaD能够抑制凝溶胶蛋白与肌动蛋白结合,降低凝溶胶蛋白对肌动蛋白纤维的剪切作用[13~15],1-CaD或者它的C末端片段CaD39,可以加强原肌球蛋白与肌动蛋白丝的结合[16,17]。因此人们认为在体外蛋白层次上,l-CaD能够通过与肌动蛋白的结合来调节肌动蛋白纤维的结构。在细胞内,l-CaD主要集中在应力纤维、前端板状伪足和细胞膜褶皱中[18~20]。研究显示,通过向细胞中显微注射l-CaD抗体,可以导致细胞内微粒运动的瞬时速度和跃移距离显著减少,胞内肌动蛋白纤维解聚,应力纤维消失[21,22]。进一步研究发现[23],细胞分裂间期的静态细胞中,l-CaD以非磷酸化的形式出现,并主要位于细胞骨架较为稳定的应力纤维上;当细胞开始分裂或迁移时,l-CaD主要以磷酸化的形式位于细胞骨架调整活跃的细胞运动前沿,并参与细胞粘附斑的形成。CaD跟cortactin、Arp2/3 complex、WASP等肌动蛋白结合蛋白一起存在于细胞骨架结构足体(podosome)中,足体被认为是细胞粘附、迁移和浸润细胞外基质的主要方式,因为足体的中心部分是金属基质蛋白酶MMP-9的重要分泌场所[24,25]。近来的研究证明,通过激活细胞周期依赖性激酶(cell division cycle 2,Cdc2)对l-CaD的磷酸化作用,将显著影响内皮细胞和血管平滑肌细胞足体的形成,因此我们猜测l-CaD的分布和磷酸化可能是调节细胞运动能力的重要因素。
为了进一步明确l-CaD及其磷酸化作用对细胞运动能力的影响,我们选取人源性乳腺癌细胞MCF-7作为载体,通过基因转染的方式,在MCF-7细胞内高表达连接了增强型绿色荧光蛋白的外源野生型l-CaD(EGFP-wtCaD)及其磷酸化突变株:包括不可磷酸化l-CaD突变株(EGFP-A1234CaD)、磷酸化l-CaD突变株(EGFP-D1234CaD)。MCF-7天然低表达l-CaD,因此内源性l-CaD对外源高表达l-CaD的拮抗影响可忽略。结合细胞骨架荧光染色、细胞基底牵张力及迁移能力的测定,我们发现l-CaD能够通过稳定细胞骨架,增加细胞骨架强度、细胞的基底牵张力和胰酶耐受性,并对细胞迁移有显著的抑制作用,磷酸化的l-CaD与细胞骨架的结合能力相对较弱,对细胞迁移能力无显著影响。我们的研究不仅明确了l-CaD磷酸化可以通过对细胞骨架的调节作用影响细胞的运动能力,而且为通过l-CaD作为靶向手段治疗肿瘤提供了新的思路。
1 材料和方法
1.1 细胞培养
人源性乳腺癌细胞MCF-7(ATCC#HTB-22TM)用添加了10%胎牛血清和1%抗生素的DMEM培养基(CellgroTM)培养;人源性上皮细胞(human mammary epithelial cell,HMEC)用添加了10 ng/mL人源性上皮生长因子(hEGF,CellgroTM)、10 μg/mL胰岛素、5%胎牛血清和1%抗生素的DMEM-F12基础培养基(CellgroTM)培养。所有细胞均在37℃,5%CO2条件下培养。
1.2 质粒
通过NcoⅠ将含有l-CaD DNA的片段从人源性成纤维细胞l-CaD(Gene Bank #M64110)的pCB6hx质粒上酶切下来,经过T4DNA聚合酶平整末端后,用BamHⅠ处理获得BamHⅠCaD插入片段。将BamHⅠCaD插入哺乳动物表达载体pEGFPC1 (Clontech)BspE和BamHⅠ多克隆位点之间,获得野生型l-CaD(EGFP-wtCaD),并通过测序确认EGFP开放阅读框和终止密码子的正确性。通过定点突变的方式[23],突变ERK跟PAK位点的氨基,获得了PAK和ERK磷酸化位点完全被封闭的不可磷酸化l-CaD突变株(EGFP-A1234,PAK和ERK位点Ser都更换为Ala)和模拟PAK和ERK位点完全磷酸化的突变株(EGFP-D1234,PAK和ERK位点Ser都更换为Asp),对照组质粒为不含l-CaD序列的EGFP空质粒载体。
1.3 细胞转染
MCF-7细胞以5×105的密度种在6孔板内,孵育过夜。800 μl无血清DMEM培养基饥饿细胞2 h,随后加入93 μl含有2 μg质粒DNA以及5 μl FUGENE转染试剂(Roche)的无血清DMEM培养基。孵育5 h后用完全培养基换液。48 h后通过Western-blot检测蛋白表达量。
1.4 Western Blot检测l-CaD的表达
通过Western blot检测细胞中内外源性总l-CaD表达量。将细胞以1×105细胞/孔的密度种在6孔板(Becton-Dickinson,Rutherford,NJ)中,孵育24 h。移除培养基,冰预冷的PBS冲洗细胞两次。向每孔加入100 ml裂解液制备总蛋白,裂解液中含有1 mmol/L苯甲磺酰氟(Sigma)、10 mg/mL亮肽素(Sigma)、30 mg/mL胰蛋白酶抑制剂(Sigma)和1 mmol/L NaVO3(Sigma)。冰上孵育30 min,刮净。细胞提取物都通过SDS-PAGE分离,并用亲和纯化的多克隆抗体anti-CaD和anti-β-actin单克隆抗体(Sigma)进行免疫标记,再用亲和纯化的、分别连接有IRDyeTM 700和800的抗兔并抗鼠的荧光二抗标记。用Odyssey红外图像系统(Li-COR,Biosciences,Lincoln,NE)检测,可以直接定量表征红外荧光,荧光强度则代表蛋白表达量。
1.5 细胞骨架荧光染色
细胞种植在表衬有人纤连蛋白的玻璃盖玻片上(Becton Dickinson),孵育24 h直至细胞完全铺展。PBS清洗两次,4%多聚甲醛固定15 min,0.3%TritonX-100透膜5 min。F-actin用rhodamine phalloidin(1∶100)染色并孵育1 h,所有溶液均为PBS制备。PBS清洗3× 5 min,Mowiol(Sigma)封片。所有图像均通过Nikon Eclipse TE300显微镜的BioRad Radiance 2000激光共聚焦系统获得,并通过Laser Sharp 2000 BioRad软件处理。
1.6 细胞迁移测定
基于细胞趋化原理,使用8μm孔径滤膜的Transwell24孔板(Becton Dickinson)进行细胞迁移实验。滤膜的内、外壁用5 μg/mL的人纤连蛋白(R&D,Minneapolis)在37℃表衬2 h,PBS清洗。200 μl的细胞悬液以2×104cells/孔的密度种在Transwell的内腔。外腔加入800 μl含有10%FBS的完全培养基。37℃孵育24 h,选取9个随机视野,用ZEISS-AXIO荧光显微镜分别在相差视野和荧光视野下计数总的迁移细胞数和转染了绿色荧光的迁移细胞数。具有绿色荧光的迁移细胞数与总的具有绿色荧光的细胞数之间的比率则作为转染细胞的相对迁移能力。
1.7 细胞基底牵张力测定
细胞种植于均匀包埋了200 nm红色荧光微珠的聚丙烯酰胺凝胶基底表面。完全铺展的细胞由于细胞骨架产生的应力使凝胶产生一定程度的形变,该形变将导致凝胶内部均匀包埋的微珠产生一定的位移,通过Fourier-Transform Traction Microscopy(FTTM)则可以将细胞从基底脱附前后微珠位移的变化,转算为细胞施加在凝胶表面的牵张力。
1.7.1 聚丙烯酰胺凝胶的制备
聚丙烯酰胺凝胶基底的制备主要根据前人的方法[26,27]。具体步骤概括为:1)0.1 mol/L NaOH表面改性玻璃底培养皿(MatTek)的玻璃区域,过夜风干;2)滴加97%的3-aminopropyltrimethoxylsilane于步骤1)中NaOH沾染的区域,清洗,风干,随后加入0.5%的戊二醛,然后将培养皿清洗并过夜风干。3)在培养皿中央加入20 μl含有0.03%双丙烯酰胺、5%丙烯酰胺(Bio-Rad)、0.6%200 nm红色荧光微珠(Invitrogen)、0.5%过硫酸铵以及0.05%TEMED(Bio-Rad)的超纯水。随后用25 mm盖玻片均匀覆盖直至聚合。移去盖玻片,加入200 μl溶液〔1 mmol/L Sulfosuccinimidyl-6-[4-azido-2-nitrophenylamino] hexanoate(Sulfo-SANPAH;Pierce)溶解在200 mmol/L HEPE溶剂中〕进行表面活化。紫外线照射5 min,0.1 mol/L HEPES清洗两次,每次15 min,PBS清洗15 min,加入200 μlⅠ型胶原溶液(0.1 mg/mL;Inamed Biomaterials)表衬,4℃过夜。隔天,PBS洗涤并用2 ml无血清培养基水合,于37℃、5%CO2的孵箱中储存至使用。
1.7.2 细胞基底牵张力的测定
将1×104个细胞种植在制备好的聚丙烯酰胺凝胶上,孵育24 h,无血清DMEM培养基饥饿细胞过夜。由于细胞高表达连接了绿色荧光蛋白基因的质粒,通过荧光显微镜可分别确定单个绿色荧光细胞以及细胞下方的红色荧光微珠,在相差显微镜和荧光显微镜下对细胞和细胞下微珠拍照。胰酶消化细胞后,获取另一张细胞下同一位置的微珠荧光照片。将所得的3张照片转入Matlab,则可确定细胞基底下微珠的位移[28]。细胞的区域通过软件描绘实验开始时获得相差图片中细胞轮廓的方法来计算。应用Butler等人[29]的方法计算细胞牵张区域内凝胶基底的形变和位移。基于Fourier-Transform,基底的位移量可转算为由于细胞骨架铺展、收缩而施加在基底上的牵张力(PJ表示)。
1.8 胰酶刺激下的细胞基底脱离测定
MCF-7细胞以5×104密度种植于24孔板中,孵育48 h。PBS洗涤2次,加入标准0.25%胰酶/EDTA溶液(CellgroTM)。在Nikon Eclipse TE300荧光显微镜荧光光路下用100X观测转染细胞,计数细胞脱离基底的速度和比率。
1.9统计分析
2结果
2.1Western Blot检测胞内l-CaD的表达
通过Western blot,我们首先检测了MCF-7细胞内源l-CaD的表达,以正常上皮细胞HMEC作为对照,我们发现内源性l-CaD在MCF-7细胞中表达量很低,并且显著低于HMEC细胞(图1A),因此我们在MCF-7细胞中通过基因转染高表达的外源野生型l-CaD及其磷酸化突变株,将不会受到内源蛋白的影响;进一步,我们在MCF-7细胞以质粒转染的方式高表达外源野生型l-CaD基因(EGFP-wtCaD)、不可磷酸化CaD突变株(EGFPA1234CaD)、磷酸化CaD突变株(EGFP-D1234CaD)以及空质粒载体(EGFP),通过Western blot,我们确定外源l-CaD在MCF-7细胞中获得了显著高表达,因此可以认为外源高表达l-CaD在胞内占主导作用(图1B)。
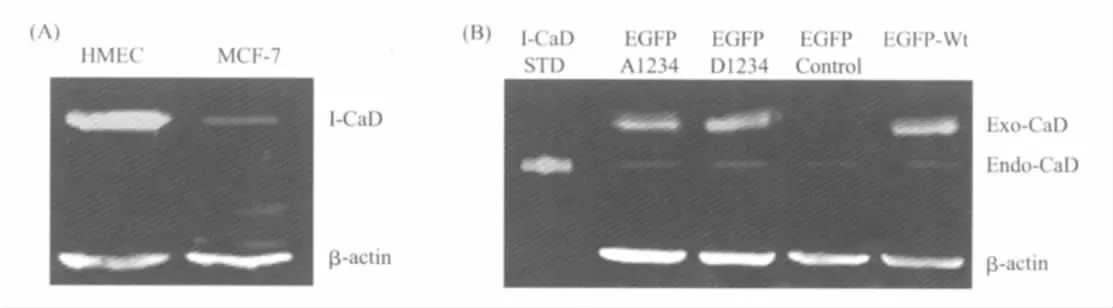
图1Western blot检测细胞中内、外源l-CaD及其磷酸化突变株的表达通过亲和纯化的多克隆抗体anti-CaD和anti-β-actin单克隆抗体对细胞提取物进行免疫标记。(A)MCF-7内源l-CaD (Endogenous l-CaD)表达量很少,显著低于对照组人源上皮细胞HMEC。(B)外源蛋白连接有EGFP,所以外源l-CaD(Exogenous l-CaD)在SDS-PAGE上的位置明显高于l-CaD标准蛋白(l-CaD STD)。上排从左至右分别为高表达的外源不可磷酸化CaD突变株(A1234CaD)、磷酸化CaD突变株(D1234CaD)、空质粒载体(EGFP-Control)以及野生型l-CaD(wtCaD),下排分别为同一细胞提取物样本的内源β-actin,可以看出外源l-CaD在MCF-7胞内获得了显著高表达,EGFP空质粒载体没有连接外源l-CaD,因此对照组细胞内仅能检测到内源l-CaD而没有外源l-CaD表达Fig.1Western blot analysis of EGFP-tagged CaD variants and endogenous CaD expressed in MCF-7 human breast cancer cellsThe total extracts from cells transfected with various constructs wereimmunoblottedwithpolyclonalanti-CaDandmonoclonalanti-β-actinantibodies.(A)The expression level of endogenous CaD(Endo-CaD)in MCF-7 cells was much lower than in Human mammary epithelial cells(HMEC).(B)The upper roll was exogenous CaD(Exo-CaD)variants.The samples were,respectively,cells transfected with A1234,D1234,EGFP control,and wtCaD.Because the EGFP tagged with the exogenous CaD,the exogenous CaD was higher than the standard CaD marker.The lower roll was the β-actin which was from the same cell sample.The expression of exogenous CaD was much higher than the endogenous CaD,the endogenous CaD would have little competing effect on the exogenous CaD
2.2 l-CaD及其磷酸化突变株对MCF-7细胞骨架结构的影响
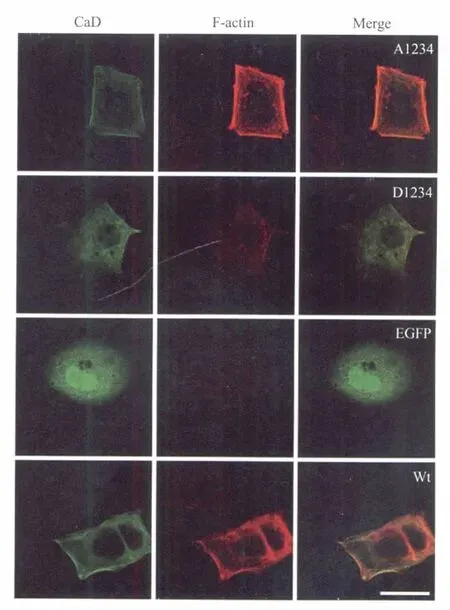
图2 高表达外源l-CaD及其磷酸化突变株的MDA MB-231细胞在激光共聚焦扫描下所得的细胞骨架荧光染色图片所有的外源l-CaD均为EGFP标记,显示为绿色荧光(左列);F-actin通过rhodamine phalloidin染色显示为红色荧光(中间列);右列为合并照片。细胞均通过转染高表达EGFP空质粒(对照组,EGFP)、EGFP-A1234(A1234)、EGFP-D1234(D1234)和EGFP-wtCaD(Wt)。A1234转染细胞显示了最为明显、牢固的细胞骨架结构;wtCaD转染细胞的细胞骨架也比D1234转染细胞和对照组细胞(EGFP)的更为明显。D1234转染细胞与对照组细胞表现出相似的细胞骨架。标尺:100 μmFig.2Confocal images of transfected MCF-7human breast cancer cellsAll CaD constructs were EGFP-tagged(left panels);actin was stained with red(middle panels);Merged images are shown on the right panels.Cells were transfected with EGFP(control),EGFP-wtCaD(wild-type CaD)and CaD mutant,including EGFP-A1234 and EGFP-D1234.A1234 transfected cells had most robust cytoskeleton structure,the wtCaD transfected cells also had more robust structure than D1234 and control cells(EGFP).The D1234 transfected cells exhibited similar cytoskeleton structure to the control cells.Scale bar=100 μm
l-CaD作为一种肌动蛋白结合蛋白,它不仅可以稳定肌动蛋白丝,并且能通过抑制肌动球蛋白的结合,在调节肌动球蛋白聚合和重排中起分子刹车的作用。通过磷酸化和脱磷酸化,CaD可以脱离或结合到肌动蛋白纤维上,促进细胞骨架的形成或重排。为了阐明l-CaD及其磷酸化在MCF-7细胞骨架中的作用,我们在MCF-7细胞内高表达了外源野生型wtCaD及其磷酸化突变株A1234、D1234,以EGFP空质粒转染细胞作为对照,通过rhodaminephalloidin荧光染色以及激光共聚焦扫描(图2),我们发现,尽管MCF-7细胞内没有明显的应力纤维结构,但绝大部分A1234质粒转染的细胞边缘位置显示了最为明显的细胞骨架结构,并且外源性l-CaD与细胞骨架有着明显重叠(图2-A1234);wtCaD细胞也显示出强于对照组细胞的细胞骨架,外源性l-CaD与细胞骨架的重叠也非常明显(图2-wt);与之相对的是,由于D1234-CaD模拟磷酸化l-CaD,与细胞骨架的结合能力很弱,因此转染了D1234的细胞,表现出显著弱于A1234及wtCaD转染细胞的细胞骨架(图2-D1234),其细胞骨架结构与对照组细胞(图2-EGFP)类似,但外源性D1234与细胞骨架也有一定程度的重叠。
2.3 l-CaD及其磷酸化突变株对MCF-7细胞迁移能力的影响
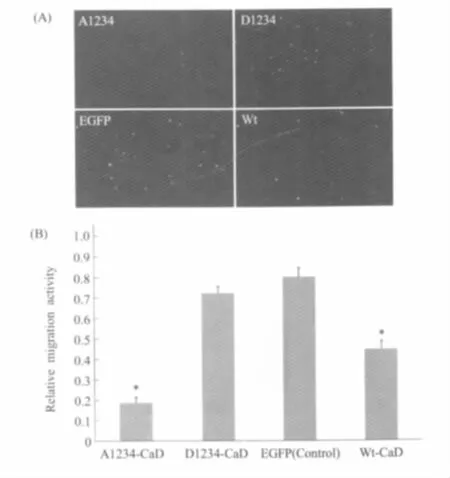
图3 高表达外源l-CaD及其磷酸化突变株的MCF-7细胞相对迁移能力(n=9)(A)荧光显微镜下计数的迁移细胞,每一个荧光亮点代表透膜的转染细胞。荧光显微照片显示A1234转染细胞透膜数最少,Wt细胞透膜细胞也明显少于EGFP对照组细胞,D1234细胞透膜数表现出与对照组细胞类似。(B)细胞计数显示A1234转染细胞的迁移能力受到了最大程度的抑制,其相对迁移率约为对照组EGFP转染细胞的25%;wtCaD转染细胞的迁移能力也受到抑制,其相对迁移率约为对照组细胞的60%;D1234细胞迁移的影响不显著,相对迁移率与对照组细胞类似Fig.3Results of transwell migration assays of cells that were transfected with EGFP(control), EGFP-wtCaD,EGFP-A1234 and EGFP-D1234 to perform migration assay(A)The images of migrated cells under fluorescence microscope,The light spots represent the transfected cells that migrated through the membrane.(B)The migration ratio for the A1234 transfected cells was about 25%of the control cells(EGFP),and the ratio of wtCaD was about 60%of the control cells.D1234 mutant didn't have significant inhibitory effect on the mobility of MCF-7 cells
为了检测l-CaD及其磷酸化对MCF-7细胞迁移能力的影响,基于趋化实验的原理,我们使用了8 μm孔径的transwell进行细胞迁移实验,应用迁移过膜的绿色荧光细胞数与总的绿色荧光细胞数之间的比率表征转染细胞的相对迁移能力(图3A)。实验结果显示,在所有的转染细胞中,A1234转染细胞的迁移能力受到了最大程度的抑制,其相对迁移率(0.19±0.03)只有对照组EGFP空质粒转染细胞(0.80±0.05)的25%(图3B);转染wtCaD同样抑制了细胞的迁移能力,其相对迁移率(0.45±0.04)约为对照组细胞的60%;D1234细胞跟对照组细胞的迁移能力相近,无显著差异(0.73±0.045)。很明显,l-CaD及其磷酸化参与了细胞的迁移行为,完全阻断l-CaD的磷酸化将显著抑制细胞的迁移。
2.4 l-CaD及其磷酸化突变株对MCF-7细胞基底牵张力的影响
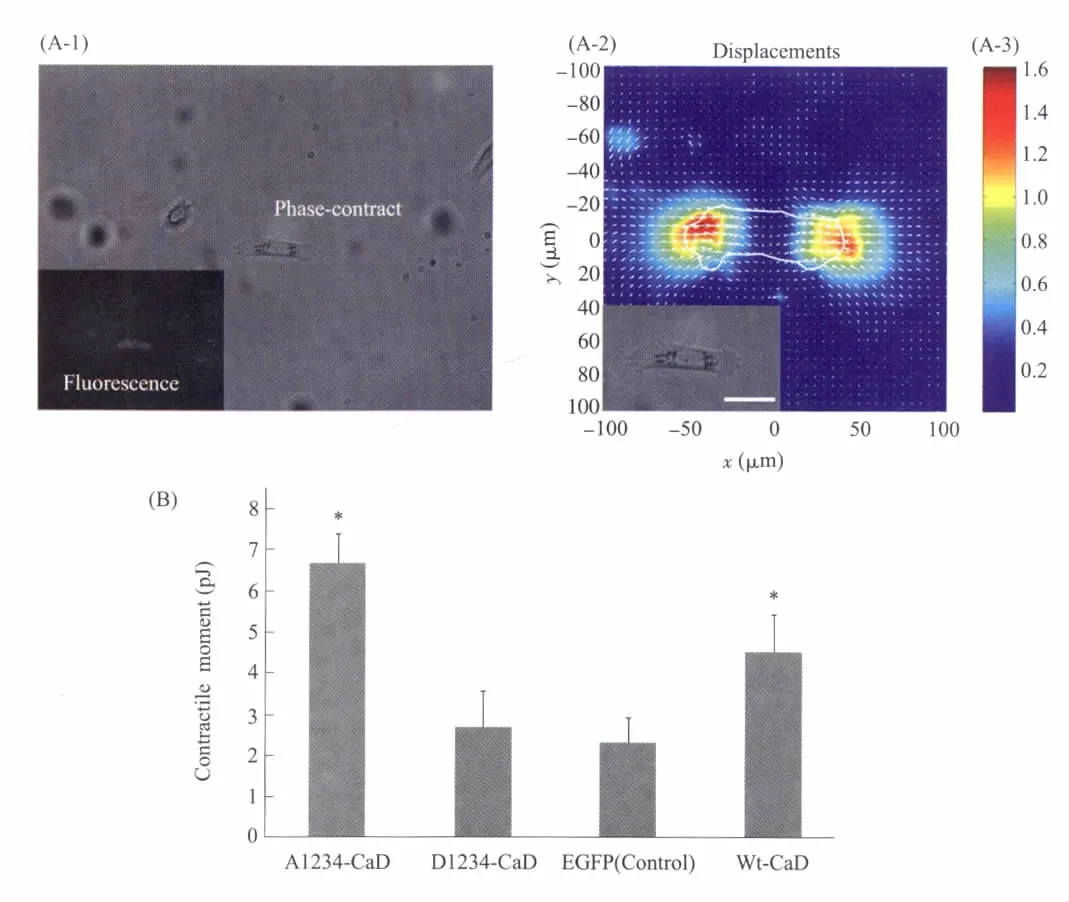
图4 细胞基底牵张力测定及其原理示意图(n=10)(A-1)在荧光显微镜下找到单个表达外源质粒的绿色荧光细胞(左下方),在荧光显微镜和相差显微镜下记录所得细胞图片。(A-2)Matlab分析所得的凝胶基底中荧光微粒的位移模拟图,以及细胞下方牵张力场的分布。箭头方向与颜色分布分别代表微粒运动的方向与强度。(A-3)经过软件分析得出的凝胶基底中荧光微粒位移的具体强度。标尺:50 μm。(B)高表达外源l-CaD及其磷酸化突变株的MCF-7细胞的基底牵张力。A1234细胞展现出最强的基底牵张力;与对照组细胞相比,wtCaD细胞的牵张力也显著增加,D1234突变株对细胞基底牵张力没有显著影响。标尺:100 μmFig.4Fouriertransformtranctionmicroscopymeasurementsandtheimagesofa representative MDA MB231 cell gathered in the measurement process(A-1)The single green cellwasfirstidentifiedunderfluorescencechannel(lowerleft)andthenrecordedtheboth fluorescence and phase-contrast images.(A-2,A-3)The computed traction field basedonthe micropatterned beads.The magnitude and the direction of the vectors indicate the beads movement which was used to compute the contractile moment.(B)Results of traction force measurements of MCF-7 cells transfected with wtCaD and phosphomimetic mutants of CaD(n=10)
细胞对基底的牵张力是影响细胞迁移的关键因素之一。为了分解l-CaD及其磷酸化突变株对整个细胞迁移行为的影响,我们使用Fourier-Transform Traction Microscopy,在单细胞水平上,对l-CaD及其突变株对MCF-7细胞基底牵张力的影响进行了检测(图4)。转染了EGFP、wtCaD、A1234、D1234的细胞种植于均匀包埋了红色荧光微珠的聚丙烯酰胺凝胶基底表面。通过相差及荧光显微镜,获取胰酶消化前后的细胞及细胞下荧光微珠的照片(图4A-1),通过计算机分析,获得细胞下荧光微珠的位移大小和方向(图4A-2,3),通过Fourier-Transform将荧光微珠的位移转换为细胞对基底的平均牵张力。结果显示,迁移受到最大抑制(参照图3)的A1234转染细胞表现出了最大的牵张力〔(6.7±0.7)pJ〕(图4B),约为对照组细胞牵张力〔(2.3±0.6)pJ〕的3倍;与对照组细胞相比,wtCaD转染细胞的牵张力(4.5±0.9)也显著升高,约为对照组细胞的2倍;相对而言,D1234转染细胞的牵张力(2.7±0.87)与对照组细胞相近,无显著影响。数据显示l-CaD及其磷酸化突变株对细胞基底牵张力有显著影响,并与细胞骨架的结构一致。
2.5 l-CaD及其磷酸化突变株对MCF-7细胞在胰酶刺激下基底脱附的影响
细胞迁移过程中另一个关键步骤就是细胞从基底脱附。在胰酶作用下,细胞内部肌动蛋白束从粘附斑位置迅速脱离、解聚,从而导致细胞变圆并从基底上脱附。根据这样的原理,我们通过胰酶刺激,对EGFP、wtCaD、A1234以及D1234转染后的细胞从基底上脱附下来的动力学过程进行了比较。结果显示(图5),与对照组细胞相比,wtCaD转染细胞表现出对胰酶处理的延迟型应答,A1234转染的细胞其变圆速率更加缓慢;D1234对细胞在胰酶刺激下的应答影响不大,D1234转染细胞表现出与对照组细胞相近的变圆速率。
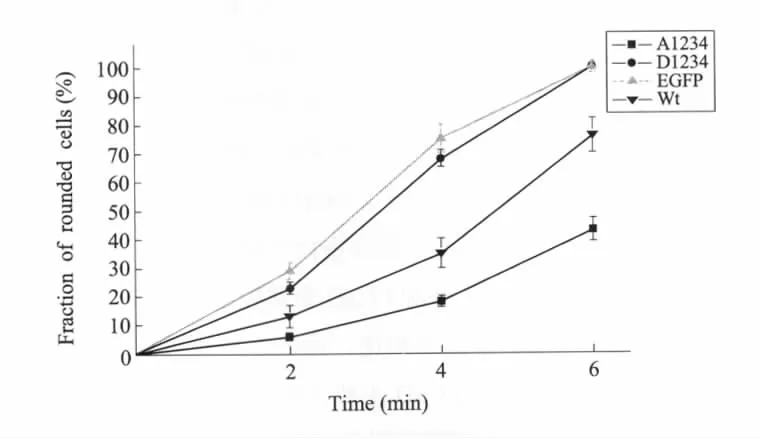
图5 胰酶刺激下细胞基底脱附行为检测(n=6)在胰酶刺激下,细胞会由于细胞骨架的收缩、解聚而变圆并从基底脱附。我们以EGFP空质粒转染细胞为对照组,检测了外源l-CaD高表达对细胞在胰酶刺激下脱附能力的影响。细胞种植于24孔板内,滴加标准0.25%胰酶/EDTA溶液,在相差显微镜和荧光显微镜下实时观测细胞收缩、变圆、脱附的过程。记录0~6 min各组细胞中圆形细胞的比例。A1234转染细胞表现出了对胰酶最显著的耐受能力;高表达wtCaD的细胞对胰酶的响应也有所延迟,D1234细胞跟对照组细胞对胰酶刺激的响应类似Fig.5Detachment of transfected MCF-7 cells upon trypsinizationCells from each plate were trypsinized and monitored under the phase-contrast and fluorescence microscope for time-dependent retraction,rounding and detachment.Percentage of round cells within the designated period was plotted for each type of cells.The percentage of rounded cells in each plate was reported.A1234 cells show the greatest tolerance against enzyme;the response of wtCaD high-expressing cells to enzyme was delayed,D1234 cells display the same response to enzyme as the control(n=6)
3 讨论
众多研究已经证明,l-CaD可以通过与肌动蛋白的相互作用参与到细胞正常的生理活动中[6~8]。在体外条件下,l-CaD能够通过与肌动蛋白结合来稳定肌动蛋白纤维[16,17],从而抑制凝溶胶蛋白对肌动蛋白纤维的剪切作用[13~15]。在细胞内,一方面人们发现通过显微注射l-CaD抗体能导致细胞骨架解聚,从而降低胞内微粒转运速度[21,22];另一方面,在磷酸化作用下,l-CaD将从肌动蛋白纤维上解离下来,从而促进肌动蛋白纤维的解聚和重排[10~15],并且磷酸化与非磷酸化的l-CaD有不同的分布区域,非磷酸化l-CaD富集在稳定的细胞骨架上,而磷酸化l-CaD主要集中在细胞骨架调节频繁的细胞运动前沿及足体内[23~25]。这些研究结果无一不预示着,l-CaD作为一种重要的肌动蛋白结合蛋白,在细胞正常生理活动中起着关键作用。但是,l-CaD在体外对肌动蛋白纤维的稳定作用以及通过显微注射l-CaD抗体的方式所得的结果,并不能直观地证明细胞内l-CaD及其磷酸化对细胞骨架重排和解聚的调节作用;在体观测l-CaD胞内分布也不能直观显示l-CaD及其磷酸化如何调控细胞的运动能力,因此在我们的研究中,将l-CaD及其磷酸化突变株作为“分子探针”,通过在胞内高表达外源l-CaD,干扰胞内细胞骨架调节进程和l-CaD磷酸化程度,证明了l-CaD是通过调节细胞骨架的解聚和重排而影响细胞的运动能力。
为了证实l-CaD及其磷酸化对细胞骨架的调节作用,我们制备了野生型l-CaD(wtCaD)及其磷酸化突变株。将野生型l-CaD的ERK和PAK磷酸化位点定点突变为丙氨酸,获得了不能通过磷酸化作用从肌动蛋白上脱离的l-CaD不可磷酸化突变株A1234-CaD;将野生型l-CaD的ERK和PAK磷酸化位点定点突变为天冬氨酸,获得了模拟l-CaD磷酸化状态的D1234-CaD。在胞内高表达外源蛋白应考虑到内源蛋白的拮抗作用,我们之前的研究显示,l-CaD在人源性乳腺癌细胞MCF-7内表达量非常低,因此MCF-7是一个进行高表达外源l-CaD研究的优良细胞模型。体外实验证明了l-CaD通过与肌动蛋白结合从而稳定肌动蛋白纤维的作用,而通过磷酸化,l-CaD将从肌动蛋白上脱附,从而促进肌动蛋白纤维的解聚[16,17],我们通过在MCF-7细胞内高表达外源l-CaD来调控细胞骨架的形成,获得了与体外实验一致的结果。我们发现,与对照组细胞相比,高表达外源野生型l-CaD(wtCaD)的细胞拥有更为牢固的细胞骨架结构,外源l-CaD主要富集在细胞骨架上,与细胞骨架重合明显;不可磷酸化l-CaD(A1234)转染的细胞则显示了甚至强于wtCaD细胞的骨架系统,由于不能通过磷酸化从细胞骨架上脱离,绝大部分A1234-CaD集中在细胞骨架上,显著增强了骨架强度;D1234-CaD模拟磷酸化l-CaD,与细胞骨架的结合作用很弱,不能通过稳定细胞骨架增强骨架的强度,因此D1234高表达细胞显示了与对照组细胞相似的细胞骨架系统。这个结果说明,在胞内条件下,l-CaD对细胞骨架形成有显著的调节作用,非磷酸化l-CaD能够明显促进细胞骨架形成并维持其稳定性,而磷酸化l-CaD对细胞骨架的结合能力很弱,对细胞骨架的形成、稳定性没有显著影响。
细胞迁移由多个步骤组成[30],包括肌动蛋白骨架重构、粘附、基底脱附、细胞牵张,其中,肌动蛋白骨架的解聚跟重排是细胞迁移的首要步骤。为了进一步探明l-CaD是否能通过对细胞骨架的调节作用影响细胞的运动能力,一方面通过细胞迁移小室,我们考察了l-CaD对细胞迁移能力的整体影响;另一方面,通过基底牵张力分析及细胞脱粘附阵列,我们考察了l-CaD对细胞迁移的子过程——细胞收缩及脱附的影响。数据显示,细胞骨架结构最为牢固的A1234-CaD高表达细胞整体迁移能力受到了最显著的抑制,细胞基底牵张力显著增强,对胰酶刺激的响应明显延迟。这个结果进一步说明了细胞骨架的解聚和重排对细胞运动能力的促进作用。当l-CaD的磷酸化被丙氨酸突变阻断时,A1234-CaD突变株将无法通过磷酸化从细胞骨架上脱离,细胞骨架重排受阻,从而导致细胞迁移受到显著抑制,而非磷酸化l-CaD在细胞骨架上的富集在抑制细胞整体迁移能力的同时,通过增强细胞骨架的强度,赋予了细胞更强的基底牵张力,细胞骨架对胰酶的耐受性增强;与A1234-CaD的作用类似,野生型l-CaD高表达的细胞迁移能力受到显著抑制,而基底牵张力和胰酶耐受性增强。wtCaD在胞内高表达,可能超出了胞内磷酸化激酶的承受范围,激光共聚焦图片显示富余的过量l-CaD得不到高效的磷酸化,以非磷酸化形式大量富集在细胞骨架上,导致细胞骨架增强而解聚受阻,细胞迁移受到明显抑制的同时赋予了细胞更强的基底牵张力和胰酶耐受性;D1234-CaD跟肌动蛋白的结合能力很弱,不能通过稳定肌动蛋白纤维而增加细胞骨架的强度,因此,D1234-CaD高表达的细胞表现出了与EGFP空质粒转染的对照组细胞相似的迁移能力,基底牵张力跟胰酶耐受性也不能通过细胞骨架强度增加而获得相应的提高。
细胞骨架通过肌动蛋白有序的解聚和重排,在许多细胞生理活动的控制中起关键作用,包括:细胞分裂、迁移、内吞和外排作用、凋亡和炎症、囊泡运输和基因表达。我们的研究证明,l-CaD作为一种重要的肌动蛋白结合蛋白,通过与肌动蛋白的相互作用参与调控了细胞的运动能力。l-CaD在胞内以非磷酸化的形式结合到肌动蛋白上,促进了细胞骨架的形成,并能维持其稳定性,如果阻断l-CaD磷酸化,l-CaD很难从细胞骨架上脱离,将导致细胞骨架有序的解聚和重排受阻,细胞运动能力将受到显著的抑制。总的来说,l-CaD通过磷酸化与去磷酸化起到了一个“蛋白开关”的作用,通过控制细胞骨架的解聚和重排来调节细胞的运动能力,这也为使用l-CaD作为靶底物治疗肿瘤,特别是高转移性肿瘤提供了新的理论依据。
1.Lauffenburger DA,Horwitz AF.Cell migration:a physically integrated molecular process.Cell,1996,84(3):359~369
2.Schneider IC,Haugh JM.Mechanisms of gradient sensing and chemotaxis:conserved pathways,diverse regulation. Cell Cycle,2006,5(11):1130~1134
3.Dormann D,Weijer CJ.Chemotactic cell movement during development.Curr Opin Genet Dev,2003,13(4):358~364
4.Thomas D Pollard,John A Cooper.Actin,a central player incellshapeandmovement.Science,2009,27: 1208~1212
5.Small JV,Rottner K,Kaverina I,Anderson KI.Assembling an actin cytoskeleton for cell attachment and movement. Biochimica et Biophysica Acta,1998,1404:271~281
6.Matsumura F,Yamashiro S.Caldesmon.Curr Opin Cell Biol,1993,5(1):70~76
7.Marston SB,Huber PAJ(Eds).Caldesmon.Biochemistry of smooth muscle contraction.San Diego,CA:Academic Press,Inc.1996
8.Wang CL.Caldesmon and smooth-muscle regulation.Cell Biochem Biophys,2001,35(3):275~288
9.Bretscher A.Thin filament regulatory proteins of smoothand non-muscle cells.Nature,1986,321(6072):726~727
10.Warren KS,Lin JL,Wamboldt DD,Lin JJ.Overexpression of human fibroblast caldesmon fragment containingactin-, Ca++/calmodulin-,and tropomyosin-binding domains stabilizes endogenous tropomyosin and microfilaments.J Cell Biol, 1994,125(2):359~368
11.Pittenger MF,Kistler A,Helfman DM.Alternatively spliced exonsofthebetatropomyosingeneexhibitdifferent affinities for F-actin and effects with nonmuscle caldesmon.J Cell Sci,1995,108(Pt 10):3253~3265
12.Humphrey MB,Herrera-Sosa H,Gonzalez G,Lee R,Bryan J.Cloning of cDNAs encoding human caldesmons.Gene, 1992,112(2):197~204
13.Dabrowska R,Hinssen H,Galazkiewicz B,Nowak E. Modulationofgelsolin-inducedactin-filamentseveringby caldesmonandtropomyosinandtheeffectofthese proteins on the actin activation of myosin Mg2+–ATPase activity.Biochem J,1996,315(Pt 3):753~759
14.Ishikawa R,Yamashiro S,Matsumura F.Annealing of gelsolin-severedactinfragmentsbytropomyosininthe presence of Ca2+.Potentiation of the annealing process by caldesmon.J Biol Chem,1989,264:16764~16770
15.Takiguchi K,Matsumura F.Role of the basic C-terminal half of caldesmon in its regulation of F-actin:comparison betweencaldesmonandcalponin.JBiochem(Tokyo), 2005,138:805~813
16.Novy RE,Sellers JR,Liu LF,Lin JJC.In vitrofunctional characterization of bacterially expressed human fibroblast tropomyosin isoforms and their chimeric mutants.Cell Motil Cytoskeleton,1993,26:248~261
17.Yamashiro-Matsumura S,Matsumura F.Characterization of 83-kilodalton nonmuscle caldesmon from cultured rat cells: stimulation of actin binding of nonmuscle tropomyosin and periodic localization along microfilaments like tropomyosin.J Cell Biol,1988,106:1973~1983
18.Bretscher A,Lynch W.Identification and localization of immunoreactiveformsofcaldesmoninsmoothand nonmuscle cells:a comparison with the distributions of tropomyosin and alpha-actinin.J Cell Biol,1985,100: 1656~1663
19.Nakamura N,Tanaka J,Sobue K.Rous sarcoma virustransformedcellsdeveloppeculiaradhesivestructures along the cell periphery.J Cell Sci,1993,106(Pt 4): 1057~1069
20.TanakaJ,WatanabeT,NakamuraN,SobueK. Morphologicalandbiochemicalanalysesofcontractile proteins(actin,myosin,caldesmon and tropomyosin)in normal and transformed cells.J Cell Sci,1993,104(Pt 2): 595~606
21.Hegmann TE,Schulte DL,Lin JLC,Lin JJC.Inhibition of intracellulargranulemovementbymicroinjectionof monoclonalantibodiesagainstcaldesmon.CellMotil Cytoskeleton,1991,20:109~120
22.Lamb NJ,Fernandez A,Mezgueldi M,Labbe JP,Kassab R,Fattoum A.Disruption of the actin cytoskeleton in living nonmuscle cells by microinjection of antibodies to domain-3 of caldesmon.Eur J Cell Biol,1996,69:36~44
23.KordowskaJ,HetrickT,AdamLP,WangCL. Phosphorylated l-caldesmon is involved in disassembly of actin stress fibers and postmitotic spreading.Exp Cell Res, 2006,312(2):95~110
24.ChenWT.Proteolyticactivityofspecializedsurface protrusions formed at rosette contact sites of transformed cells.J Exp Zool,1989,251:167~185
25.Ochoa GC,Slepnev VI,Neff L,Ringstad N,Takei K, Daniell L,Kim W,Cao H,McNiven M,Baron R,De Camilli P.A functional link between dynamin and the actin cytoskeletonatpodosomes.JCellBiol,2000,150: 377~389
26.Dembo M,Wang YL.Stresses at the cell-to-substrate interface during locomotion of fibroblasts.Biophys J,1999, 76:2307~2316
27.Wang N,Tolic′-N覬rrelykke IM,Chen J,Mijailovich SM, Butler JP,Fredberg JJ,Stamenovic′D.Cell prestress.I. Stiffness and prestress are closely associated in adherent contractile cells.Am J Physiol Cell Physiol,2002,282: C606~616
28.Tolic′-N覬rrelykke IM,Butler JP,Chen J,Wang N.Spatial and temporal traction response in human airway smooth muscle cells.Am J Physiol Cell Physiol,2002,283(4): C1254~1266
29.Butler JP,Toli-N覬rrelykke IM,Fabry B,Fredberg JJ. Traction fields,moments,and strain energy that cells exert on their surroundings.Am J Physiol Cell Physiol,2002, 282(3):C595~605
30.Condeelis J.The biochemistry of animal cell crawling. Motion analysis of living cell.New York:Wiley-Liss,1998. 85~100
Abstract:Light chain(l-CaD)is an important actin binding protein,presents almost all types of vertebrate cells.In vitrostudies showed that l-CaD can bind to G-actin to accelerate the polymerization of the G-actin into F-actin and stabilize the formed F-actin.Upon phosphorylation,the l-CaD will disassociate from the F-acin to facilitate its disassembly into G-actin.In order to explore whether the l-CaD mediate the cell mobility by its effect on cytoskeleton,Human breast cancer cell line MCF-7 was chosen as experimental model in which the expression level of l-CaD is very low.By transfection,wild type l-CaD and its phosphorylationmutant(A1234-CaDunphosphorylatableCaD;D1234-CaDphosphorylatedCaD)were force-expressed in MCF-7 cells.First,the effect of the l-CaD on cytoskeleton structure was tested by confocal images;and then the transwell assay was performed to address the influence of l-CaD on cell migration activities;Furthermore,the cell contractility and cell detachment which are sub-steps of cell migration were addressed by Fourier-Transform traction microscopy on single cell level and trypsin stimulation respectively.The results showed that l-CaD had significant effect on cytoskeleton structure of MCF-7 cells. The unphosphorylated l-CaD concentrated on cytoskeleton,increased its intensity which generated more cell contractility and inhibited the response of the cells to the trypsin stimulation.Because of the stabilization effect on cytoskeleton by unphosphorylated l-CaD,the rearrangement of the cytoskeleton was inhibited which resulted in the decrease of the cell migration activities;The phosphorylated l-CaD has very low affinity to the cytoskeleton,so its effect on cell mobility was not significant compared to the controlled cells.Taken together,upon phosphorylation,the l-CaD acted like a"protein switch",it will mediate the cell mobility by its effect on cytoskeleton disassembly and rearrangement.
Key Words:l-Caldesmon;Cytoskeleton;Cell mobility;Cell contractility
Caldesmon Regulate The Mobility of Tumor Cells by Mediating The Actin Cytoskeleton Stability
JIANG Qifeng1,2,CAI Shaoxi1,YAN Xiaoqing1
1.Key Laboratory of Biorheological Science and Technology(Chongqing University), Ministry of Education,Bioengineering college,Chongqing University,Chongqing 400044,China;
2.Boston Biomedical Research Institute,Boston 02472,USA
Q245,Q319
2009-10-16;接受日期:2010-01-05
国家自然科学基金项目(10872224)和“111”项目
蔡绍皙,电话:(023)65112097,E-mail:sxcai@cqu.edu.cn
This work was supported by grants from The National Natural Science Foundation of China(10872224)and"111"project
Received:Oct 16,2009Accepted:Jan 5,2010
Corresponding author:Cai Shaoxi,Tel:+86(23)65112097,E-mail:sxcai@cqu.edu.cn