转录因子在哺乳动物围着床期的作用
张丽英,王连邦,冯需辉,单春华
1.东北林业大学生命科学学院,哈尔滨150040;
2.厦门大学生命科学学院,厦门361005
转录因子在哺乳动物围着床期的作用
张丽英1,王连邦1,冯需辉2,单春华1
1.东北林业大学生命科学学院,哈尔滨150040;
2.厦门大学生命科学学院,厦门361005
胚胎着床是非常复杂的生理过程,既需要胚胎具有着床能力,又需要子宫处于接受态。在围着床期,很多转录因子的表达发生变化。一个转录因子可以调控多个靶基因,一个基因也可同时受到多个转录因子的调控,从而形成复杂的基因表达网络调控机制,这对胚胎着床是非常重要的。文章对在围着床期起重要作用的转录因子进行了综述。
胚胎着床;转录因子;蜕膜化;子宫接受态
0 引言
胚胎着床的关键是处于活化态胚胎与处于接受态子宫相互识别,建立紧密的联系。围着床期主要包括着床前期(对小鼠而言指妊娠第1~4天)、着床期(对小鼠而言指妊娠第4~5.5天)、着床后期(对小鼠而言指妊娠第5.5天以后)。成年雌鼠与雄鼠交配后,以见栓当日为妊娠第1天(详见图1)。在围着床期间,许多转录因子表达发生变化,主要是通过调控子宫或胚胎中的相关基因,直接或间接地影响蜕膜化等胚胎着床进程。
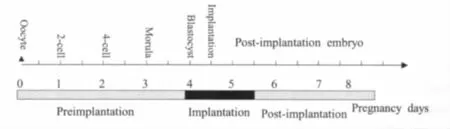
图1 胚胎着床过程同品系的雌鼠与雄鼠交配诱导妊娠,次日见栓确认为妊娠第1天,胚胎在妊娠第4天午夜着床,此时为妊娠第4.5天。着床期指妊娠第4天到妊娠第5.5天,着床前期指妊娠第1天到妊娠第4天,着床后期指妊娠第5.5天以后Fig.1The process of embryo implantationAdult females were mated with fertile males of the same strain to induce pregnancy(day 1=day of vaginal plug),embryo implants on the midnight of day 4,when it is day 4.5 of pregnancy.Implantation:from day 4 to day 5.5 of pregnancy; pre-implantation:from day 1 to day 4 of pregnancy;post-implantation:after day 5.5 of pregnancy
1 在着床前期子宫中发挥作用的转录因子
1.1 同源盒基因
同源盒基因通过与DNA结合激活或抑制靶基因,调节多基因家族的转录,决定细胞的定向分化与增殖,调控胚胎发育。同源盒基因A10(homeboxA10,HOXA10)、同源盒基因A11(homebox A11,HOXA11)和H6同源异型框3(H6 homeobox 3,Hmx3)在胚胎着床前期发挥重要作用。
小鼠早期妊娠第1~2天,HOXA10在子宫腔上皮和腺上皮强表达;第3天,在子宫腔上皮和腺上皮的表达量下降,但在上皮下的间质细胞开始表达;第5~8天,只在蜕膜细胞表达;当间质细胞在第8天完成了蜕膜反应后,表达量开始下降[1]。HOXA10是着床过程中孕酮发挥作用的介导分子。HOXA10敲除的小鼠基质细胞不能进行蜕膜化,从而导致不育,但仍能够启动胚泡的黏附[2]。狒狒子宫内膜中,转录因子FKHR和HOXA10共同作用导致胰岛素样生长因子结合蛋白-1(insulin-like growth factor binding protein-1,IGFBP-1)表达。IGFBP-1是蜕膜化细胞的一个主要产物,并在蜕膜化和滋养层细胞侵入的交互作用中起关键作用[3~4]。HOXA10基因的蛋白产物可直接调控子宫内膜接受性的标志分子——整合素β3的表达,当HOXA10表达降低时,整合素β3 mRNA表达也随之降低[5]。HOXA10可能通过调控整合素β3、IGFBP-1等基因从而影响子宫内膜接受态的建立。
HOXA11对建立子宫接受态及促进胚泡的着床是非常重要的。Gendron等[6]用原位杂交技术发现,妊娠第4天的小鼠子宫内HOXA11出现峰值;胚泡植入后(妊娠第5~8天),内膜间质细胞仍有持续表达。HOXA11敲除的小鼠能正常排卵和受精,受精卵也可正常发育成胚泡,但胚泡不能植入子宫。HOXA11基因敲除的小鼠子宫发育不全,白血病抑制因子(leuckemia inbibitory factor,LIF)不表达,几乎无腺体,着床和蜕膜化有缺陷[7]。HOXA11可能通过影响LIF等着床相关基因的表达,改变子宫妊娠环境,进一步影响胚胎着床。在人类胚胎的着床过程中,HOXA10和HOXA11 mRNA的峰值出现与子宫内膜接受态窗口一致,这种分布及其作用与小鼠相似。在前三个月中,HOXA10和HOXA11持续在蜕膜化区表达,但是在妊娠三个月后,没有检测到HOXA11的表达[8]。
大多数Hmx3异常的雌性小鼠具有生殖缺陷。Hmx3在妊娠子宫的肌层中呈基础性表达。Hmx3(-/-)的雌鼠可以受精,并且胚胎经历正常的着床前发育,但不能着床,随后死亡,然而胚胎可在野生型假孕的雌鼠子宫内成功着床。Hmx3(-/-)小鼠,88%不孕,原因是没有着床位点或者蜕膜肿胀。Hmx3(-/-)小鼠的子宫组织外观正常,但包括Wnt(wingless-related MMTV integration site)基因在内的着床标志分子的表达,与野生型鼠相比在着床过程中有所不同:Wnta5不是在宫腔上皮激活而异位于间质,Wnt7a和Wnt4在子宫肌层和腺上皮不再被激活,LIF仍然维持低水平表达。即使是妊娠期,LIF在腺上皮或其他子宫组织的表达也不再增加[9]。Hmx3可能通过影响LIF等着床级联基因的表达来发挥作用。
1.2 核受体超家族
核受体是一类能与顺式作用元件结合的转录调控因子超家族,需要通过配体的作用才能激活,主要调控发育、细胞分化、生殖等相关基因的表达。其中孕酮受体(progesterone receptor,PR)、雌激素受体α(estrogen receptor α,ERα)、雌激素受体β(estrogen receptor β,ERβ)与胚胎的着床紧密相关。
PR包括PR-A和PR-B两个亚型,是由同一基因的不同转录起始位点编码产生的。PR在胚胎着床过程中表达变化明显,在小鼠早期妊娠第1~2天,只在子宫上皮细胞中低表达;第3~4天表达部位扩展到基质细胞中;第5天胚泡着床时,PR仅在着床位点下的基质中表达;第6~8天在蜕膜化细胞中表达。单独敲除PR-A基因(较短的)的小鼠,由于不能发生蜕膜反应而导致着床失败,并存在卵巢功能障碍。单独敲除PR-B(较长的),小鼠体内与妊娠有关的腺体发育异常。同时缺失PR-A和PR-B两种基因的PR(-/-)鼠出现了很多生殖上的缺陷,包括排卵作用受损、子宫增生、缺少蜕膜化[10]。PR需要SRC家族成员及FK506结合蛋白(FK506-binding protein,Fkbp52)的辅助,才能更好的调控下游基因的转录,体外Fkbp52能上调PR的活性。在小鼠妊娠早期,Fkbp52的表达情况也与PR相似,Fkbp52基因敲除的小鼠,PR的转录活性下降,两性调节蛋白、组氨酸脱羧酶和Ihh(Indian hedgehog)等一些受孕酮调节的基因表达减弱[7]。
雌激素受体存在两个主要的亚型:ERa和ERβ[11]。它们既可以通过经典的ERE途径,也可通过非经典途径与其他转录因子〔如转录活化蛋白-1(activatorprotein-1,AP-1)、特异性蛋白1(specificity protein 1,Sp1)、核因子kβ(Nuclear factor-kappa β,NF-κβ)等〕相互作用,调节基因转录[12]。小鼠早期妊娠第1~2天,ERa mRNA在子宫腔上皮和腺上皮表达;第3~4天于基质细胞中表达;第5天,于腔上皮和腺上皮中高表达,着床点下面的基质中表达下降;第6~8天,在次级蜕膜和系膜侧的基质细胞表达[13]。ERa(-/-)的小鼠由于卵巢或子宫发育不全而不育。对ERa(-/-)小鼠子宫注油处理,可诱导产生蜕膜化反应中涉及的基因和信号通路,如PR、HOXA10、环氧合酶2(cyclooxygenase2,COX 2)和LIF。通常,PR、HOXA10、COX2或LIF基因改变的小鼠缺少蜕膜化反应。人为处理蜕膜化后,ERa(-/-)鼠与野生型鼠相比,PR和HOXA10 mRNA水平没改变,PR蛋白在基质中被诱导;LIF表达增加;COX2蛋白和mRNA表达量增加。ERa(-/-)鼠不能够起始并支持着床,或许更多的是由于粘附反应的失败[14]。ERa在围着床期很可能通过调控参与控制粘附反应基因的表达而影响胚胎着床,但具体的机制还不清楚。ERβ mRNA在小鼠早期妊娠子宫中几乎检测不到。ERβ基因敲除后子宫功能正常,仍可以接受胚泡着床[11]。所以在胚胎着床过程中ERa发挥主要作用。
2 着床期及着床后子宫高表达的转录因子的作用
2.1 STAT家族
STAT家族至少有6种不同的STAT。它们广泛表达于不同类型的细胞和组织中,在调节发育、分化、增殖和细胞凋亡等生物学功能方面起着重要作用。目前发现信号传导和转录活化子3(signal transducer and activator of transcription 3,STAT3)在调控子宫内膜细胞蜕膜化及胚胎植入方面发挥着重要作用。
在小鼠早期妊娠第4天夜里,STAT3仅于子宫腔上皮发生较强的磷酸化,而同期的假孕小鼠子宫中检测不到磷酸化;第5天着床位点的基质和胚泡周围的腔上皮发生较强的磷酸化,非着床位点仅有基础水平的磷酸化[15]。STAT3通过很多信号通路对胚胎着床过程产生影响。STAT3可以通过JAK/STAT途径参与子宫内膜容受性的建立和胚胎的植入[16]。胚胎植入子宫内膜时需要金属蛋白酶参与蜕膜化过程,调控金属蛋白酶的组织抑制因子含有能被STAT3识别的启动子[17]。STAT3还可能通过调控金属蛋白酶组织抑制因子的表达来影响子宫内膜基质的重塑,从而参与子宫接受态的建立。
2.2 锌指转录因子家族
基本转录元件结合蛋白(basic transcription element-binding protein,BTEB)属于Krüppel样转录因子家族成员之一,是参与真核细胞基因转录调控的锌指蛋白,主要通过羧基末端锌指结构,与靶基因启动子区的GC或GT/CACC box结合,从而调节靶基因的转录。Snail家族成员编码具有锌指结构的转录因子,它们在胚胎着床、胚胎发生、肿瘤发生、细胞命运决定、细胞周期调控等生理或病理过程中发挥重要作用。
基本转录元件结合蛋白-1(basic transcription element-binding protein-1,BTEB-1)在早期妊娠子宫中与孕酮受体共表达。通过对野生型和BTEB1(-/-)妊娠第1~6天小鼠子宫内膜细胞增殖(BrdU标记)、细胞凋亡(TUNEL)及PR表达(免疫组化)的检测,Michael等[18]发现BTEB1(-/-)鼠腔上皮BrdU标记的PR细胞数目的百分比在第4天出现高峰(野生型在第3天),腺上皮则与野生型一样在第3天出现高峰但会多持续一天。野生型BrdU标记的PR细胞数目百分比在第3天出现高峰,这对于维持到第5天的高水平是非常必要的,但BTEB1(-/-)的峰值却出现在第4天。另外,野生型小鼠PR阳性的基质细胞数目与腔上皮增殖的数目负相关,而BTEB1(-/-)小鼠见栓前三天没有检测到这种现象。Michael等认为这些变化导致准备着床的胚胎和子宫内膜发育不同步,从而支持了BTEB1(-/-)鼠不育的观点,并认为BTEB1通过调节孕酮受体转录活性,参与由孕酮受体调控的腔上皮的增殖,这对创建成功着床的子宫接受态是非常重要的。
Snail在小鼠早期妊娠第1~4天子宫中表达水平很低;第5天,在着床胚胎周围的基质细胞中瞬时强表达,非着床位点则检测不到[19],假孕的小鼠子宫中检测不到其表达。当胚胎处于休眠状态时,无Snail表达,用雌激素处理启动胚胎着床后,检测到Snail的特异表达。Vega等[20]认为Snail通过抑制Cyclin D2的转录来阻断细胞周期而抵抗细胞死亡,因为Cyclin D2基因启动子包含两个Snail结合的E-box,而且该区域在小鼠、人、大鼠上是保守的。另外,Herfs等[21]证明Snail基因能够抑制紧密连接的相关蛋白的表达,因此,在胚胎着床位点处表达的Snail,不仅可防止该处的细胞发生死亡,还可阻止在该处形成紧密连接,从而有利于胚胎穿过内膜,与血管建立联系。
Slug是Snail锌指转录因子家族成员之一。杜芳等[22]通过RT-PCR和免疫组化检测发现,Slug在小鼠早期妊娠第1~3天的上皮和基质细胞表达逐渐增加;第4天达到高峰;第5天表达开始下降;第6~7天弱表达。高表达的Slug与E-钙黏蛋白启动子近端的E-box相互作用,从而抑制E-钙黏蛋白的表达,这有利于上皮细胞向间质细胞转化,增加滋养层细胞侵袭能力,也利于子宫内膜上皮细胞获得接受性[23]。E-钙黏蛋白的抑制也会使细胞连接复合体减少,从而影响细胞间的粘连和信号的传导,所以杜芳等认为Slug的表达利于胚泡对母体子宫内膜的侵入。
2.3 E26转化特异性家族转录因子
ETS转录因子在肿瘤的侵入转移和血管生成过程中发挥重要作用,其亚家族PEA3调节很多与生殖功能相关的基因,如COX2和蛋白酶等。PEA3成员ERM、ER81、PEA3在第4~5天的小鼠围着床期子宫内表达水平较高,且ERM在妊娠第4天的上皮和基质中高表达、第5天的基质和子宫腺体上高表达;ER81和PEA3在第1、4、5天低表达,几乎检测不到;第8天,ERM和PEA3主要在胚胎上表达,母体蜕膜处低水平表达,ER81在子宫系膜蜕膜的血管床高表达。Koo等[24]认为ERM涉及到早期着床事件,ER81涉及母体后来的胎盘脉管系统的形成,PEA3与早期胚胎形态发生有关。PEA3在许多肿瘤细胞中调节血管内皮生长因子[25]、表皮生长因子[26]等基因的表达,但在胚胎着床过程中的调控机制仍不清楚。
2.4 其他的转录因子
过氧化物酶体增殖因子活化受体δ(peroxisome proliferator activated receptorδ,PPARδ)参与胚胎着床过程。PPARδ在小鼠早期妊娠的第1~4天表达水平极低,第5天仅在着床胚泡周围的基质中表达,假孕小鼠第5天子宫中则没有相应的表达。大鼠中,PPARδ仅在妊娠第6天子宫的胚胎着床位点表达[27]。通过观察野生型和PPARδ(-/-)小鼠的着床情况,发现在PPARδ(-/-)的雌鼠中发生了延迟着床。胚泡转移实验证明,母体的PPARδ对于正常着床至关重要。胚胎着床过程中发挥重要作用的前列腺环素就是通过激活PPARδ而影响胚胎着床的[28]。小鼠早期妊娠子宫中,COX2呈现出时空特异性的表达,特别是在第5天的子宫着床位点周围的基质细胞中表达[29]。有研究发现,人的肝癌细胞中,PPARδ的激活增加了COX2启动子的活性,导致COX2的表达及细胞的增殖。但胚胎着床过程中,PPARδ与COX2的相互作用未见报道。尽管母体子宫PPARδ对于正常着床和蜕膜化是非常必要的,但是胚胎源的PPARδ也非常重要,它主要通过与AKT及LIF-STAT3信号通路相互作用,从而促进胎盘形成过程中胚胎滋养层细胞的分化[27]。
溶血磷脂酸受体3(lysophosphatidic acid receptor3,LPA3)在小鼠围着床期子宫内膜存在表达变化。免疫组化法、RT-PCR、Western blot检测结果显示:LPA3在妊娠第1~6天的子宫内膜组织均有表达;第3天表达开始增强;第4天最强;第5天和第6天骤然下降[30]。小鼠胚胎着床间距和时间是由LPA3调节的溶血磷脂酸信号通路调控的。LPA3敲除的小鼠着床前子宫内COX2表达下降,进而导致前列腺素E2和I2水平减少,当外源性的前列腺素E2和I2的类似物注射到LPA3敲除的雌鼠内可以补救延迟着床,但是不能补救胚胎着床间距[31]。可见LPA3可以调控COX2等相关基因的表达而影响胚胎着床,同时受雌、孕激素的调节[32]。
我们将前面提到的在围着床期对胚胎着床发挥重要作用的转录因子总结于表1中。

表1 部分在围着床期子宫对胚胎着床发挥重要作用的转录因子Table 1A partial list of transcription factors found to be critical for uterine function and implantation
3 胚胎表达的转录因子的作用
胚胎上表达的转录因子在着床前后发挥着重要作用。许多与发育相关的转录因子通过影响胚胎的发育影响着床。转录因子敲除的小鼠模型表明:尾型同源盒转录因子2(caudal relatedhomeodomain transcription2,CDX2)、TEA域家族成员4(TEA domain family member4,TEAD4)、热休克蛋白转录因子1(heat shock transcription factor 1,HSF1)和HOXA10等基因的敲除或改变,虽然并没有影响雌鼠的排卵和受精,但着床前的胚胎由于发育失败而致死[33,34];阴阳因子(Yin Yang-1,YY1)、Kruppel样因子6(Krüippel-like factor 6,KLF6)基因的敲除或改变,致使胚胎虽可以着床,但着床后不久胚胎死亡[35,36]。这说明胚胎表达的转录因子对于胚胎的正常发育及着床是必不可少的。还有很多与胚胎发育相关的转录因子,在此不再赘述。
4 结语与展望
胚胎着床是一个复杂的过程。许多转录因子在早期妊娠过程中的表达发生改变并调控靶基因表达:从而在围着床期发挥重要作用,一些转录因子的敲除或抑制会影响胚胎着床。随着基因剔除、基因芯片、蛋白质芯片、RNA干涉等技术的迅速发展,以及信号传递途径研究的深入,鉴定胚胎着床过程中特异性表达的转录因子成为可能,从而使人们能更加深入地了解胚胎着床过程中的分子调控机制,进而为与胚胎着床类似的肿瘤发生机制提供参考,为研制新型避孕药物及肿瘤治疗药物提供理论依据。
1.Satokata I,Benson G,Maas R.Sexually dimorphic sterility phenotypesinHoxa10deficientmice.Nature,1995, 374(6521):460~463
2.田振,杨增明.子宫内膜接受性的建立和分子调控.动物学杂志,2008,43(4):133~139 TianZ,YangZM.Theestablishmentandmolecular regulationofuterinereceptivity.ChineseJournalof Zoology,2008,43(4):133~139
3.Fazleabas AT,Kim JJ,Strakova Z.Implantation:embryonic signalsandthemodulationoftheuterienvironment. Placenta,2004,25:26~31
4.Kim JJ,Fazleabas AT.Uterine receptivity and implantation: theregulationandactionofinsulin-likegrowthfactor bindingprotein-1(IGFBP-1),HOXA10andforkhead transcription factor-1(FOXO-1)in the baboon endometrium. Reprod Biol Endocrinol,2004,2:34
5.DuH,TaylorHS.Molecularregulationofmüllerian development by hoxgenes.Ann NY Acad Sci,2004,1034: 152~165
6.Wong KH,Wintch HD,Capecchi MR.Hoxa11 regulates stromal cell death and proliferation during neonatal uterine development.Mol Endocrinol,2004,18(1):184~193
7.迟毓婧,杨增明.孕酮调节途径在着床过程中的作用.生理科学进展,2008,39(3):275~278 Chi YJ,Yang ZM.Roles of progesterone-regulated genes in embryo implantation.Progress in Physiological Sciences, 2008,39(3):275~278
8.Taylor HS,Igarashi P,Olive DL,Arici A.Sex steroids mediate HOXA11 expression in the human peri-implantation endometrium.JClinEndocrinolMetab,1999,84(3): 1129~1135
9.Kimber SJ.Leukaemia inhibitory factor in implantation and uterine biology.Reproduction,2005,130(2):131~145
10.Wang H,Dey SK.Roadmap to embryo implantation:clues from mouse models.Nat Rev Genet,2006,7(3):185~199
11.Dey SK,Lim H,Das SK,Reese J,Paria BC,Daikoku T, Wang H.Molecular cues to implantation.Endocrine,2004, 25(3):341~373
12.Matthews J,Wihlén B,Tujague M,Wan J,Strm A, Gustafsson JA.Estrogen receptor(ER)beta modulates ERalpha-mediated transcriptional activation by altering the recruitmentofc-Fosandc-Juntoestrogen-responsive promoters.Mol Endocrinol,2006,20(3):534~543
13.杨新玲,杨增明.核受体在胚泡着床生理过程中的调节与功能.生理科学进展,2009,40(4):345~349 Yang XL,Yang ZM.Regulation and function of nuclearreceptorsduringembryoimplantation.Progressin Physiological Sciences,2009,40(4):345~349
14.Curtis H,Goulding EH,Ddy EM,Korach KS.Studies using theestrogenreceptor-knockoututerusdemonstratethat implantation but not decidualization-associated signaling is estrogen dependent.Biol Reprod,2002,67:1268~1277
15.Teng CB,Diao HL,Ma XH,Xu LB,Yang ZM.Differential expressionandactivationofStat3duringmouseembryo implantation and decidualization.Mol Reprod Dev,2004, 69(1):1~10
16.赵义清,章汉旺.STAT3在小鼠胚胎围着床期子宫内膜的表达与活化.中国妇幼保健,2007,22(13):1800~1802 Zhao YQ,Zhang HW.Expression and activation of STAT3 in endometrium during peri-implantation period of mouse embryo.MaternalandChildHealthCareofChina, 2007,22(13):1800~1802
17.Fitzgerald JS,Poehlmann TG,Schleussner E,Markert UR. Trophoblastinvasion:theroleofintracellularcytokine signallingviasignaltransducerandactivatorof transcription 3(STAT3).Hum Reproduction Update,2008, 14(4):335~344
18.Velarde MC,Geng Y,Eason RR,Simmen FA,Simmen RC.NullmutationofKrüppelLikeFactor9/Basic transcriptionelementbindingprotein-1alters peri-implantation uterine development in mice.Biol Reprod, 2005,73(3):472~481
19.Ma XH,Hu SJ,Yu H,Xu LB,Yang ZM.Differential expressionoftranscriptionalrepressorsnailgeneat implantation site in mouse uterus.Mol Reprod,2006, 73(2):133~141
20.Vega S,Morales AV,Ocaa OH,Valdés F,Fabregat I, NietoMA.Snailblocksthecellcycleandconfers resistancetocelldeath.GenesDev,2004,18(10): 1131~1143
21.Herfs M,Hubert P,Kholod N,Caberg JH,Gilles C,Berx G,Savagner P,Boniver J,Delvenne P.Transforming growthfactor-β1-mediatedSlugandSnailtranscription factor up-regulation reduces the sensity of langerhans cells in epithelial metaplasia by affecting E-cadherin expression. Am J Pathol,2008,172(5):1391~1402
22.杜芳,杨戎,魏莎莉,马海兰,王庆跃.锌指转录因子Sl ug在早孕小鼠子宫内膜的表达.生殖与避孕,2008,28(10):77~581 Du F,Yang R,Wei SL,Ma HL,Wang QY.Expression of Sluggeneinendometriumofearlypregnantmouse. Reproduction&Contraception,2008,28(10):577~581
23.BolósV,PeinadoH,Pérez-MorenoMA,Fraga MF, Esteller M,Cano A.The transcription factor Slug represses E-cadherin expression and induces epithelial to mesenchymal transitions:a comparison with Snail and E47 repressors.J Cell Sci,2003,116(3):499~511
24.Koo BT,Song H,Moon I,Han K,Chen C,Murphy K,Lim H.Differential expression of the PEA3 subfamily of ETS transcriptionfactorsinthemouseovaryandperiimplantation uterus.Reproduction,2005,129(5):651~657
25.Hua D,Chen B,Bai M,Yu H,Wu X,Jin W.PEA3 activates VEGF transcription in T47D and SKBR3 breast cancer cells.Acta Biochim Biophys Sin,2009,41(1):63~68
26.Cowden Dahl KD,Zeineldin R,Hudson LG.PEA3 is necessaryforoptimalepidermalgrowthfactorreceptorstimulated matrix metalloproteinase expression and invasion of ovarian tumor cells.Mol Cancer Res,2007,5(5): 413~421
27.Ding NZ,Teng CB,Ma H,Ni H,Ma XH,Xu LB,Yang ZM.Peroxisomeproliferatoractivatedreceptordelta expression and regulation in mouse uterus during mmbryo implantation and decidualization.Molecula Reproduction and Development,2003,(66):218~224
28.Wang H,Xie H,Sun X,Tranguch S,Zhang H,Jia X, Wang D,Das SK,Desvergne B,Wahli W,DuBois RN, DeySK.Stage-specificintegrationofmaternaland embryonic peroxisome proliferator-activated receptor(PPAR) signaling is critical to pregnancy success.J Biol Chem, 2007,282(52):37770~37782
29.Lee KY,Jeong JW,Tsai SY,Lydon JP,DeMayo FJ. Mouse models of implantation.Trends Endocrinol Metab, 2007,18(6):234~239
30.Hama K,Aoki J,Inoue A,Endo T,Amano T,Motoki R, Kanai M,Ye X,Chun J,Matsuki N,Suzuki H,Shibasaki M,Arai H.Embryo spacing and implantation timing are differentially regulated by LPA3-mediated Lysophosphatidic acid signaling in mice.Biol Reprod,2007,77(6):954~959
31.Ye X,Hama K,Contos JJ,Anliker B,Inoue A,Skinner MK,Suzuki H,Amano T,Kennedy G,Arai H,Aoki J, Chun J.LPA3-mediated lysophosphatidic acid signalling in embryo implantation and spacing.Nature,2005,435(7038): 104~108
32.郭燕红,张雷,邵素霞,尹青,龚淼,张金平,赵静.雌、孕激素对LPA3在小鼠子宫内膜围着床期表达的影响.基础医学与临床,2009,29(2):178~182 Guo YH,Zhang L,Shao SX,Yin Q,Gong M,Zhang JP, ZhaoJ.Effectofestrogenandprogesteroneonthe expressionofLPA3inuterineendometriumduring periimplantation.Basic&Clinical Medicine,2009,29(2): 178~182
33.Nishioka N,Yamamoto S,Kiyonari H,Sato H,Sawada A, OtaM,NakaoK,SasakiH.Tead4isrequiredfor specificationoftrophectoderminpre-implantationmouse embryos.Mech Dev,2008,125(3-4):270~283
34.Metchat A,Akerfelt M,Bierkamp C,Delsinne V,Sistonen L,Alexandre H,Christians ES.Mammalian heat shock factor1isessentialforoocytemeiosisanddirectly regulates Hsp90alpha expression.J Biol Chem,2009, 284(14):9521~9528
35.Affarel B,Gay F,Shi Y,Liu H,Huarte M,Wu S,Collins T,Li E,Shi Y.Essential dosage-dependent functions of thetranscriptionfactorYinYang1inlateembryonic development and cell cycle progression,Mol Cell Biol, 2006,26(9):3565~3581
36.Pearson R,Fleetwood J,Eaton S,Crossley M,Bao S. Krüppel-like transcription factors:a functional family.Int J Biochem Cell Biol,2008,40(10):1996~2001
Abstract:Embryoimplantationisacomplexphysiologicalprocess,inwhichthereciprocalinteraction betweenanimplantationcompetentblastocystandreceptiveuterusmustbeachieved.Duringperiimplantation,maternal or embryonic transcription factors are spatio-temporal expressed.One transcription factor can control multiple target genes,and one gene can be controled by many transcription factors also, which forms a complex network of regulation.The role of transcription factors in peri-implantation were reviewed in this paper.
Key Words:Embryo implantation;Transcription factor;Decidualization;Receptivity
Transcription Factors in Mammalian Peri-Implantation
ZHANG Liying1,WANG Lianbang1,FENG Xuhui2,SHAN Chunhua1
1.Laboratory of Development Biology,Northeast Forestry University,Haerbin 150040,China;
2.College of Life Science,Xiamen University,Xiamen 361005,China
Q492,R321.3
2009-11-22;接受日期:2010-01-03
东北林业大学引进人才项目
单春华,电话:(0451)82191784,E-mail:chhshan@sina.com
This work was supported by The project of introducing talents from northeast forestry university
Received:Nov 22,2009Accepted:Jan 3,2010
Corresponding author:SHAN Chunhua,Tel:+86(451)82191784,E-mail:chhshan@sina.com