含二苯甲酮结构抗紫外线分散染料中间体的合成
杨洋,孙岩峰,2
(1.大连工业大学 化工与材料学院,辽宁 大连 116034;2.大连理工大学 精细化工国家重点实验室,辽宁 大连 116012)
0 引言
近十几年来,各种工业废气对大气层污染不断加剧,特别是工业氟利昂等氟化物使地球臭氧层遭到严重破坏,这使得太阳光中紫外线对地球表面的辐射量逐渐增强,对人们的健康造成严重损害[1]。目前,世界皮肤癌患者正在以每年3%的速度增长,面对“紫外杀手”,各国都在进行紫外线防护产品研究。我国是染料和纺织品生产与出口的大国,为满足市场的需要并与发达国家接轨,2002年我国发布了《纺织品防紫外线性能的评定》方法(GB/T 18830-2002)。此后,各种抗紫外线服装与设施应运而生。而解决服装抗紫外线的方法主要有两条途径[2-4],一是直接向纤维中添加超细陶瓷粉等来提升织物对紫外线的反射能力,国外各大公司都在开发这种功能型纤维;二是在染整过程中,加入紫外线吸收剂,对纤维进行后处理来提升织物的抗紫外能力。然而,外加紫外吸收剂方法存在用量大、与织物纤维结合力弱(分子间作用力)、容易从纤维上脱落以及常常使织物产生色变等缺点[5]。研究发现[6],二苯甲酮与三嗪类衍生物是一类安全、高效的抗紫外产品,能够有效地吸收290~400nm的紫外线。为此,设想将两种紫外线吸收结构直接引入染料分子结构之中,使得纤维经过染色处理后,直接得到抗紫外线的纺织品,从根本上解决外加抗紫外线吸收剂的缺点。作者曾制备了含三嗪结构的分散染料,并取得很好的应用效果[7]。
本文选取含有二苯甲酮结构的氨基衍生物为研究对象,用间硝基苯甲酰氯、间苯二酚(二甲醚)等为主要原料,经过Friedel-Crafts酰化、烷基化、催化氢化等反应步骤,合成了6个含二苯甲酮结构的衍生物。希望利用这一系列染料中间体与不同的耦合组分反应制得具有抗紫外性能的分散染料,使得纤维经过染色处理后,直接得到抗紫外线的纺织品,从根本上解决外加抗紫外线吸收剂的缺点。
1 实 验
1.1 仪器与试剂
仪器:HP1100高效液相色谱/质谱联机系统,美国HEWLETTPACKARD公司;FTIR-430红外光谱仪,日本JASCO公司;Varian INOVA 400NMR谱仪,美国Varian INOVA公司;中间体含量用美国HEWLETTPACKARD公司HP1050高效液相色谱仪测定;色谱柱,SpherisorbC18(5μm,250mm×4.6mm);流动相,V(甲醇)∶V(水)=95∶5。
试剂:所用试剂均为市售化学纯或分析纯。
1.2 含二苯甲酮结构中间体的合成
本实验合成6个含二苯甲酮结构中间体,工艺流程见图1。
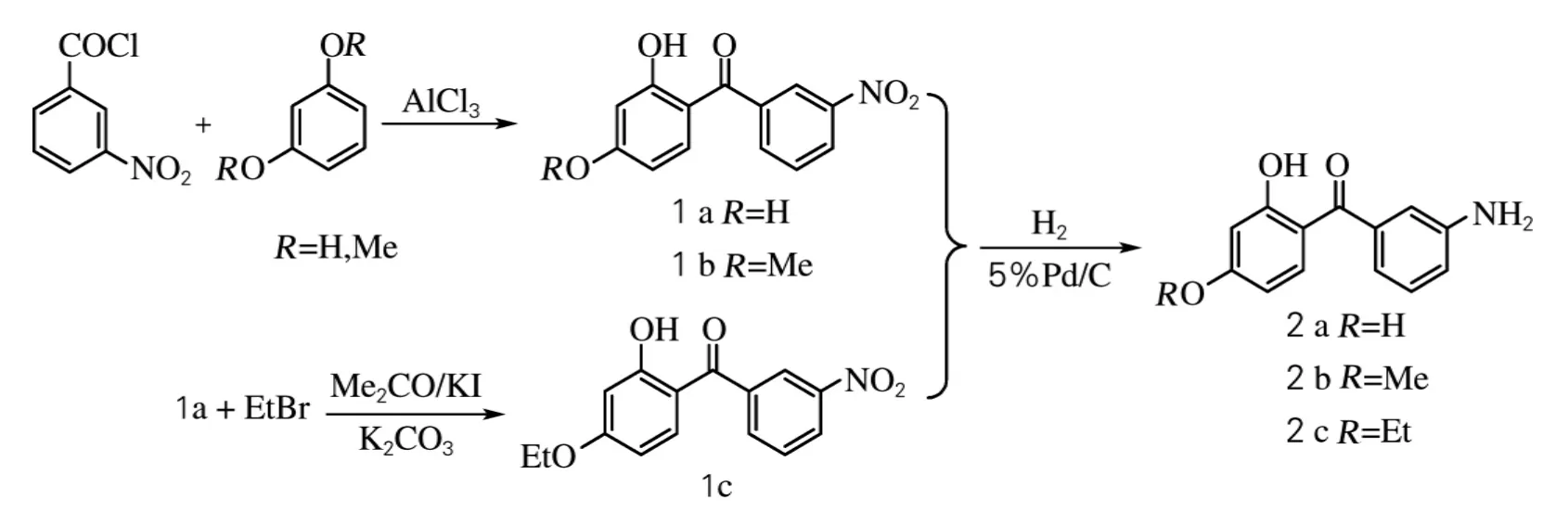
图1 中间体1a~1c,2a~2c的合成Fig.1 Synthesis of intermediates 1a-1c,2a-2c
1.2.1 2,4-二羟基-3′-硝基二苯甲酮(1a)的合成
将100mL氯苯与20g间硝基苯甲酰氯(0.108mol)加入三口烧瓶中,搅拌均匀;搅拌下分批加入15.1g无水AlCl3(0.113mol),升温至90℃。缓慢加入13g间苯二酚(0.118mol),再滴加0.06g吡啶,将反应体系温度调整至110℃,反应5 h。降至室温,加入300mL水,用固体NaOH将体系调制强碱,抽滤。用浓HCl将滤液酸洗调至中性,抽滤并干燥。得到固体产物18.1g,产率65%。
1.2.2 2-羟基-4-甲氧基-3′-硝基二苯甲酮(1b)的合成[8]
将30mL CH2Cl2与10g AlCl3(0.075mol)迅速加入适当三口烧瓶中,搅拌下加入4.6g间硝基苯甲酰氯(0.025mol)。冷却至0℃,在30min内滴加3.9g间苯二甲醚(0.028mol),加毕,回流反应3h。降至室温,反应液倒入150g冰与15mL浓盐酸的混合物中,搅拌至溶液分层。分出有机层,用无水MgSO4干燥。除去干燥剂和二氯甲烷。将剩余液倒入甲醇溶液中,有浅黄色固体析出。用甲醇重结晶,得淡黄色晶体4.9g,产率71.8%。
1.2.3 2-羟基-4-乙氧基-3′-硝基二苯甲酮(1c)的合成
将30mL丙酮与8g 1a(0.031mol)加入适当三口烧瓶中,溶解后,加入4.7g K2CO3(0.034mol)、4.0g CH3CH2Br(0.037mol)和0.03g KI。在35℃反应至终点[用薄层色谱法控制终点,展开剂为V(甲苯)∶V(乙酸乙酯)=6∶1]。过滤,除去溶剂,水洗至中性。过滤,干燥得固体产物8.5g,产率为96%,质量分数≥98%。
1.2.4 2,4-二羟基-3′-氨基二苯甲酮(2a)的合成
将50mL无水乙醇与8g 2,4-二羟基-3′-硝基二苯甲酮(0.031mol)加入适当三口烧瓶中,混合均匀后,加入0.4g 5%Pd/C催化剂。检查气密性,用氢气置换体系内空气,控制氢气每秒一个的均匀鼓泡速度,在25℃下常压搅拌反应5h(用薄层色谱法和氨基指示剂控制终点,展开剂为V(甲苯)∶V(乙酸乙酯)=4∶1),过滤回收催化剂,除去溶剂,得7.0g黄色固体2a,产率99.0%。
1.2.5 2-羟基-4-烷氧基-3′-氨基二苯甲酮(2b,2c)的合成
用化合物1b和1c替代1a重复上述实验,分别得浅黄色6.5g氨基化合物2b(产率91.3%)和6.9g 2c(产率96.3%)。
2 结果与讨论
2.1 中间体合成
2.1.1 2,4-二羟基-3′-硝基二苯甲酮(1a)
首先按照文献[9]以间硝基苯甲酰氯和间苯二酚在AlCl3催化下,合成目标产物1a,实验发现,在反应过程中有化合物d形成,见图2。

图2 间苯二酚与间硝基苯甲酰氯的反应过程Fig.2 Reaction process between resorcin and m-nitrobenzoyl chloride
酰氯十分活泼,带有强吸电子基时,更加活泼,酰氯遇到间苯二酚首先形成化合物d与e,在无水三氯化铝的作用下,化合物e发生Fries重排,形成目标分子1a。而化合物d则不发生重排。但是反应结束后,可以利用d与目标产物1a在碱溶液的溶解性能差异顺利将二者分开。实验考查了反应时间、AlCl3的用量以及反应物的量比对反应的影响,见表1。

表1 反应时间、AlCl3的用量及反应物的物质的量比对反应的影响Tab.1 Effect of reaction time,AlCl3quantity and molar ratio of the raw material on the reaction
由表1可以看出,以氯苯作为溶剂,间硝基苯甲酰氯与间苯二酚的摩尔配比为1∶1.1,反应物与催化剂AlCl3摩尔比为1∶1.05,反应温度在110℃,反应时间为5h,反应结果较好。延长反应时间或增加间苯二酚与催化剂的用量对反应的产率影响不大。
2.1.2 2-羟基-4-甲氧基-3′-硝基二苯甲酮(1b)
间二苯甲醚与间硝基苯甲酰氯的反应过程实质上是Friedel-Crafts反应,但反应过程伴随着邻位甲氧基的脱甲基反应,其反应机理见图3。
首先,按照传统的Friedel-Crafts反应机理,在反应体系中形成了过渡态Ⅰ。然后羰基邻位上甲氧基中,氧上的孤对电子作为Lewis碱与三氯化铝中铝原子的空轨道发生配位(电子转移),结果形成六元环过渡态Ⅱ,与此同时邻位甲氧基中的C—O键强度被削弱,最终断裂生成氯甲烷,以及稳定的金属络合物Ⅲ。最后,络合物Ⅲ在冰水与浓盐酸的混合溶液中发生水解即得到2-羟基-4-甲氧基-3′-硝基二苯甲酮。
2.1.3 2-羟基-4-乙氧基-3′-硝基二苯甲酮(1c)

图3 Friedel-Crafts反应机理Fig.3 Friedel-Crafts Reaction mechanism
2,4-二羟基-3′-硝基二苯甲酮O-乙基化后可以得到其相应的烷基化产物[10]。1a分子中有2个羟基,但是两个羟基化学环境不同,其中2位羟基上的氢原子容易形成分子内氢键使其不易发生O-乙基化,相比之下,4位羟基上的氢原子更容易与卤代烷进行O-乙基化得到产物1c。在1a和1c的1H NMR谱(图4)中可以明显地看到,当1a进行烷基化得到1c时,4位上的氢原子在核磁谱图中信号消失。实验采用C2H5Br作为烷化剂,丙酮为溶剂,KI为催化剂,K2CO3作缚酸剂,顺利得到目标分子1c,用薄层色谱V(甲苯)∶V(乙酸乙酯)=6∶1,Rf=0.7跟踪终点。

图4 化合物1a和1c的1 H NMR谱图Fig.4 1 H NMR spectrum of compounds 1aand 1c
2.1.4 含二苯甲酮结构的氨基衍生物(2a~2c)
将含二苯甲酮结构的硝基衍生物进行还原可得到相应的氨基物(图1)。将硝基还原为氨基主要采用催化加氢、活泼金属还原、硫化碱还原与水合肼还原等方法。本文选择5%Pd/C作催化剂,95%乙醇为溶液对硝基物进行常压还原即获得良好效果。实验发现,催化剂用量、反应温度、压力以及反应介质pH值等均对催化加氢结果产生影响。在温度过高、压力较大的情况下,在薄层色谱上可出现3、4个斑点,这可能是由于部分羰基也被还原。在还原2,4-二羟基-3′-硝基二苯甲酮时,只有在中性条件下,硝基物才能被顺利还原。
2.2 结构表征
2.2.1 中间体的IR、1H NMR、MS数据
对合成的6个中间体通过红外、核磁共振及质谱分析,结果见表2。由表2可见,化合物1a~2c的红外光谱中,在1 600cm-1左右有明显的羰基吸收峰,此处的羰基吸收峰比通常的羰基吸收峰位置向低波数方向有明显位移。一方面该化合物中酮羰基与苯环具有很强的共轭效应。另一方面,羰基与其邻位的酚羟基上的氢形成了分子内氢键,两种因素都减弱了羰基的双键性,使其键强度下降,吸收峰向低波数有较大位移。红外光谱谱图中,化合物1a~1c在1 535、1 340cm-1左右有明显的硝基吸收峰,经过还原反应后,得到化合物2a~2c,硝基吸收峰消失,在3 460、3 360cm-1左右有明显的氨基吸收峰。
化合物1a~1c由于硝基的吸电子作用,硝基邻位上的两个氢原子的化学位移分别出现在低场8.38和8.43~8.47,而当硝基还原为氨基时,这两个氢原子的化学位移则相应地出现在高场7.22和7.20~7.22。另外,化合物1a~2b在核磁氢谱中,羟基上的活泼氢的化学位移均在12附近。这些有力的证据也为最终确定化合物1a~2b的结构提供了重要的信息。
2.2.2 中间体的紫外吸收光谱
合成的中间体2a、2b、2c化合物紫外吸收光谱见图5。由图5可见,从中间体2a、2b、2c紫外吸收光谱中可以看到,3个中间体化合物都能够强烈广泛地吸收290~350nm的紫外线。

表2 二苯甲酮结构中间体结构分析Tab.2 Structural analyses of intermediates containing benzophenone moiety

图5 化合物2a、2b、2c的紫外吸收光谱谱图Fig.5 UV absorption spectra of compounds 2a,2b,2c
3 结论
以间硝基苯甲酰氯、间苯二酚(二甲醚)为主要原料,经过Friedel-Crafts酰化、烷基化、催化氢化等反应合成了6个含二苯甲酮结构的中间体,利用IR、MS、1H NMR对其化学结构进行表征,结果正确。化合物2a~2c在紫外吸收光谱中,能够吸收290~350nm的紫外线。并且用单因素试验考察了合成化合物1a的最佳条件:以氯苯作为溶剂,反应温度110℃,反应时间为5h,n(间硝基苯甲酰氯)∶n(间苯二酚)∶n(AlCl3)=1∶1.1∶1.05。产品的产率为65%。

