OmpR 与PhoP高渗应激下交叉调节伤寒沙门菌基因表达
生秀梅,徐顺高,张海方,许化溪,黄新祥
(江苏大学医学技术学院,江苏镇江替换为 212013)
OmpR 与PhoP高渗应激下交叉调节伤寒沙门菌基因表达
生秀梅,徐顺高,张海方,许化溪,黄新祥*
(江苏大学医学技术学院,江苏镇江替换为 212013)
为了探寻OmpR和PhoP之间的交叉调节关系,构建了 ompR-phoP双缺陷变异株,运用基因芯片分析技术比较了伤寒沙门菌ompR缺陷株、phoP缺陷株及ompR-phoP双缺陷株之间基因表达谱的差异.结果显示OmpR与PhoP共同激活11个基因的转录,主要为外膜孔蛋白相关基因、脂多糖修饰相关基因等,两者在调节特定的膜蛋白、孔蛋白及表面结构成分的表达水平方面发挥着协同作用,OmpR与PhoP对未知功能蛋白基因t0563、t0564也具有协同激活效应,值得进一步关注.OmpR与PhoP共同抑制 nanT的转录,阻止唾液酸的转运.另外,ompR缺陷株和phoP缺陷株中未见变化,而ompR-phoP双缺陷变异株中差异表达基因也可能是OmpR和PhoP的共同调节元,但需要进一步验证.
伤寒沙门菌;OmpR;PhoP;基因表达调节
伤寒沙门菌(S almvnelia entenicaserovar Typhi,S.Typhi)是一种具有鞭毛的革兰阴性人类肠道致病菌,也是一种重要的原核生物研究用模式菌[1-3].伤寒沙门菌进入人体后遭遇多种环境的胁迫,如胃部的强酸,肠道的高渗和胆汁,网状内皮细胞的高氧等[4].此时,伤寒沙门菌通过启动胞内由细胞膜上特殊的感受分子与胞内的效应调节分子相偶联构成的双组分调节系统(two-component regulatory system)对环境进行应答,调节基因表达和代谢反应,从而得以在人体内生存并感染宿主细胞[5-7].目前,在沙门菌和埃希菌(Escherichia)中已发现有数10种双组分调节系统[8].EnvZ/OmpR和PhoQ/PhoP为两对较为重要的双组份调节系统.其中OmpR是目前肠杆菌科中研究最多的渗透压调节因子,能协同调节某些细菌毒力基因的表达;PhoP则主要参与细菌的毒性及细菌对环境应激的耐受能力等有关的调节[9-12].
近年来有研究发现,不同双组分调节系统之间存在着网络化交叉调节作用,如 E.coliK-12中的AcrB/ArcA和 EnvZ/OmpR,在厌氧条件下能共同调节外膜孔蛋白的表达[13],伤寒沙门菌 SPI-2基因的表达受到调节因子SsrB和OmpR的双重影响等[14].本室前期基于沙门菌基因组寡核苷酸芯片进行的相关研究中发现,在高渗应激初期,OmpR和PhoP均明显上调,提示高渗应激条件下OmpR、PhoP可能存在交叉调节作用[15].
鉴于此,本研究将应用伤寒沙门菌全基因组DNA芯片基因表达谱技术比较野生型伤寒沙门菌、伤寒沙门菌om pR缺陷株、phoP缺陷株及ompR-phoP双缺陷株之间基因表达谱的差异以期获得OmpR、PhoP以及OmpR和 PhoP共同调节的靶基因,为阐明细菌基因表达调控网络提供证据.
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 伤寒沙门菌 GIFU10007、大肠埃希菌 E.coliSPY372λpir、自杀质粒 p GMB151为日本岐阜大学惠赠,本室保存;伤寒沙门菌 GIFU10007ompR基因缺陷型变异株、phoP基因缺陷型变异株及携带有伤寒沙门菌 phoP基因缺陷性同源片段的自杀质粒的大肠埃希菌 E.coli SPY372λpir为本室制备.
1.1.2主要试剂 rTaqDNA聚合酶、缓冲液和dN TPs均购自 TaKaRa公司(大连);质粒提取试剂盒购自 Promega公司(美国);荧光染料Cy3、Cy5购自 Amersham Pharmacia biotech公司(美国);总 RNA提取试剂盒购自 QIA GEN公司(美国);反转录试剂盒购自 Invitrogen公司(美国);伤寒沙门菌基因组DNA芯片为本室制备[16].
1.1.3 主要仪器 PCR扩增仪(Mastercycler Personal,Eppendorf公司,德国);凝胶成像系统(Gene Genius Bioimaging system,Gene 公司 ,美国);电转化仪(BIO RAD Gene PulseroII,Bio-Rad公司,美国);核酸检测仪(ND-1000 Spectrophotometer,NanoDrop公司,美国);荧光定量 PCR仪(Rotor-Gene 2000 Real-Time Amplification RC-2072,Corbett Research公司,澳大利亚);基因芯片杂交仪(hybrigene HB-3D,Hybrigene公司,英国);基因芯片扫描仪(GenePixTMPersonal 4100A,Axon Instruments公司,美国).
1.2 方法
1.2.1 伤寒沙门菌om pR-phoP双缺陷株的制备将伤寒沙门菌GIFU10007ompR基因缺陷型变异株培养至对数生长期,以0℃灭菌水洗涤制成所需的电击感受态细菌.使用质粒提取试剂盒按说明书操作从携带有伤寒沙门菌 phoP基因缺陷性同源片段的自杀质粒的大肠埃希菌 E.coliSPY372 λpir中提取含phoP基因缺陷性同源片段的重组自杀质粒.取2μg该质粒与40μL的电击感受态ompR基因缺陷型变异株细胞溶液混合后,加到预冷的电极杯中.电击参数:电容 25μF,电压2.4 kV.电击后立即转入1 mL 37℃预温的SOC营养液中,37℃小幅振摇温浴1h后,接种于LB-氨苄青霉素和链霉素平板,37℃过夜培养.由于自杀质粒带有氨苄青霉素和链霉素抗性基因,首先在含氨苄青霉素和链霉素的LB平板上筛选抗性菌落,增菌培养后,再利用自杀质粒带有的sacB基因特性,在含5%蔗糖的LB平板上筛选耐蔗糖菌落[17].因 phoP基因缺陷性同源性核苷酸片段与原片段大小有差异,可用PCR观察细菌的重组现象,筛选用引物序列为 (P1:5’-TAGGATCCATCTGACCGACTCAACCGTC,P2:5’-AAGGATCCGAA-TGGTATCGACCACCACG).选重组变异株连续传代培养,将连续3次传代都有稳定的完全重组的菌株作为 phoP-ompR基因双缺陷变异株.
1.2.2 细菌培养及总RNA提取 挑取伤寒沙门菌野生株、ompR基因缺陷变异株、phoP基因缺陷变异株、ompR-phoP双缺陷变异株菌落,分别接种于1 mL低渗LB培养基中,37℃振荡(220 r/min)培养过夜,以 1∶100分别转种于30 mL低渗LB培养基中(50 mmol/L NaCl),37℃振荡(220 r/min)培养4 h至对数生长期,向其中加入1.6 mL 5 mol/L的 NaCl溶液(此时为高渗LB培养基,300 mmol/L NaCl),继续培养30 min,冰上放置 10 min后离心(4℃,4 000 r/min,10 min),弃上清,收集菌体.TE buffer-溶菌酶(0.6 mg/mL,p H 8.0)结合磁珠 MORA-EXTRACT(AMR,日本)室温振荡4 min破壁溶菌,RNaeasy mini column(QIAGEN)试剂盒,按说明书操作提取细菌总RNA,用ND-1000 Spectrophotometer(NanoDrop)测浓度及纯度,并取少量于1%琼脂糖凝胶电泳观察质量,DNaseI消化痕量的DNA后,-70℃保存待用.伤寒沙门菌野生株重复6次,其余菌株重复2次.
1.2.3 RNA反转录与cDNA荧光标记 取细菌总RNA各20μg,9碱基随机引物(N9)、基因组特异性引物(genome directed primers,GDP)[18]和反转录酶(SuperScript III,Invitrogen)进行反转录,采用荧光互标策略获得Cy3或Cy5标记cDNA.其中野生型伤寒沙门菌采用C y3标记时,其余菌株均用Cy5标记,野生株用Cy5标记时,其余菌株则用Cy3标记.标记产物纯化后各种缺陷变异株与野生株混合配对与伤寒沙门菌基因组DNA芯片进行杂交(42℃,18 h).具体操作详见参考文献[16].
1.2.4 芯片扫描及数据分析 芯片杂交后用 GenePix Personal 4100A芯片扫描仪(Axon Instruments)扫描芯片,采用 GenePix Pro 6.0软件(Axon Instruments)并辅以 Excel软件进行图片处理和数据分析.计算扣除背景后的各样点荧光信号值(均值).采用全局归一法(global normalization)对双色荧光数据进行标准化处理.并计算每个点杂交后不同荧光物质标记所得信号比值(Ratio),以log(2)Ratio值描述结果,取-1和1(表达1倍差异)作为阈值.
2 结果与讨论
2.1 伤寒沙门菌ompR-phoP双缺陷株的制备
通过将含 phoP基因缺陷性同源片段的重组自杀质粒p GMB151以电转法引入到 GIFU10007ompR基因缺陷变异株中.首先在氨苄青霉素和链霉素平板上筛选抗性菌落,在5%蔗糖平板上筛选耐蔗糖菌落,用PCR观察其重组变异情况.图1为电转后重组菌株的鉴定,z66为伤寒沙门菌特有基因,所挑选菌落检测结果均为阳性,且 PCR扩增ompR基因的结果显示挑选菌落与野生株相比片段较小,而PCR扩增 phoP基因的结果显示除了野生株和1号菌株外全部显示双条带,说明含phoP基因缺陷性同源片段的重组自杀质粒p GMB151已成功转入 GIFU10007ompR基因缺陷变异株中.首次经LB-蔗糖平板筛选的菌落用PCR观察结果,大部分细菌出现大小两个片段,即共价整合体,挑选其中小片段占优势的菌落继续筛选得到完全重组菌株后,在LB平板上连续传代4次,筛选结果均仅有小片段出现(如图2),显示已完全重组,说明该菌株已成为稳定的变异株.

图1 电转后重组菌株的鉴定Fig.1 Zdentification of recombinant strains after electroporation

图2 重组菌第4次传代后PCR鉴定结果Fig.2 PCR results of recombinant Strains artentnansrer for 4 times
2.2 高渗应激后野生株和缺陷株基因表达谱差异
图3和图4显示了伤寒沙门菌ompR缺陷株、phoP缺陷株以及ompR-phoP双缺陷变异株在高渗应激条件下的基因转录情况.从图中可以看出伤寒沙门菌OmpR和PhoP在高渗应激条件下存在着交叉调节作用、同时也具有各自的调节元.
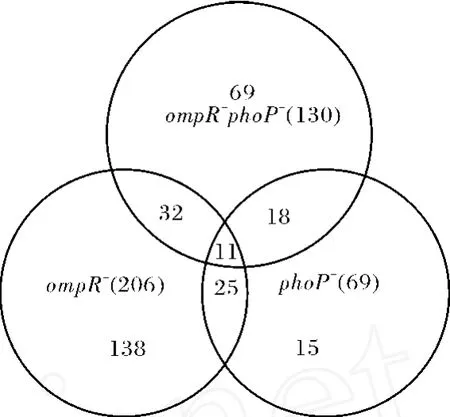
图3 高渗应激30 min 3种伤寒沙门菌缺陷变异株中共同转录下调的基因数目Fig.3 Gene numbers down-regnlated simdtaneously in three deletion mutant strains ofS.Typhi upon up-shift high osmotic treatment for 30 min
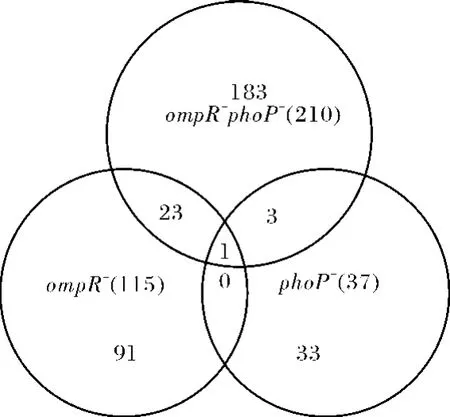
图4 高渗应激30 min 3种伤寒沙门菌缺陷变异株中共同转录上调的基因数目Fig.4 Gene numbers up-regulatal simul to neously in three deletion mutant stnains ofS.Typhiuponup-shift high osmotic treatment for 30 min
2.2.1 高渗应激后ompR单缺陷变异株的基因表达谱分析 将荧光信号较低的不可信数据剔除,对余下数据进行分析,结果显示,在高渗应激30 min,伤寒沙门菌ompR单缺陷变异株相对于野生株而言,有321个基因具有显著的表达差异.其中206个基因表达下调,115个基因表达上调.
高渗应激30 min,ompR突变株中,om pC和omp F相对于野生株而言分别下调12倍和5倍.大肠杆菌om pC和omp F基因编码主要外膜孔蛋白OmpC和OmpF,是 EnvZ/OmpR二元调控系统研究最为详尽的靶标基因[13].我们的研究结果也显示高渗应激条件下,伤寒沙门菌OmpR能诱导主要外膜孔蛋白OmpC和OmpF的转录.
与Vi抗原合成相关的基因簇(vexAB CD E、tviAB CD E)在高渗应激30 min全部下调,且大多下调5倍以上,提示OmpR参与调节Vi荚膜抗原的合成;编码 RNA聚合酶α、β、β亚基基因(rpo-AB C等)下调2~2.5倍,延伸因子 Ts(tsf)下调2倍,说明OmpR对伤寒沙门菌基因的表达具有整体调控作用.
细菌的许多功能如 TCA循环、氨基酸代谢、糖代谢、铁吸收以及各类化合物的结合和转运,能量的生成等对细菌自身的生长都是至关重要的.细菌缺失了某些重要调控基因,将使得上述细胞功能改变或代偿性调节,以应对突变株引起的生长缺陷.从本研究结果来看,编码ATP合酶各亚基基因(atpAB CD EFGH)均转录下调3倍以上,编码物质及能量代谢相关基因(如糖代谢相关 leuB C、f ruA、otsAB、treB C、aceAB K 等、硫代谢相关基因cysA KJ W P等、nuoIJ M N等)明显下调;大部分编码核糖体蛋白合成和修饰、成熟等相关基因(rpl簇,rps簇,rpm簇)均有所下调;下调基因中有部分未知功能基因,从基因所处位置来看,有些基因位于同一操纵子内,可能由同一个启动子启动转录,值得进一步探讨.pmrD、pmrF、slyA等受PhoP调节的基因亦有所下调,提示 OmpR和PhoP具有相同的调节元.
高渗应激30 min,相对于野生株而言,om pR突变株中上调基因主要是鞭毛、动力、趋化及毒力岛相关基因(f lgBD E H IL M N,f liS,f lhAB C,motA,cheAB M Z,sscAB,sseF等).编码与物质的转运和结合有关蛋白的基因(f ruB K、uxuAB、uxaC、glpD EF KR T X、srlMR等)及氨基酸代谢相关基因(hutCU H、aspA)也表达上调,说明 Om pR对这些基因的调控是负向的.
2.2.2 高渗应激后 phoP单缺陷变异株的基因表达谱分析 PhoP与PhoQ构成双组份调节系统,参与脂多糖(LPS)的修饰及环境Mg2+及p H变化引起的胞内基因表达调节[19-20].本研究比较了高渗应激30 min,伤寒沙门菌 phoP单缺陷变异株与野生株表达谱差异.结果显示,有106个基因具有表达差异,其中37个基因转录上调,69个基因转录下调.
与毒力相关基因如 pag P、mgtC、pmrD F等以及转位酶基因 prlA等表达下调,说明转录因子PhoP高渗条件下能够激活抗吞噬因子.许多负责核糖体蛋白合成和修饰、核糖体成熟、蛋白质翻译和修饰以及RNA合成的基因下调,说明 PhoP对伤寒沙门菌基因的整体表达亦具有调节作用.gst表达下调8倍,gst编码的谷胱甘肽S-转移酶具有过氧化酶活性,能保护细胞免受 H2O2损伤.与渗透压相关基因 ompC、env Z也表达下调,再次提示PhoP与OmpR之间存在交叉调节作用.参与能量代谢、呼吸链组分、氨基酸代谢、糖的合成与转运、大小分子的降解等相关基因的表达水平下调,表明phoP突变株在高渗应激条件下的代谢过程较野生株明显减慢.此外,有些未知功能蛋白下调倍数达8倍以上,如 t0563、t0564,有必要进一步研究.
phoP突变株在高渗应激条件下上调基因主要与各种分子的转运、电子传递链及噬菌体休克蛋白相关.psp位点编码噬菌体休克蛋白,该位点最早发现于大肠杆菌中,能辅助细菌在静止期晚期的碱性p H值中存活,被认为在细菌适应宿主生态位中发挥重要作用[21].
2.2.3 高渗应激后ompR-phoP双缺陷变异株的基因表达谱分析 为了揭示 om pR和 phoP交叉调节网络,本研究比较了高渗应激30 min,伤寒沙门菌ompR-phoP双缺陷变异株与野生株表达谱差异.结果显示,有340个基因具有表达差异,其中210个基因转录上调,130个基因转录下调.
om pR-phoP双缺陷变异株下调基因中有43个在ompR单缺陷株中下调,为OmpR调节元;29个在 phoP单缺陷株中下调,为PhoP调节元;其中11个在2个单缺陷株及双缺陷株中全部下调,为OmpR、PhoP共同调节元.表1列出了3种缺陷株在高渗应激30 min相对于野生株全部上、下调的基因.这些共同下调的基因多为外膜孔蛋白相关基因、脂多糖修饰相关基因,说明两者在调节特定的膜蛋白、孔蛋白及表面结构成分的表达水平方面发挥着协同作用.未知功能蛋白 t0563、t0564在3种缺陷株中均表达明显下调,本室在后续研究中将重点关注.
om pR-phoP双缺陷变异株上调基因中有24个在ompR单缺陷株中上调;只有4个在 phoP单缺陷株中上调;其中3个缺陷株中全部上调的基因只有1个(nanT,参与唾液酸的转运,见表1).
om pR缺陷株和 phoP缺陷株中未见变化,而ompR-phoP双缺陷变异株中具有表达差异的基因多为 TCA循环、氨基酸代谢、糖代谢、脂代谢等相关基因,OmpR和PhoP为2个重要的中央调节因子,细菌在同时缺失 om pR和 phoP后,细菌可能通过其他代偿途径维持细菌的存活和生长,这些基因也可能是OmpR和PhoP的共同调节元,但需要进一步验证.

表1 3种缺陷株在高渗应激30 min相对于野生株全部上、下调基因Tab.1 Genes up/down-regulatde in thre deletion mutant strans compared to the wild-type strain ofS.Typhiupon up-shift high osmotic treatment for 30 min
3 小结
EnvZ/OmpR和PhoQ/PhoP为两对较为重要的双组份调节系统.不同双组分调节系统之间存在着网络化交叉调节作用.为了探寻OmpR和PhoP之间的交叉调节关系,我们比较了伤寒沙门菌ompR缺陷株、phoP缺陷株及om pR-phoP双缺陷株之间基因表达谱的差异,结果显示OmpR与PhoP共同激活外膜孔蛋白相关基因、脂多糖修饰相关基因等的转录,两者在调节特定的膜蛋白、孔蛋白及表面结构成分的表达水平方面发挥着协同作用.OmpR与 PhoP共同抑制 nanT的转录,提示两者可能同时阻止唾液酸的转运.OmpR与PhoP对未知功能蛋白 t0563、t0564的协同效应,t0563、t0564的功能,以及OmpR与PhoP具体的交叉调节机制仍有待于进一步阐明.我们的研究结果获得了部分OmpR、PhoP以及OmpR和 PhoP共同调节的靶基因,为阐明细菌基因表达调控网络提供了一定基础.
[1]Everest P,Wain J,Roberts M,et al.The molecular mechanisms of severe typhoid fever[J].Trends Microbiol,2001,9:316-320.
[2]Altier C.Genetic and Environmental Control of Salmonella Invasion[J].J Microbiol,2005,43:85-92.
[3]Jones B D.Salmonella Invasion Gene Regulation:A Story of Environmental Awareness[J].Journal Microbiol,2005,43:110-117.
[4]Pickard D,Li J,Roberts M,et al.Characterization of defined ompR mutants of Salmonella typhi:ompR is involved in the regulation of Vi polysaccharide expression[J].Infect Immun,1994,62:3984-3993.
[5]Nixon B T,Ronson C W,Ausubel F M.Two-component regulatory systems responsive to environmental stimuli share strongly conserved domains with the nitrogen assimilation regulatory genes ntrB and ntrC[J].PNAS USA,1986,83:7850-7854.
[6]Igo M M,Slauch J M,Silhavy T J.Signal transduction in bacteria:kinases that control gene expression[J].New Biol,1990,2:5-9.
[7]Kenney L J.Structure/function relationships in OmpR and other winged-helix transcription factors[J].Curr Opin Microbiol,2002,5:135-141.
[8]Yamamoto K,Hirao K,Oshima T,et al.Functional characterization in vitro of all two-component signal transduction systems from Escherichia coli[J].J Biol Chem,2005,280:1448-1456.
[9]Brzostek K,Raczkowska A,Zasada A.The osmotic regulator OmpR is involved in the response of Yersinia enterocolitica O:9 to environmental stresses and survival within macrophages[J].FEMS Microbiol Lett,2003,228:265-271.
[10]Bernardini M L,Fontaine A,Sansonetti P J.The two-component regulatory system ompR-envZ controls the virulence of Shigella flexneri[J].J Bacteriol,1990,172:6274-6281.
[11]Bang I S,Kim B H,Foster J W,et al.OmpR regulates the stationary-phase acid tolerance response of Salmonella enterica serovar Typhimurium[J].J Bacteriol,2000,182:2245-2252.
[12]Miller S I,Kukral A M,Mekalanos J J.A two-componentregulatory system(PhoP-PhoQ)controls Salmonella typhimurium virulence[J].PNAS USA,1989,86(13):5054-5058.
[13]Cai SJ,Inouye M.EnvZ-OmpR Interaction and Osmoregulation in Escherichia coli[J].J Biolog Chem,2002,277(27):24155-24161.
[14]Feng X,Walthers D,Oropeza R,et al.The response regulator SsrB activates transcription and binds to a region overlapping OmpR binding sites at Salmonella pathogenicity island[J].Mol Microbiol,2004,54:823-35.
[15]Huang X X,Xu H X,Xu S G,et al.Genomic oligo microarray analysis of global transcriptional expression by Salmonella enterica serovar Typhi during hyperosmotic stress[J].Int J Mol Sci,2007,8:116-135.
[16]生秀梅,黄新祥,茅凌翔,等.伤寒沙门菌基因组DNA芯片的制备与基因表达谱分析应用[J].生物化学与生物物理进展,2009,36:206-212.
[17]Huang X X,Phung L V,Dejsirilert S R.et al.Cloning and characterization of the gene encoding the z66 antigen of Salmonella enterica serovar Typhi[J].FEMS Microbiol Lett,2004,234:239-246.
[18]Talat A M,Hunter P,Johnston S A.Genome-directed primers for selective labeling of bacterial transcripts for DNA microarray analysis[J].Nat Biotechnol,2000,18:679-682.
[19]Hitchen P G,Prior J L,Oyston P C,et al.Structural characterization of lipo-oligosaccharide(LOS)from Yersinia pestis:regulation of LOS structure by the PhoPQ system[J].Mol Microbiol,2002,44(6):1637-1650.
[20]Oyston PC,Dorrell N,Williams K,et al.The response regulator PhoP is important for survival under conditions of macrophage-induced stress and virulence in Yersinia pestis[J].Infect Immun,2000,68(6):3419-3425.
[21]Model P,Jovanovic G,Dworkin J.The Escherichia coli phage-shock-protein(psp)operon[J].Mol Microbiol,1997,24(2):255-261.
Abstract:To explore the cross-regulation network of OmpR and PhoP,om pR-phoPdeletion mutant strain was constructed,andS.Ty phigenomic DNA microarray was used to compare the global transcriptional difference betweenompRmutant strain,phoPmutant strain,ompR-phoPmutant strain,and the wild-type strain upon up-shift high osmotic stress.The results showed that transcription of 11 genes were activated and 1 gene was inhibited simultaneously by OmpR and PhoP,respectively.These activated genes encoded outer membrane proteins and lipopolysaccharide modification proteins,which indicated that OmpR and PhoP can together promote the expression of membrane protein,porin and structrual component of bacterial surface.Furthermore,among these activated genes,t0563andt0564with unknown functions are worth further research.On the other hand,OmpR and PhoP inhibited the transcription of nanT simultaneously to prevent the transport of sialic acid.Genes with transcriptional difference only observed inom pR-phoPmutant strain may also be the regulon of OmpR and PhoP.
Key words:S almonella entericaserovar Typhi;OmpR;PhoP;gene expression regulating
OmpRand PhoP cross-regulate gene expression ofSalmonella entericaserovar Typhi under up-shift high osmotic stress
SHENG Xiumei,XU Shungao,ZHANG Haifang,XU Huangxi,HUANG Xinxiang
(School of Medical Technology,Jiangsu University,Zhenjiang,Jiangsu 212013)
R378.2+3;Q786
A
1000-1190(2010)04-0633-06
2010-06-10.
国家自然科学基金项目(30570088);江苏省高校自然科学基金项目(08KJD310012).
*通讯联系人.E-mail:huxinx@yahoo.com.hk.

