利用AFLP技术筛选与哲罗鱼Hucho taimen(Pallas)性别相关的分子标记
张 超, 佟广香,匡友谊,张春雷,3,尹家胜*
(1.中国水产科学研究院黑龙江水产研究所,哈尔滨 150070;2.上海海洋大学水产与生命学院,上海 201306;3.云南农业大学动物科学技术学院,昆明 650201)
哲罗鱼 Hucho taimen(Pallas)系鲑形目(Salmoniformes)、鲑科(Salmonidae)、哲罗鱼属(Hucho),是凶猛的大型冷水鱼类。哲罗鱼具有生长速度快、营养价值高等优良特性,是冷水性鱼类中较好的驯养品种,目前驯化养殖及人工繁育已经获得成功。哲罗鱼繁殖[1],生理学及染色体核型方面的研究国内已有报道[2-4],在分子生物学方面,国内有利用微卫星和AFLP对哲罗鱼遗传多样性研究的报道[5-7],国外有对虹鳟的性别基因位点及鲑科鱼类性染色体进行研究[8-11],但在分析哲罗鱼性别相关的分子标记方面,尚未见有报道。
AFLP(Amplified Fragment Length Polymorphism of DNA)技术结合了RFLP的稳定性和PCR的高效性,具有多态性丰富、DNA用量少、无需预知基因组的序列信息等特点[12]。已广泛应用于遗传连锁图谱的构建[13]、遗传多样性分析[14]、重要性状的分子标记筛选等方面[15]。利用AFLP技术进行动物性别相关分子标记的寻找,国内外研究相对较少。相关的研究主要集中在植物领域[16-17]。在水产动物方面,仅在建鲤[18]、尼罗罗非鱼[19-20]、半滑舌鳎[21-22]、虹鳟[10,23]、大西洋鲑[24]等几种鱼类中获得与性别相关的分子标记,且在这些获得的标记中,大部分标记与性别的连锁关系还有待于进一步确定。而且有报道指出目前得到的一些性别特异标记具有很高的种系特异性[20]。本研究利用AFLP技术分析雌雄哲罗鱼DNA水平的差异,寻找与性别相关的分子标记,以期为哲罗鱼的性别鉴定及单性养殖提供依据。
1 材料与方法
1.1 材料
哲罗鱼雌雄各10尾,体长范围为70.2~104 cm,体重范围为2.428~12.680 kg,均采自黑龙江水产研究所渤海冷水性鱼实验站,在性成熟期鉴定雌雄后剪取鳍条,于75%酒精中保存。
1.2 方法
1.2.1 基因组DNA的提取与检测
将鳍条样品在超纯水中反复清洗多次,使乙醇完全挥发,提取方法参照文献[25],1%琼脂糖凝胶电泳检测,并用分光光度计测定其纯度和浓度,然后将DNA浓度调整至100 ng·μL-1备用。
1.2.2 AFLP分析
用限制性内切酶Eco RⅠ/TaqⅠ组合和Eco RⅠ/Tru9Ⅰ组合分别对基因组DNA进行双酶切,然后T4DNA连接酶进行连接。具体操作步骤参照文献[26]。接头序列如下:

以连接产物为模板进行预扩增,预扩增产物稀释后进行选择性扩增。预扩增引物和选择性引物序列见表1,扩增产物用10%聚丙烯酰胺(丙烯酰胺:甲叉丙烯酰胺为29:1)凝胶电泳检测,上样5 μL,在恒压(380 V)条件下电泳11 h后银染,扫描仪成像。
1.3 数据分析
用Gel-pro4.5软件分析获得的AFLP电泳图谱,根据标准100 bp DNA Ladder计算扩增片段的大小。统计方法参照文献[26],用Philip3.6软件和TreeView软件进行个体聚类分析,Bootstrap抽样5 000次。

表1 引物序列Table1 Primers sequence
2 结果与分析
2.1 AFLP扩增结果及多态性分析
用25对E/PT引物组合和20对E/T引物组合对20尾哲罗鱼个体进行AFLP扩增,25对E/PT引物组合共扩增出了958个位点,多态性位点为251个,多态性比例在4.76%~62.26%之间,平均多态性比例为25.068%;20对E/T引物组合共扩增出了971个位点,多态性位点为217个,多态性比例在6.98%~37.50%之间,平均多态性比例为22.175%,结果见表2。从表中可以看出,两组酶切组合得出的结果相差不大,E/T引物组合扩增出的位点数稍多于E/PT引物组合,但多态性位点比例稍低于后者。综合两组数据来看,这20尾哲罗鱼之间的多态性位点比例并不是很高,多态水平一般。
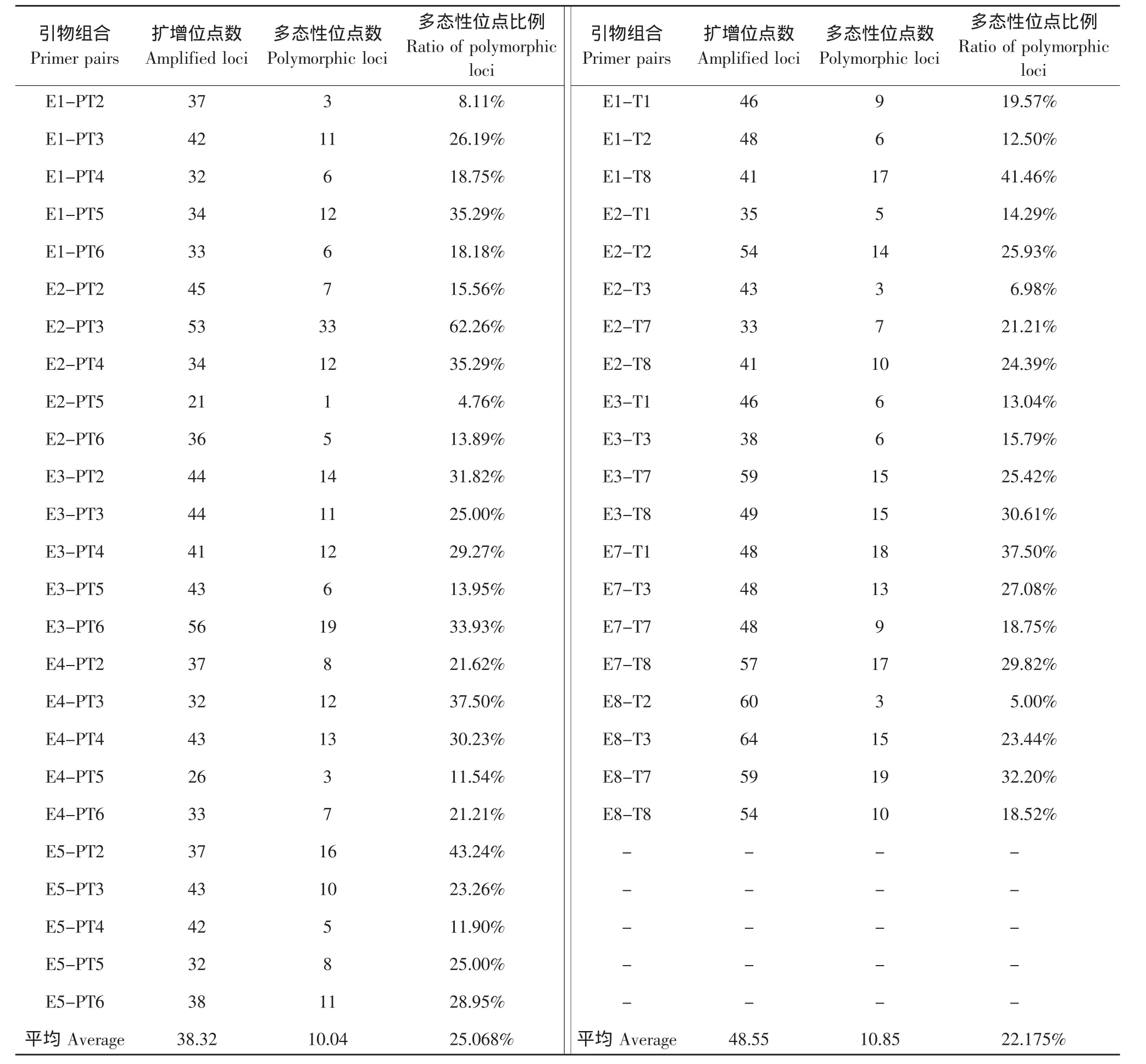
表2 哲罗鱼中不同引物组合扩增的位点数及多态性位点比例Table2 Number of loci and ratio of polymorphic loci amplified by different AFLP primers in H.taimen
图1为引物组合E3-PT3扩增的结果,图2为引物组合E1-T8扩增的结果,多态性比例分别为25.00%和41.46%。 图中标号1~10为雌鱼,11~20为雄鱼,箭头所指处为多态位点,图1中有两个多态位点,图2中有一个多态位点,这三个多态位点在雌雄哲罗鱼中扩增出的比例存在一定的差异,说明这些多态位点与哲罗鱼性别可能存在一定的相关性。

图1 E3-PT3的扩增结果Fig.1 Electrophoretogram of H.taimen population amplified by primer combination E3-PT3
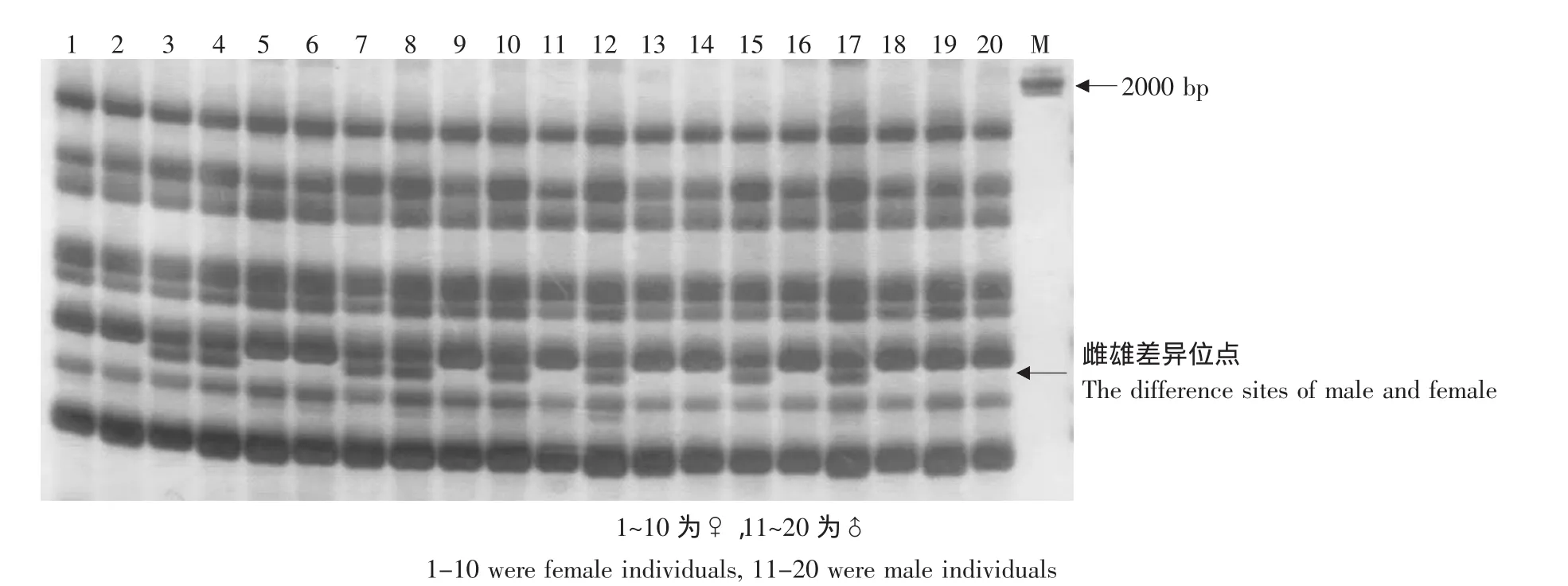
图2 E1-T8的扩增结果Fig.2 Electrophoretogram of H.taimen population amplified by primer combination E1-T8
2.2 雌雄个体差异
分析45对引物组合的扩增结果,有15个位点在雌性和雄性个体中出现的比例存在很大的差异(大于50%),如引物组合E3-PT6扩增的分子质量为115 bp的位点在10个雄性个体中出现8个,而10个雌性个体中仅有1个出现;引物组合E2-T2扩增的分子质量为603 bp的位点在10个雌性个体中都有出现,而在10个雄性个体中只出现3个,结果见表3。这15个位点中虽然没有找到哲罗鱼雌雄特异位点,但每个位点在雌雄中扩增的比例相差都在50%以上,表明这些位点与哲罗鱼性别存在很大的相关性,这些位点可能位于性染色体上或者性别决定基因附近区域。
利用popgene3.2版软件计算雌雄两个群体的观测等位基因Na、有效等位基因Ne,Nei氏基因多样性指数H和Shannon氏指数I,结果见表4、5。由表中可以看出,两组酶切组合所得到的结果不同,E/PT组合获得的遗传多样性参数是雌性略高于雄性,而E/T组合则是雄性略高于雌性,总体来看,两组酶切组合得出的数据均较低,由此可以得出哲罗鱼群体遗传多样性较低,但将雌雄群体分开来看,两群体之间遗传多样性参数差异并不大,说明在进化过程中雌雄群体的遗传分化程度不大,所以从DNA角度来看,哲罗鱼雌雄群体之间的差别不大,多态性水平一般。

表3 哲罗鱼雌雄个体在15个位点出现的比例差异Table3 Differences of distribution in 15 loci between female and male groups of H.taimen

表4 E/PT组合获得的遗传多样性参数Table4 Parameters of genetic diversity by E/PT combination
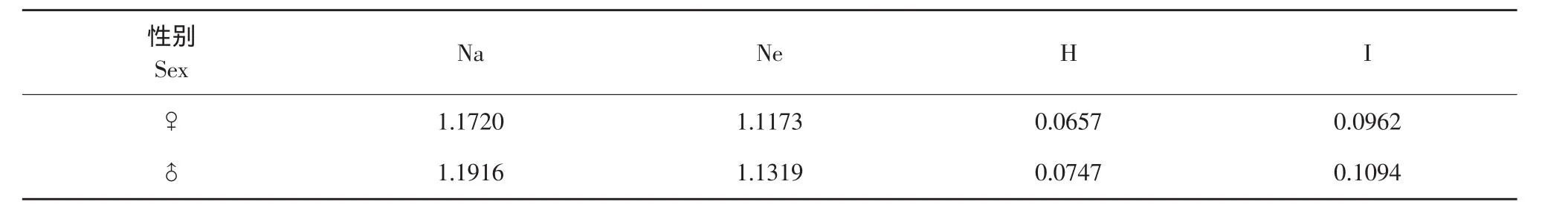
表5 E/T组合获得的遗传多样性参数Table5 Parameters of genetic diversity by E/T combination
用Phylip3.6软件计算遗传距离,并进行5 000次Bootstrap检验系统树的可靠性,图3是由表3中的15个位点绘制的哲罗鱼个体聚类图。从图3可以看出雌鱼聚集在系统树上部,雄鱼聚集在系统树下部,这说明相同性别的鱼之间遗传距离较近,优先聚为一组,而与不同性别的鱼之间的遗传距离较远,这也同样表明这15个多态位点与哲罗鱼性别之间存在很大的相关性。
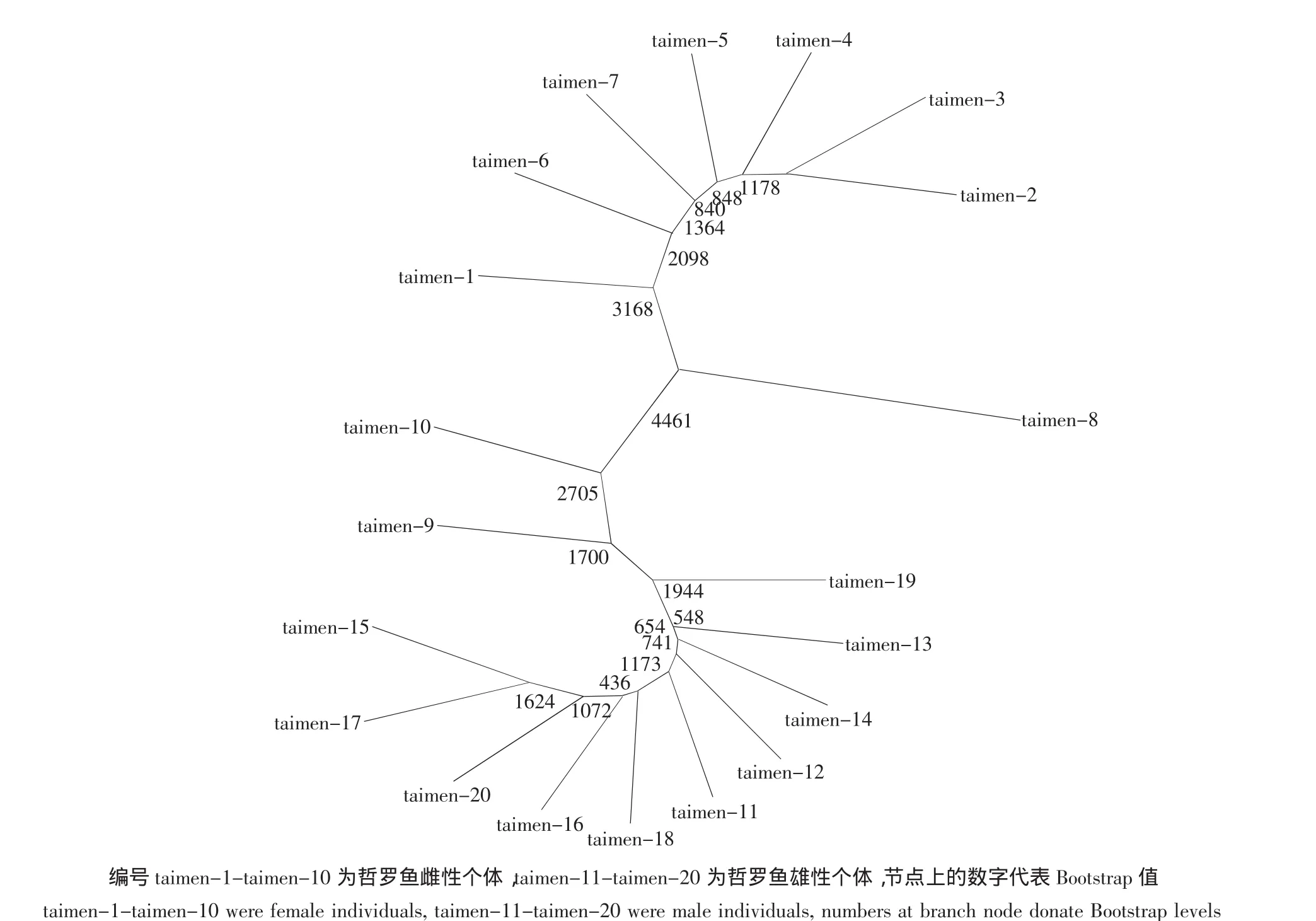
图3 哲罗鱼个体聚类图Fig.3 Individuals dendrogram of H.taimen
3 讨论与结论
AFLP标记技术能产生分布于整个基因组的分子标记,位点丰富,但是操作过程繁琐,任何一步的疏忽都会影响试验结果。本试验参照文献[26]采用了最适的酶量、酶切时间、连接时间及选择性扩增时的稀释倍数,将100 ng DNA用3 U的Eco RⅠ、3 U的TaqⅠ和Tru9Ⅰ分别先后酶切3、4 h,然后用2 U的T4DNA连接酶连接3 h,取3 μL连接产物进行预扩增,预扩增产物稀释50倍进行选择性扩增,得到了最可靠的结果。
本研究用45对引物组合进行试验分析,结果未发现与性别相关的特异性位点,但某些位点在雌雄个体中出现的比例存在很大的差异。这些位点可能与哲罗鱼的性别有一定的关联,推测这些位点可能位于性别决定基因的相邻区域,但与哲罗鱼遗传性别的确切关系还有待于进一步研究。雌雄个体出现比例差异较大的15个位点的聚类分析结果也表明雌雄个体具有一定的遗传分化,同性个体优先聚类。
鲑科鱼类性别方面的研究多是国外学者们进行的,主要集中在对虹鳟的研究。Iturra等利用RAPD方法获得两个虹鳟雄性特异分子标记,并将其中一个标记转化为SCAR标记,命名为OmyP9,然后将其作为探针,采用FISH法将该标记定位于Y染色体上[10];同时,还采用FISH法,利用虹鳟的性别标记OmyP9和5s rDNA、GH2基因作为FISH法的探针,特征化了虹鳟性别染色体,并鉴别了银大麻哈鱼的性染色体[27],这表明OmyP9这个性别标记在虹鳟和银大麻哈鱼中可以通用。虹鳟和银大麻哈鱼同属鲑科鱼类的大麻哈鱼属,所以这些性别标记在属内并不存在种系特异性;Felip等将虹鳟15个性别相关AFLP分子标记转化为SCAR标记,并在虹鳟四个遗传多态的雄性克隆系内将其中一个Y染色体连锁标记Omy-163定位于性别位点附近[23];Alfaqih等将虹鳟5个候选性别决定基因与Y染色体进行了连锁[8],Brunelli等已经成功获得了虹鳟的Y染色体序列[28]。由此可见,虹鳟的性染色体已经确定为Y染色体,而且已经获得了Y染色体的序列及多个性别相关的分子标记和候选性别决定基因。本文作者根据已公布的虹鳟的OmyP9、Omy-163和GH2基因等性别标记的序列设计了18对引物,采用SSCP技术筛选哲罗鱼性别的分子标记,未能发现哲罗鱼雌雄差异。这可能是由于虹鳟和哲罗鱼虽同属鲑科,但不同属,而性别标记又存在属间特异性,所以虹鳟的性别标记不能应用于哲罗鱼。既然哲罗鱼与虹鳟同属鲑科鱼类,在遗传进化方面存在许多共同之处,可以参考虹鳟性别方面的研究方法对哲罗鱼性染色体及性别相关分子标记进行研究。
分析本研究未发现性别特异位点的可能原因有以下两方面:①AFLP技术是针对于整个基因组序列进行扩增,而与性别相关的基因数量较少,因此采用该技术寻找哲罗鱼雌雄之间的差异存在一定的困难;②本研究所用的引物组合较少,样本量也较少,所以扩增出的多态性位点不是很多,若采用多种雌雄差异分析方法,或者选用更多的选择性扩增引物,改进电泳条件,检测更多的雌雄差异位点,将更有助于寻找到雌雄特异位点。另外,鱼类的性别不仅与遗传因素有关,还与环境因素有一定的关系,可以分为遗传性别和生理性别,遗传性别和生理性别的不统一也会造成实验数据的不准确,在某些雌雄出现比例差异很大的位点上,如E2-PT3,雄性个体均有出现,而雌性个体只有3个出现,这3个个体有可能在生理上属雌性,而在遗传上属雄性,因此用性别特异位点鉴定性别时,其准确性并不能够达到100%,即使获得某个雌雄特异位点,扩大样本量分析时也不能保证其能够完全鉴定出雌雄。
哲罗鱼是我国的濒危物种,同时也是一个优良的淡水养殖品种。哲罗鱼的雌雄从外形上很难分辨,因此开发哲罗鱼性别的特异性标记,对其进行性别鉴定,可以对雌雄群体进行不同性状的定向选育,形成不同性状的优良品种;或分别对雌雄群体进行杂交获得具有杂种优势的后代。本文虽然没有找到哲罗鱼雌雄特异位点,但该研究积累的大量AFLP分析结果和数据,可作为哲罗鱼的遗传背景资料,为哲罗鱼性别或其他方面的进一步研究提供参考。
[1]徐伟,尹家胜,姜作发,等.哲罗鱼人工繁育技术的初步研究[J].中国水产科学,2003,10(1):26-30.
[2]关海红,匡友谊,徐伟,等.哲罗鱼消化系统器官发生发育的组织学观察[J].动物学杂志,2007,42(2):116-123.
[3]张永泉,尹家胜,贾钟贺,等.哲罗鱼胚胎和仔鱼发育的研究[J].大连水产学院学报,2008,23(6):425-430.
[4]张荣华,孙中武,尹家胜,等.哲罗鱼的染色体核型分析[J].水产学杂志,2008,21(1):64-67.
[5]梁利群,常玉梅,董崇智,等.微卫星DNA标记对乌苏里江哲罗鱼遗传多样性的分析[J].水产学报,2004,28(3):241-244.
[6]Tong G X,Kuang Y Y,Yin J S,et al.Isolation of microsatellite DNA and analysis on genetic diversity of endangered fish,Hucho taimen(Pallas)[J].Molecular Ecology Notes,2006,6(4):1099-1101.
[7]匡友谊,佟广香,尹家胜,等.呼玛河哲罗鱼遗传多样性的AFLP分析[J].中国水产科学,2007,14(4):615-621.
[8]Alfaqih M A,Brunelli J P,Drew R E,et al.Mapping of five candidate sex-determining loci in rainbow trout(Oncorhynchus mykiss)[J].BMC Genetics,2009,10:2.
[9]Woram R A,Gharbi K,Sakamoto T,et al.Comparative genome analysis of the primary sex-determining locus in salmonid Fishes[J].Genome Res,2003,13:272-280.
[10]Iturra P,Medrano J F,Bagley M,et al.Identification of sex chromosome molecular markers using RAPDs and fluorescent in situ hybridization in rainbow trout[J].Genetica,1998,101:209-213.
[11]Devlin R H,Biagi C A,Smailus D E.Genetic mapping of Y-chromosomal DNA markers in Pacific salmon[J].Genetica,2001,111:43-58.
[12]雷娜,李景富,李烨,等.番茄AFLP技术体系的优化与建立[J].东北农业大学学报,2008,39(3):29-33.
[13]岳志芹,王伟继,孔杰,等.AFLP分子标记构建中国对虾遗传连锁图谱的初步研究[J].高技术通讯,2004(5):88-93.
[14]韩志强,高天翔,王志勇,等.黄姑鱼群体遗传多样性的AFLP分析[J].水产学报,2006,30(5):640-646.
[15]李文枫,李景富,许向阳,等.番茄抗叶霉病基因Cf-11的AFLP标记[J].东北农业大学学报,2008,39(9):25-28.
[16]王晓梅,宋文芹,刘松,等.利用AFLP技术筛选与银杏性别相关的分子标记[J].南开大学学报:自然科学版,2001,34(1):5-9.
[17]Rahman M A,Ainsworth C C.AFLP Analysis of genome difference between male and females in dioecious plant rumex acetosa[J].Journal of Biological Sciences,2004,4(2):160-169.
[18]司伟.全雌鲤鱼育种技术及性别相关分子标记研究[D].南京:南京农业大学,2006.
[19]杨东,余来宁,张繁荣,等.筛选与尼罗罗非鱼性别相关的AFLP标记[J].水生生物学报,2007,31(6):901-904
[20]杨东.尼罗罗非鱼性别决定机制和性别相关的分子标记[D].武汉:华中农业大学,2006.
[21]马洪雨,陈松林,李静,等.半滑舌鳎雌性特异AFLP标记CseF 783的克隆及其在遗传性别鉴定中的应用[J].遗传,2009,31(1):88-94.
[22]Ma H Y,Chen S,LI J,et al.Cloning,characterization of two female-specific AFLP markers and development of PCR-based sex identification method for the halfsmooth tongue sole Cynoglossus semilaevis[J].Current Zoology,2009,55(4):309-314.
[23]Felip A,Young W P,Wheeler P A,et al.An AFLP based approach for the identification of sex linked markers in rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,2005,247(1-4):35-43.
[24]Artieria C G,Mitchella L A,Nga S H S,et al.Identification of the sex-determining locus of Atlantic salmon(Salmo salar)on chromosome 2[J].Cytogenet Genome Res,2006,112:152-159.
[25]佟广香,鲁翠云,匡友谊,等.哲罗鱼基因组微卫星富集文库的构建与分析[J].中国水产科学,2006,13(2):181-186.
[26]佟广香,包玉龙,尹家胜,等.哲罗鱼AFLP技术体系建立的研究[J].江西农业大学学报,2008,30(3):405-410.
[27]Iturra P,Lam N,Fuente M de la,et al.Characterization of sex chromosomes in rainbow trout and coho salmon using fluorescence in situ hybridization(FISH)[J].Genetica,2001,111:125-131.
[28]Brunelli J P,Wertzler K J,Sundin K,et al.Y-specific sequences and polymorphisms in rainbow trout and Chinook salmon[J].Genome 2008,51(9):739-748.

