基于SCGE的五氯酚对稀有鮈鲫DNA损伤的研究
马永鹏,王 燕,朱祥伟,刘树深,刘 堰*
(1.西南大学生命科学学院,三峡库区生态环境教育部重点实验室,重庆 400715;2.同济大学环境科学与工程学院,长江水环境教育部重点实验室,上海 200092)
基于SCGE的五氯酚对稀有鮈鲫DNA损伤的研究
马永鹏1,王 燕1,朱祥伟2,刘树深2,刘 堰1*
(1.西南大学生命科学学院,三峡库区生态环境教育部重点实验室,重庆 400715;2.同济大学环境科学与工程学院,长江水环境教育部重点实验室,上海 200092)
采用单细胞凝胶电泳(SCGE)技术,研究了在不同的染毒时间内不同浓度的五氯酚(PCP)对稀有鮈鲫(Gobiocypris rarus)血细胞和肝脏细胞DNA的损伤.结果显示,各PCP染毒组细胞彗星尾部DNA含量 (%DNAT) 和彗星尾长(TL) 显著增加,与空白对照组比较,差异极显著(P<0.05).随着浓度的增加,细胞彗星尾部%DNAT和 TL逐渐增加,其相关系数>0.926,说明在实验浓度范围内, 存在显著的浓度-效应关系.在同一浓度下,随着暴露时间的增加,处理组%DNAT和TL逐渐增加,存在显著的时间-效应关系.由于PCP可引起稀有鮈鲫血细胞和肝脏细胞DNA的严重损伤,因此稀有鮈鲫血细胞和肝脏细胞DNA的损伤可作为PCP遗传毒性的指示.
五氯酚;稀有鮈鲫;DNA损伤;单细胞凝胶电泳(SCGE);遗传毒性
Abstract:By using the alkaline single cell gel-electrophoresis (SCGE), the DNA damage in blood cells and liver cells of Gobiocypris rarus caused by pentachlorophenol at different exposure time (1day, 4days, 7days) with different concentration of pentachlorophenol (40, 100, 160μg/L) was evaluated. Tail DNA percentage (%DNAT) and tail length (TL) of the three tested groups were significantly different from the control group (P < 0.05). Furthermore, the damage intensity of treated groups increased gradually with respect to the increasing of pentachlorophenol. The concentration-effect relationship was significant for the correlation coeffiencient was graeter than 0.926. Under the same concentration, the % DNAT and TL increased gradually with the time of exposure. The time-effect relationship was also significant. This study recommended that it could be a sensitive monitor of aquatic pollution to use the SCGE to detect the DNA damage in fish blood cells and liver cells. It showed that this assay could be applied in the assessment of water pollution and aquatic mutagens.
Key words:pentachlorophenol;gobiocypris rarus;DNA damage;alkaline single cell gel electrophoresis (SCGE);genotoxicity
五氯酚(PCP)是一种典型的持久性有机污染物(POPs),是环境优先监测污染物之一,被国际肿瘤研究机构[1]和美国环境保护局[2]列为人类可能的致癌物.在我国,PCP及其钠盐主要作为杀虫剂和木材防腐剂而广泛应用,曾在长江中下游 11个省、市被大范围、长时间地用于杀灭钉螺,导致对水环境的污染[3].PCP对细菌、高等植物细胞、小鼠和人淋巴细胞都具有遗传毒性[4-7],但其作为一种诱变剂或辅诱变剂的研究有限[8],并且对 PCP遗传毒性的研究观点不一[9].因此,研究PCP对水生生物和水体生态系统的遗传毒性影响具有重要意义.
稀有鮈鲫(Gobiocypris rarus)是我国特有的一种卵生小型鲤科鱼类,具有生命力强、饲养简便、性成熟快、周年产卵等[10]优点.已有研究[11]结果显示,稀有鮈鲫是一种对化学物质较敏感的试验动物.近年来,单细胞凝胶电泳试验(SCGE,又称彗星试验)由于其快速、敏感、经济等优点,正越来越多地被用于环境污染物的遗传毒性评价[12].本研究以稀有鮈鲫为研究对象,通过SCGE研究PCP对稀有鮈鲫血细胞和肝脏细胞DNA的损伤效应,以期为水体环境的生物监测、筛选水环境中基因毒剂指标提供实验依据.
1 材料与方法
1.1 试剂及仪器
PCP纯度 99%,(Chem.Service);三羟甲基氨基甲烷(Tris)(AMRESCO);二甲基亚砜(DMSO) (Sanland-Chem);正常熔点琼脂糖(上海化学试剂公司);低熔点琼脂糖(北京经科宏达生物技术有限公司);溴化乙锭,台盼蓝(美国 Sigma公司); TritonX-100 (北京奇华盛生物技术发展中心);其他试剂均为国产分析纯.
微量高速冷冻离心机(德国 Hettich ZENTRIFUGEN 公司),水平电泳槽和 DYY-6B型电泳仪(北京六一仪器厂),荧光显微镜(Elicspe 80i型,Nikon,日本),120目细胞筛.
1.2 实验动物
健康的稀有鮈鲫种鱼购于中国科学院武汉水生生物研究所,在本实验室饲养繁殖,水温控制在 25℃左右,光照周期为昼/夜=14h/10h.全部喂养孵化的丰年虫(丰年虫卵购于天津丹阳水产有限公司).试验用鱼为 7个月龄的健康成鱼[体重(0.53±0.15)g,体长(36.6±3.7)mm].实验前,以连续曝气 24h的自来水,[pH为(7.6±1.5),DO>5mg/L,总硬度为(7.8±0.7)德国度,水温(25±2)℃];昼/夜=14h/12h的试验条件驯化2周.
1.3 暴露试剂
PCP溶于DMSO,制成10mg/mL的储液,4℃保存.再用 DMSO进一步稀释至各浓度,置于棕色瓶4℃保存.
1.4 动物分组及染毒方式
将稀有鮈鲫随机分成空白对照组、溶剂对照组和40,100,160μg/L PCP浓度组,每组10条鱼.暴露试验在10L体系中进行,水温(25±2)℃,昼/夜=14h/12h,每天更换一半体积的暴露溶液,并补加暴露试剂至原浓度;喂食刚孵化的丰年虫1次;观察鱼是否有异常,并记录.分别在第1,4,7d各取3条鱼用于试验.
1.5 样品的收集和细胞悬液的制备
血细胞悬液:断尾法取稀有鮈鲫外周血10μL,迅速加入0.2mL磷酸缓冲盐溶液(PBS,pH 7.4)中制成血细胞悬液,置于4℃冰箱中保存待用.
肝脏细胞悬液:取下肝脏,立即用预冷的PBS冲洗 3次以去除血细胞,然后加入适量预冷的PBS,剪碎,用120目的不锈钢筛网过滤,收集细胞悬液,用 PBS调细胞浓度至 107~108/mL用作SCGE实验,置于4℃冰箱中保存待用.
各组细胞经台盼蓝染色后,细胞计数,活细胞率均在87%以上.
1.6 SCGE实验
操作步骤参照文献[13]的方法,加以适当改进.
制胶(双层凝胶法):第一层铺正常熔点的琼脂糖凝胶(0.6%:用 PBS配制),采用浸片法,将载玻片浸入凝胶中数秒后,取出用纸把背面擦净,然后水平放置在 60℃烘箱中烘干.第二层铺60μL的低熔点琼脂糖凝胶(0.7%:用 PBS配制)与20μL细胞悬液的混合液,盖上盖玻片,置4℃冰箱冷却.
细胞裂解:移去盖玻片,将载玻片水平浸入新鲜配制并预冷的细胞裂解液中避光裂解2h.
解旋:将载玻片取出,置蒸馏水中漂洗 1次,然后置于水平电泳槽的阳极端,将新配制的碱性电泳缓冲液(1 mmol/L的EDTA-2Na,300mmol/L的NaOH,pH 13)加入电泳槽中,约覆盖过载玻片胶面 0.25cm,4℃下避光静置20min.
电泳:电压 25V,4℃,调节电泳缓冲液液面高度使电流为300mA,避光电泳20min.电泳结束后,将载玻片用PBS(pH 7.4)缓冲液浸洗,每次5min,共3次.中和后,吸去玻片上的残液,然后放入无水乙醇中浸泡5min,取出晾干,避光室温保存.
滴加30μL 5μg/mL溴化乙锭到胶体表面,盖上盖玻片染色.染色20min以后,开始荧光显微镜观察.数码相机拍照,每份样本随机拍摄 100个DNA受损细胞图像,彗星图像用 CASP软件[14]自动分析,选用国际公认的彗星尾部 DNA含量(%DNAT)和彗星尾长(TL)来评价DNA的损伤程度.分析所得数据用 SPSS13.0软件,在方差齐性的情况下用单因素方差分析其统计学意义(α=0.01),同时对%DNAT与PCP浓度和血液与肝脏细胞的损伤之间进行相关性分析.
2 结果
2.1 稀有鮈鲫外周血细胞和肝脏细胞 DNA受损形态及彗星尾长分析
对照组和各PCP染毒组彗星图像如图1和图2所示.不同浓度PCP对稀有鮈鲫血细胞和肝细胞DNA损伤的彗星尾长分析如表1所示.由图1可见,空白对照组和溶剂对照组的血细胞和肝脏细胞核大小比较均一,呈圆形荧光团,无拖尾现象(图1A、B).DNA受损的血细胞和肝脏细胞有一个像彗星一样的拖尾,并且随着 PCP浓度的增加,彗星尾长显著增加(表1,P<0.05),尾部荧光强度增强,彗星头部的直径随着尾部的加长而减小(图1C、D、E),其损伤作用表现出显著的浓度效应.在相同PCP浓度下,受损DNA彗星的尾长、尾部荧光强度、彗星头部的直径都随暴露时间的增加,表现出显著的时间效应(图2A、B、C;表1).
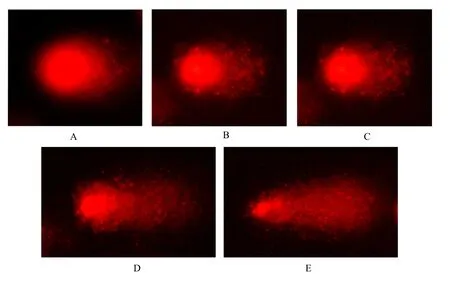
图1 第4d PCP引起稀有鮈鲫血细胞DNA受损形态(×200)Fig.1 Comet pictures of DNA damage induced by pentachlorophenol after 4 days (×200)A:空白对照组;B:溶剂对照组;C:40μg/LPCP处理组;D:100μg/LPCP处理组;E:160μg/LPCP处理组

图2 100μg/L PCP不同时间引起稀有鮈鲫肝细胞DNA受损形态(×200)Fig.2 Comet pictures of DNA damage induced by 100μg/L of pentachlorophenol in different exposure time (×200)
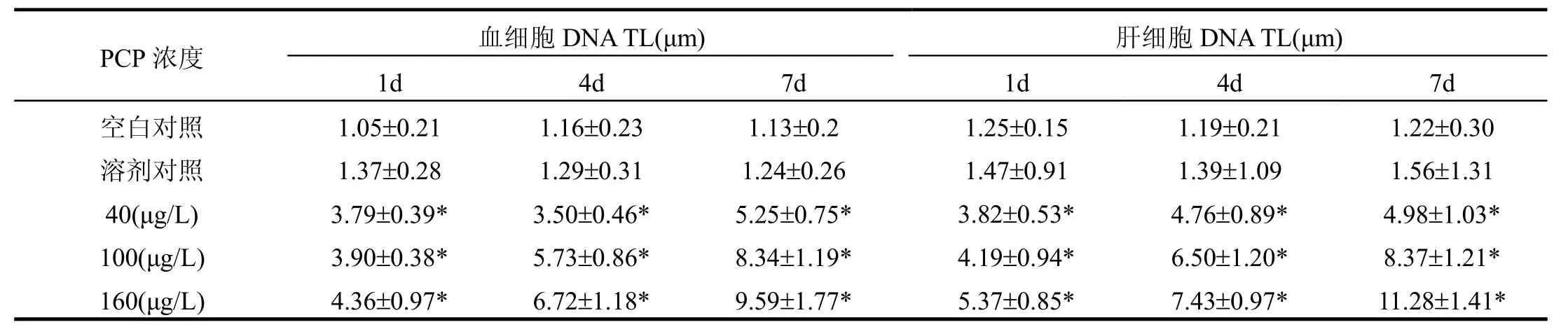
表1 不同浓度PCP下稀有鮈鲫血细胞和肝细胞DNA的TLTable 1 Comet tail length in blood cells and liver cells of Gobiocypris rarus exposed to three different sub-lethal concentrations of PCP
2.2 PCP对稀有鮈鲫外周血细胞和肝脏细胞DNA损伤的影响及浓度-效应关系
不同浓度、不同处理时间PCP对稀有鮈鲫血细胞和肝脏细胞DNA的损伤效应如图3所示;以%DNAT,对PCP浓度作线性回归,得到的浓度-效应方程如表2所示.经统计学检验,同一处理时间,各浓度组%DNAT与对照组之间有极显著性差异(P<0.01),在 40μg/LPCP处理组暴露 1d时,血细胞和肝细胞%DNAT分别为(8.23±0.73)%和(10.53±0.57)%,与空白对照组(4.16±0.96)%; (4.57±0.39)%相比已出现明显变化(图 3);在高浓度PCP处理组(100,160μg/L)中,其损伤显著增加,其中 160μg/LPCP处理组的血细胞和肝细胞%DNAT分别为(10.63±0.57)%和(14.29±0.42)%,且随着 PCP处理浓度的增加,血细胞和肝细胞%DNAT均逐渐升高,表明PCP可导致稀有鮈鲫血、肝细胞DNA损伤,且随处理浓度的增加,损伤逐渐加重,呈一定的浓度-效应关系,其相关系数>0.926;同一处理浓度,随着PCP处理时间的加长,血细胞和肝细胞%DNAT也呈逐渐升高趋势,其40μg/LPCP处理组暴露 7d时,血细胞和肝细胞%DNAT分别为(19.47±0.81)%和(21.16±0.28)%,可见,随处理时间的增加,损伤逐渐加重,呈一定的时间-效应关系.同时,对血液和肝脏细胞之间的损伤进行相关性分析得知,相关系数R=0.982.
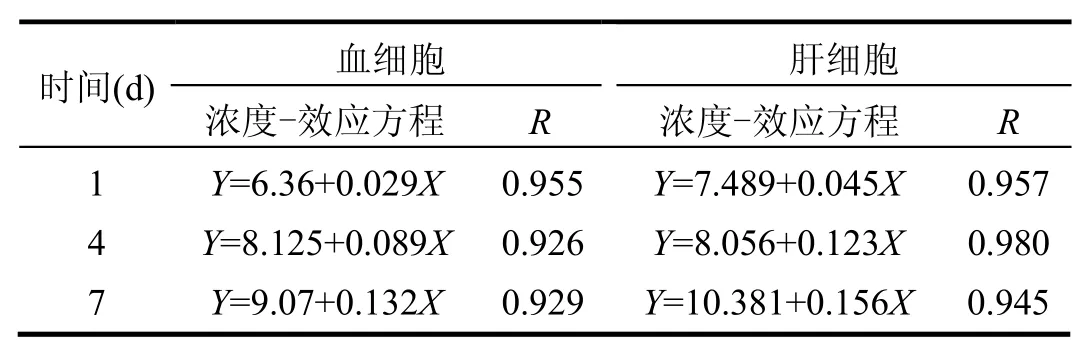
表2 稀有鮈鲫血细胞和肝细胞%DNAT 与PCP的浓度-效应方程Table 2 Concentration-effect equation [0] of %DNAT and PCP in blood cells and liver cells of Gobiocypris rarus
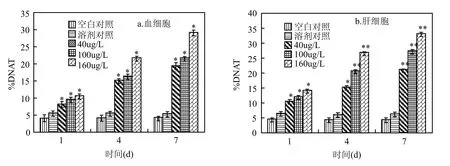
图3 PCP处理组稀有鮈鲫外周血细胞和肝脏细胞%DNATFig.3 %DNAT in blood cells and liver cells [0] of Gobiocypris rarus induced by pentachlorophenol∗表示与空白对照组相比,P<0.05;∗∗表示与空白对照组相比,P<0.01
3 讨论
PCP是一种典型的水体污染物,其不仅影响生物生生 、诱导生物细胞毒性,而且还可能诱导生物的遗传损伤.Pavlica等[15]研究了PCP对斑马贝血细胞的影响,结果发现,其可致斑马贝血细胞出现 DNA链断裂损伤.本研究结果显示, PCP可导致稀有鮈鲫血细胞和肝脏细胞 DNA明显的断裂和迁移,对血细胞和肝脏细胞 DNA造成了损伤.
Pavlica等[16]观察到 PCP诱导斑马贝和大蜗牛微核率增加,随着暴露天数延长,在较低浓度下也出现微核细胞频率增加的结果.本研究发现,在低浓度PCP暴露7d后,稀有鮈鲫血细胞和肝脏细胞%DNAT显著增加.用低浓度的PCP处理动物时,可增加动物对氧的消耗,这是由于在线粒体内氧化磷酸化的解偶联使线粒体缺少对呼吸的控制所导致的[17].而氧的过量消耗将会产生过多的氧化自由基[18],其可致氧化DNA损伤,这可能是 PCP遗传毒性的一个机制[19].Sai-Kato等[20]研究PCP对小鼠肝脏DNA损伤时,发现使用抗氧化剂以后,其DNA损伤明显降低.还有研究[21]发现,PCP导致细胞内ATP大量消耗,致使细胞内Ca2+浓度上升,激活了核酸内切酶,造成大量DNA片段的产生,这可能是PCP造成DNA损伤的另一个机制.本次试验中,稀有鮈鲫经PCP处理以后,可能增加了活性氧的媒介物,产生过多的氧化自由基从而导致血细胞和肝脏细胞DNA发生氧化损伤.
有研究显示[22],Na-PCP可在鱼的肝脏、肾脏等器官内大量蓄积,造成肝、肾及中枢神经系统严重损害,破坏生物体内的电子传递体系和造成氧化损伤,从而对生物体造成一定的 DNA损伤。本次研究结果发现,稀有鮈鲫的肝脏细胞较血细胞DNA损伤严重,这表明肝脏细胞更容易受到损伤而造成 DNA链断裂.通过相关性分析得知,PCP对稀有鮈鲫血液和肝脏细胞 DNA的损伤效应呈很好的相关性,因此,稀有鮈鲫的血液和肝脏细胞均可作为PCP遗传毒性的灵敏的指示器.
4 结论
4.1 PCP在40~160μg/L的试验浓度下,经1~7d暴露后引起稀有鮈鲫血细胞和肝细胞DNA显著损伤.
4.2 PCP对核酸物质具有较强的毒性,能导致大量 DNA片段的产生.通过线性回归分析得到,PCP的浓度与DNA损伤存在显著的浓度-效应关系,其相关系数>0.926.因此,稀有鮈鲫血细胞和肝细胞DNA损伤均可作为PCP遗传毒性的灵敏的指示器.
[1] International Agency for Research on Cancer. Pentachlorophenol (group 2B). IARC monographs on the evaluation of the carcinogenic risk of chemicals to humans [M]. Lyon: International Agency for Research on Cancer, 1991:371.
[2] Environmental Protection Agency. Pentachlorophenol (CASRN 87-86-5) [S]. Washington, D C: Environmental Protection Agency, 2001.
[3] 张 兵,郑明辉,刘芃岩,等.五氯酚在洞庭湖环境介质中的分布[J]. 中国环境科学, 2001,21(2):165-167.
[4] Roy S, Hanninen O. Pentachlorophenol: uptake/elimination kinetics and metabolism in an aquatic plant, Eichornia crassipes [J]. Environmental Toxicology and Chemistry, 1994,13:763-773. [5] Pavlica M, Vasilevska J, Papes D. Genotoxicity of pentachlorophenol revealed by Allium chromosome aberration assay [J]. Acta Biologica Cracoviensia Series Botanica, 1999,40: 85-90.
[6] Gopalaswamy U V, Nair C K K. DNA binding and mutagenicity of lindane and its metabolites [J]. Bulletin of Environmental Contamination and Toxicology, 1992,49:300-305.
[7] Ziemsen B, Angerer J, Lehnert G. Sister chromatid exchange and chromosomal breakage in pentachlorophenol (PCP) exposed workers [J]. International Archives of Occupational and Environmental Health, 1987,59(4):413-417.
[8] Seiler J P. Pentachlorophenol [J]. Mutation Research/Reviews in Genetic Toxicology, 1991,257:27-47.
[9] Alex T. Proudfoot pentachlorophenol poisoning [J]. Toxicological Reviews, 2003,22(1):3-11.
[10] 王剑伟.稀有鮈鲫产卵频次和卵子发育的研究 [J]. 水生生物学报, 1999,23:161-166.
[11] 李 莉,马陶武,吴振斌.生活污水对稀有鮈鲫的毒性效应研究[J]. 水生生物学报, 2004,28:40-44.
[12] Frenzilli G. Nigro M. Lyons B P. The comet assay for theevaluation of genotoxic impact in aquatic environments [J]. Mutation Research/Reviews in Mutation Research, 2008,681(1): 80-92.
[13] 卫 东.用彗星试验检测烷基酚对海洋生物血淋巴细胞的DNA损伤 [D]. 青岛:中国海洋大学, 2006.
[14] Krzysztof K, Anna L, Anna B, et al. A cross-platform public domain PC image-analysis program for the comet assay [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2003,534:15-20.
[15] Pavlica M, Klobular G I V, Mojas N, et al. Detection of DNA damage in haemocytes of zebra mussel using comet assay [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2001,490:209-214.
[16] Pavlica M, Klobular G I V, Vetma N, et al. Detection of micronuclei inhaemocytes of zebra mussel and greatramshorn snail exposed to pentachlorophenol [J]. Mutation Research/ Genetic Toxicology and Environmental Mutagenesis, 2000,465: 145-150.
[17] Villela I V, De Oliveira I M, Da Silva J, et al. DNA damage and repair in haemolymph cells of golden mussel (Limnoperna fortunei) exposed to environmental contaminants [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2006,605:78-86.
[18] Roszell L E, Andersson R S. Effect of in vivo pentachlorophenol exposure on Fundulus heteroclitus phagocytes-modulation of bactericidal activity [J]. Diseases of Aquatic Organisms, 1996, 26(3):205-211.
[19] Wilson J T, Pascoe P L, Parry J M, et al. Evaluation of the comet assay as method for the detection of DNA damage in the cells of a marine invertebrate, Mytilus edulis (Molusca:Pelecypoda) [J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1998,339:197-210.
[20] Sai-Kato K, Umemura T, Takagi A, et al. Pentachlorophenolinduced oxidative DNA damage in mouse liver and protective effect of antioxidants [J]. Food and Chemical Toxicology, 1995, 33(10):877-882.
[21] Dong Y L, Zhou P J, Jiang S Y, et al. Induction of oxidative stress and apoptosis by pentachlorophenol in primary cultures of Carassius carassius hepatocytes [J]. Comparative Biochemistry and Physiology (Part C), 2009,150:179-185.
[22] Tugiyono, Gagnon M M. Metabolic disturbances in fish exposed to sodium pentachlorophenate (NaPCP) and 3, 3, 4, 4, 5-pentachlorobiphenyl (PCB126), individually or combined [J]. Comparative Biochemistry and Physiology (Part C), 2002,132: 425-435.
Alkaline single cell gel electrophoresis assay (SCGE) based study on DNA damage of Gobiocypris rarus induced by pentachlorophenol.
MA Yong-peng1, WANG Yan1, ZHU Xiang-wei2, LIU Shu-shen2, LIU Yan1∗
(1.Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, School of Life Science, Southwest University, Chongqing 400715, China;2.Key Laboratory of Yangtze River Water Environment, Ministry of Education, College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China). China Environmental Science, 2010,30(2):269~274
X171.5
A
1000-6923(2010)02-0269-06
2009-06-22
三峡库区生态环境教育部重点实验室科学研究基金项目(EF200606);全国优秀博士学位论文作者基金项目(200355);重庆市科委自然科学基金项目(CSTC,2009BB1131)
* 责任作者, 教授, liuyan@swu.edu.cn
马永鹏(1985-),男,山东临沂人,西南大学生命科学学院硕士研究生,研究方向为生物化学与分子生物学.发表论文1篇.

