纳米NiO作催化剂的扣式锂-氧电池的性能
李学良,郭丽彬
(1.合肥工业大学化工学院,安徽合肥 230009; 2.可控化学与材料化工安徽省重点实验室,安徽合肥 230009)
锂-空气电池的容量大,放电时从空气中吸取氧气,在多孔炭基电极中循环,且有别于常规的铝-空气电池[1]或锌-空气电池等一次电池,是一种二次金属-空气电池。在锂-空气电池中,空气电极和金属锂分别作为正极和负极,电解液为非水电解液,空气电极有微孔,用于吸取空气中的氧。
对锂-空气电池的研究,大多集中在催化剂方面。向空气电极中掺入合适的催化剂,可提高电池的比容量及循环性能。T.Ogasawara等[2]研究了电解二氧化锰(EMD)作为催化剂掺入空气电极对电池容量和循环性能的影响,空气电极以70 mA/g的电流放电,比容量约为1 000 mAh/g;J.Xiao等[3-4]等研究了 MnO2、V2O5及 CuO等在电池反应过程中的催化作用,以V2O5为催化剂的空气电极,在放电电流密度为0.1 mA/cm2时的比容量为 600~800 mAh/g;以CuO为催化剂的空气电极,在放电电流为70 mA/g时的比容量为600~800 mAh/g。
NiO属NaCl型立方晶系,Ni、O原子的配位数均为6,是一种催化作用较好的氧化催化剂。Ni2+具有3d轨道,对多电子氧具有择优吸附的倾向。NiO作为催化剂对锂-氧电池充放电影响的报道甚少,特别是纳米NiO催化剂的应用,本文作者尚未见报道,因此研究了纳米NiO作催化剂的锂-氧电池的性能。锂-氧电池的电极过程与锂-空气电池基本相同,因此选择锂-氧电池为研究对象。
1 实验
1.1 纳米NiO的制备与分析
用水热法制备纳米NiO[5]:将0.249 g乙酸镍(上海产,AR)溶解在10 ml 1,4-丁二醇(上海产,AR)和20 ml去离子水的混合液中,磁力搅拌混匀后,转移至容积为40 ml的高压反应釜中,在200℃、1.5 MPa的条件下保持24 h后,冷却至室温,得到绿色的产物。产物过滤后,依次用去离子水和无水乙醇(上海产,AR)洗涤3次,并在120℃下真空(真空度为150 Pa,下同)干燥24 h,再在400℃下焙烧3 h,即制得纳米NiO样品。
用D/max-rB型旋转阳极X射线粉末衍射仪(日本产)对样品进行XRD分析,CuKα,λ=0.154 06 nm,管压40 kV、管流100 mA,扫描速度为8(°)/min。
1.2 电极的制备及电池的组装
1.2.1 多孔炭基电极片的制备
将厚度为0.05 mm的铝箔(天津产,≥99%)裁剪成d=12 mm的圆片,再在圆片中心挖一个直径为3 mm圆孔,然后与镍网(英国产,孔径为 28 μ m)组成氧气电极器件,作为氧气电极的集流体,并在120℃下真空干燥12 h,备用。将自制超级活性炭[6]、纳米NiO样品和聚偏氟乙烯(上海产,电池级)按质量比80∶10∶10混匀后,滴加溶剂1-甲基-2-吡咯烷酮(上海产,CP)调成膏状,均匀涂覆在氧气电极集流片上,在120℃下真空干燥24 h,取出电极片,在 YP-2压片机(上海产)上以2.13 MPa的压力压实(保持3 min),得到多孔炭基氧气电极片,活性物质质量为2.00 mg。按照上述条件,制备了不掺纳米NiO的多孔炭基氧气电极片,作为对比。
1.2.2 电池的组装
以多孔炭基氧气电极片为正极,金属锂片(天津产,电池级)为负极,1.0 mol/L LiPF6/EC+DMC(体积比1∶1,张家港产,电池级)为电解液,Celgard 2400膜(美国产)为隔膜,在充满氩气的手套箱中组装CR2032型扣式实验电池,电池壳上钻有6个直径为1 mm的透气孔。
1.3 电池的性能测试
在BTS-5 V/10 mA充放电仪(深圳产)上测试电池的恒流充放电性能,电压为2.0~5.0 V。将待测电池置于自制的密闭装置中,装置上有一根管道与氧气瓶连接,以保证被测电池在干燥的氧气环境下测试。对以0.1 mA/cm2多次充放电循环后的电池,在CHI660B型电化学工作站(上海产)上进行交流阻抗测试,频率范围为100 kHz~0.1 Hz,电压正弦波的振幅为5 mV,采用四电极设置。开路电压为放电状态2.70 V。所有测试均在常压、室温下进行。
2 结果与讨论
2.1 材料的XRD分析
图1为制得的纳米NiO样品的XRD图。
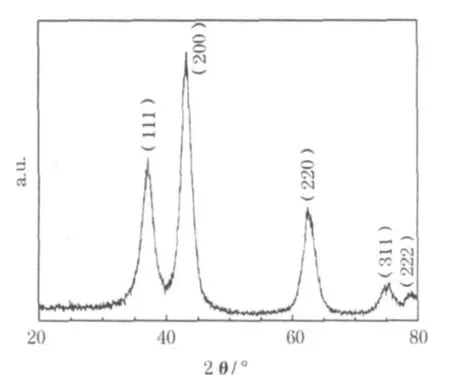
图1 纳米NiO样品的XRD图Fig.1 XRD pattern of nano-NiO sample
从图 1可知,样品在 37.20°、43.32°、62.60°、75.36°和79.02°处出现了衍射峰,与标准图谱(JCPDS:04-0835)吻合,为立方晶相的NiO。5个衍射峰分别对对应立方晶相NiO的(111)、(200)、(220)、(311)和(222)晶面。
根据Scherrer公式计算,纳米 NiO样品的平均粒径为1.69 nm。
2.2 电化学性能分析
2.2.1 恒流充放电
锂-氧扣式实验电池的首次充放电曲线见图2。
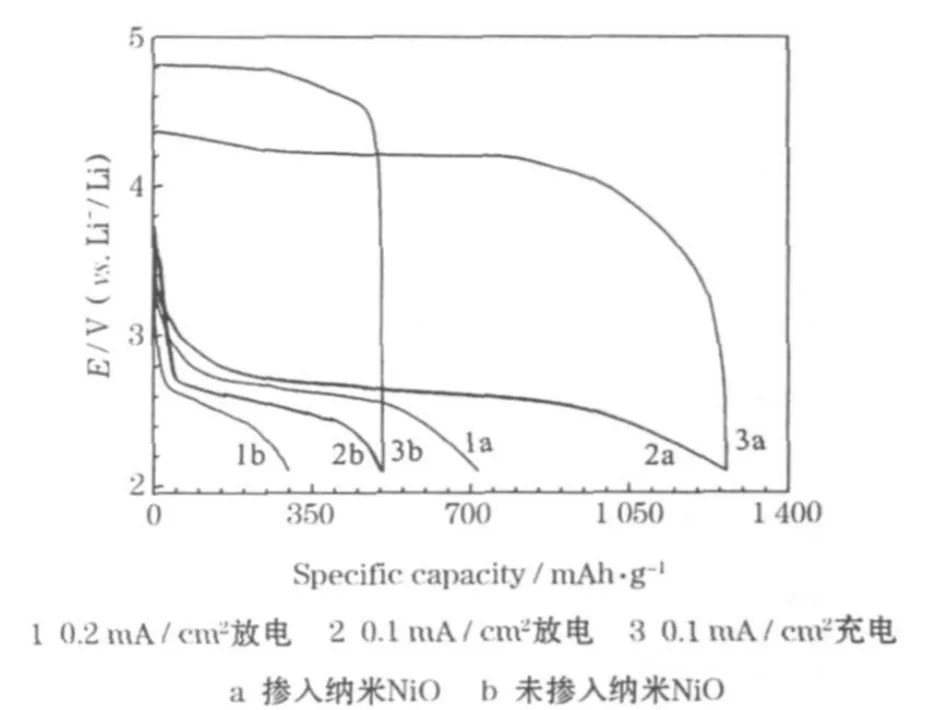
图2 锂-氧扣式实验电池的首次充放电曲线Fig.2 Initial charge-discharge curves of Li-oxygen button experimental cell
从图2可知,以纳米NiO作为氧气电极的催化剂,可提高电池的性能。在0.1 mA/cm2的电流密度下,电池的首次放电比容量为 1 258.4 mAh/g,放电电压平台约为2.7 V;在0.2 mA/cm2的电流密度下,电池的比容量有所降低,为715.4 mAh/g,放电电压平台降低到约2.6 V;未掺入催化剂纳米NiO的锂-氧电池,比容量及放电电压平台均较低。
锂-氧电池的电池反应见式(1),T.Ogasawara等[2]证明,锂-氧电池的电极反应[式(2)]是可逆的。

锂-氧电池的开路电压为3.1 V,工作电压为2.8~2.0 V,平均工作电压约为2.6 V[7]。
从图 2可知,锂-氧扣式实验电池的放电电压平台为 2.5~2.7 V,与文献[4]中同类电池的2.6 V基本一致。
从图2还可看到,掺入纳米NiO能提高锂-氧扣式实验电池的性能,缩小充、放电电压平台差。以纳米NiO作为氧气电极的催化剂,可使充电电压平台由4.8 V降至约4.2 V。
纳米NiO在锂-氧电池的电极反应中起到了催化的作用,呈现出电催化作用源于NiO的现象。p型半导体NiO为正离子缺位的非计量化合物,出现一个缺位,相当于缺少两个单位的正电荷,由于晶体中保持电中性,相应地邻近两个Ni2+价态起了变化,由Ni2+变为Ni3+,Ni3+可看作Ni2+束缚住一个单位正电荷的空“⊕”。NiO的这一结构,对多电子氧具有吸附倾向,提供电子给吸附氧的中心,NiO的添加,形成了对O2在表面上的吸附,并处于活化吸附态,有利于多相催化过程[8],且纳米NiO呈现出更强的催化作用。
2.2.2 循环寿命测试
锂-氧扣式实验电池的循环性能见图3。

图3 锂-氧扣式实验电池的循环性能Fig.3 Cycle performance of Li-oxygen button experimental cell
从图3可知,在0.1 mA/cm2的电流密度下,扣式实验电池的首次放电比容量较大;前4次循环的容量衰减明显;之后,衰减趋势变得稍微平缓。容量衰减的影响因素较多,如电解液分解、活性物质变化等[9]。
在锂-氧电池中,电极过程是有氧气参与的电化学反应。气体、电解液和活性物质三者需要充分的接触,才能保证电极反应的有效进行。气体的生成和迁移,更容易导致接触性能变差,如电解液与电极活性物质的接触变差,电极活性物质的互联变弱、多孔内电解液的互联性降低。这些因素都会导致活性物质利用率下降,并体现为电池的容量衰减[10]。随着循环的深入,多孔炭材料的结构也可能发生坍塌,堵塞电解质离子进入纳米孔的通道,导致循环性能下降[11]。
2.2.3 交流阻抗测试
锂-氧扣式实验电池的交流阻抗谱见图4。
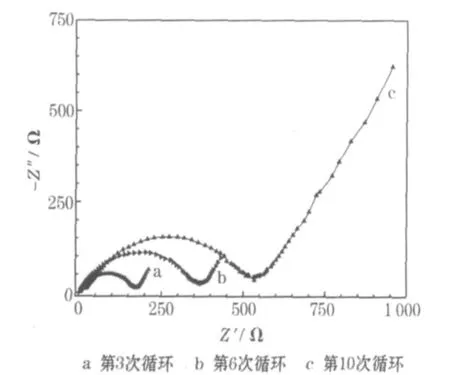
图4 锂-氧扣式实验电池的交流阻抗谱Fig.4 AC impedance plots of Li-oxygen button experimental cell
图4中的曲线均由高频区的半圆和低频区的斜线组成。半圆直径代表电荷转移阻抗,即极化电阻Rf,斜线代表Li+在活性物质中扩散的Warburg阻抗。从图4可知,半圆的直径随着循环次数的增加而变大,表明随循环次数的增加,阻抗变大。这种变化与O2在电极界面的扩散和吸附有关。
3 结论
采用水热法合成了纳米NiO,并进行了物相分析。将制备的纳米NiO作为氧气电极的催化剂,并组装了锂-氧扣式实验电池。
在0.1 mA/cm2的电流密度下,电池的首次放电比容量为1 258.4 mAh/g,放电电压平台稳定在2.7 V左右,充电电压平台为 4.2 V;在0.2 mA/cm2的电流密度下,电池的首次放电比容量为715.4 mAh/g,放电电压平台为2.6 V。
纳米NiO作为氧气电极的催化剂,可提高电池的比容量,但有关催化反应机理,还需进一步的深入研究。
[1]JU Ke-jiang(鞠克江),LIU Chang-rui(刘长瑞),TANG Changbin(唐长斌),et al.铝空气电池的研究进展及应用前景[J].Battery Bimonthly(电池),2009,39(1):50-52.
[2]Ogasawara T,Débart A,Holzapfel M,et al.Rechargeable Li2O2electrode for lithium batteries[J].J Am Chem Soc,2006,128(4):1 390-1 393.
[3]Xiao J,Xu W,Wang D Y,et al.Hybrid air-electrode for Li/air batteries[J].J Electrochem Soc,2010,157(3):A294-A297.
[4]Débart A,Bao J,Armstrong G,et al.An O2cathode for rechargeable lithium batteries:the effect of a catalyst[J].J Power Sources,2007,174(2):1 177-1 182.
[5]Ma M G,Zhu J F,Jiang J X,et al.Hydrothermal-polyol route to synthesis of β-Ni(OH)2and NiO in mixed solvents of 1,4-butanediol and water[J].Mater Lett,2009,63(21):1 791-1 793.
[6]Li X L,Han C L,Chen X Y,et al.Preparation and performance of straw based activated carbon for supercapacitor in non-aqueous electrolytes[J].Microporous Mesoporous Mater,2010,131(1-3):303-309.
[7]Yang X H,Xia Y Y.The effect of oxygen pressures on the electrochemical profile of lithium/oxygen battery[J].J Solid State Electrochem,2010,14(1):109-114.
[8]ZHENG Kai-ji(甄开吉),WANG Guo-jia(王国甲),LI Rongsheng(李荣生),et al.催化作用基础[M].(第3版),Beijing(北京):Science Press(科学出版社),2005.182-205.
[9]TANG Zhi-yuan(唐致远),RUAN Yan-li(阮艳莉).锂离子电池容量衰减机理的研究进展[J].Progress in Chemistry(化学进展),2005,17(1):1-7.
[10]Xu W,Xiao J,Wang D Y,et al.Effects of nonaqueous electrolytes on the performance of lithium/air batteries[J].J Electrochem Soc,2010,157(2):A219-A224.
[11]ZHAO Jia-chang(赵家昌),XU Jing-li(徐菁利),CHEN Si-hao(陈思浩),et al.多孔炭的孔结构与电化学性能的关系[J].Battery Bimonthly(电池),2008,38(1):17-20.

