顶空气相色谱法测定布美他尼原料药中残留的溶剂
罗亚虹,侯 军
(1.广西壮族自治区桂林食品药品检验所,广西 桂林 541002; 2.广西桂林南药股份有限公司,广西 桂林 541003)
布美他尼为一速效利尿药,利尿作用强,起效快,可用于治疗各种顽固性水肿及急性肺水肿,尤其适用于急、慢性肾功能衰竭[1]93。由于该药在合成过程中需使用甲苯、乙醇等有机溶剂,产品中的有机残留量对人体有害,依据人用药品注册技术规范国际协调会(ICH)提出的残留溶剂指导原则,甲苯、乙醇分别列为药品必须限制的第二类、三类有机溶剂[2]。笔者采用顶空气相色谱法测定布美他尼中有机溶剂的残留量,报道如下。
1 仪器与试药
日本岛津GC-17A型气相色谱仪,HSS-4A型顶空进样装置,CLASS-GC10型色谱工作站,GR-202型电子天平。布美他尼原料药(桂林南药股份有限公司,批号分别为080102,080103,080104);乙醇、甲苯、正丙醇均为分析纯,水为重蒸馏水。
2 方法与结果
2.1 色谱条件及系统适用性试验
色谱柱:DB-1型石英毛细管柱(30 m×0.53 mm,1.5 μm);柱温:采用程序升温,起始温度35℃,维持3 min,再以55℃ /min升温至90℃,维持1.5 min;载气:氮气;流速:4 mL/min;氢火焰离子化检测器(FID);进样口温度:200℃;检测器温度:250℃;顶空瓶温度:80℃,平衡30 min,进样量1 mL。在此色谱条件下,甲苯与乙醇分离满意。甲苯、乙醇、内标物正丙醇保留时间分别约为5.8,2.1,3.2 min。理论板数按正丙醇峰计不低于8 000。甲苯、乙醇与内标物正丙醇的分离度均大于2。色谱图见图1。
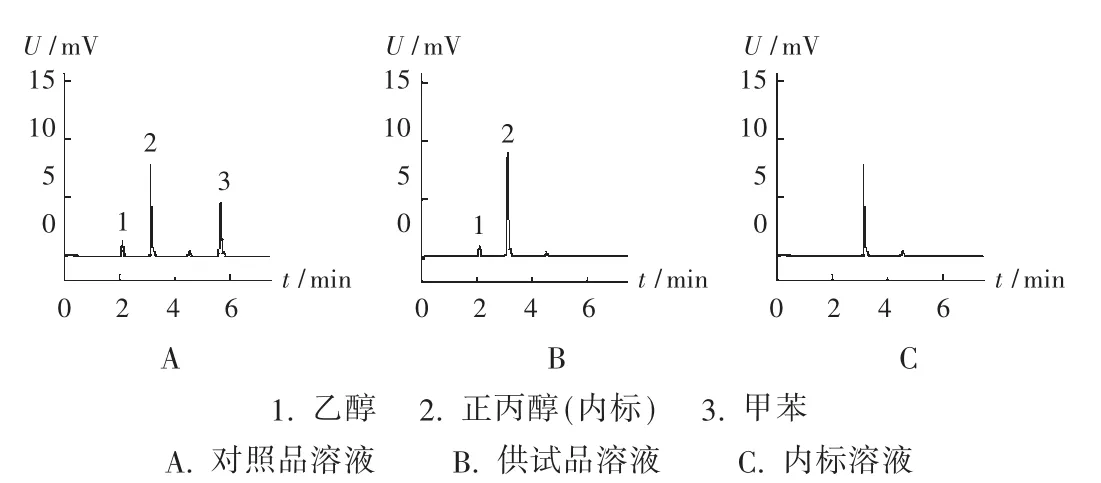
图1 高效液相色谱图
2.2 溶液制备
精密称定正丙醇8.75 mg,置250 mL量瓶中,加水至刻度,作为内标溶液。分别精密称取乙醇9.25 mg,甲苯9.0 mg,置250 mL量瓶中,加水至刻度,作为对照品贮备液;精密量取对照品贮备液0.5 mL,置顶空瓶内,精密加入内标溶液1 mL,加盖密封,作为对照品溶液。精密称取供试品约0.2 g,置顶空瓶内,精密加入内标溶液1 mL,加盖密封,作为供试品溶液。
2.3 方法学考察
专属性试验:取不加供试品的顶空瓶,精密加入内标溶液1 mL,加盖,按2.1项下色谱条件进样分析得色谱图。结果没有与乙醇、甲苯相同的色谱峰,说明内标物正丙醇所含的杂质对测定没有影响(图 1 C)。
线性关系考察:精密量取对照品贮备液0.1,0.3,0.5,0.7,0.9 mL,分别置顶空瓶中,各加内标溶液1 mL,加盖密封,在80℃保温30 min,按2.1项下色谱条件进样3次。分别以对照品乙醇、甲苯与内标物正丙醇的峰面积之比为纵坐标、对照品溶液的质量浓度为横坐标进行线性回归。结果乙醇和甲苯的回归方程分别为C=64.36 A-1.463,r=0.999 8(n=5),C=12.37 A-2.536,r=0.999 6(n=5)。当基线噪音峰为 S/N=3时,乙醇和甲苯的最低检测限分别为0.02 μg/g和0.05 μg/g。结果表明乙醇和甲苯的质量浓度分别在 3.7~33.3 μg/mL 和 3.6~32.4 μg/mL 的范围内与峰面积之比线性关系良好。
精密度试验:取同一对照品溶液,按2.1项下色谱条件连续进样6次。结果乙醇及甲苯与正丙醇的峰面积之比的 RSD分别为1.19%,1.01%。
重复性试验:取供试品(批号为080102),依法重复测定6次。结果乙醇的平均含量为4.08 μg/g,RSD为1.48%。
加样回收试验:用已测得残留量的试样,精密添加对照品贮备液0.3,0.5,0.7 mL,按2.1项下色谱条件进行测定,计算加样回收率。结果见表1。
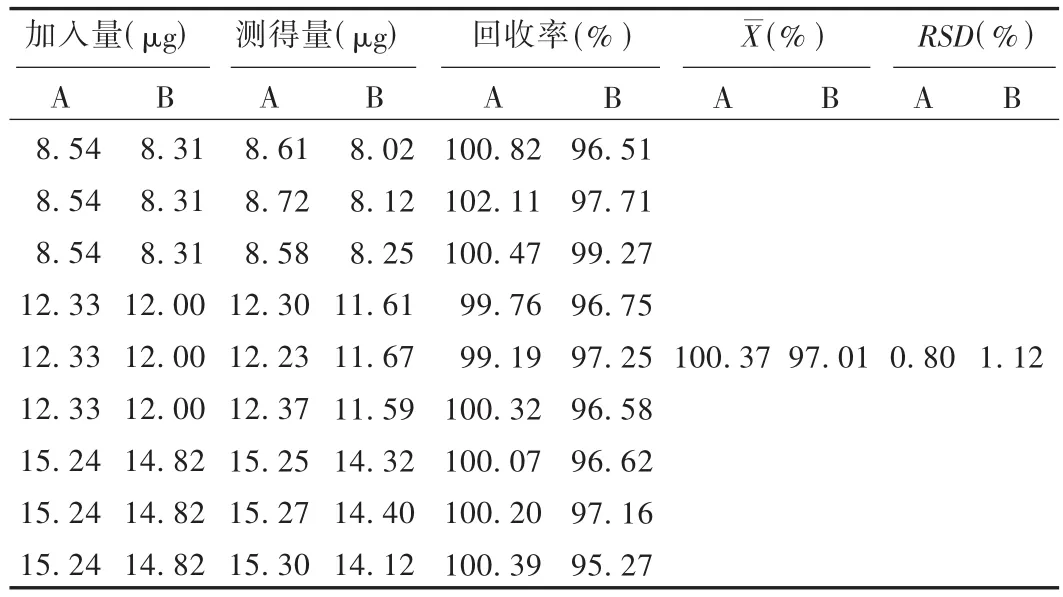
表1 乙醇和甲苯的加样回收试验结果(n=9)
2.4 样品含量测定
称取3批样品,每份约0.2 g,各置顶空瓶中,分别加入内标溶液1 mL,加盖密封,按2.1项下色谱条件进行测定。结果样品中均未检出甲苯,乙醇溶剂残留符合规定[2]。结果见表2。
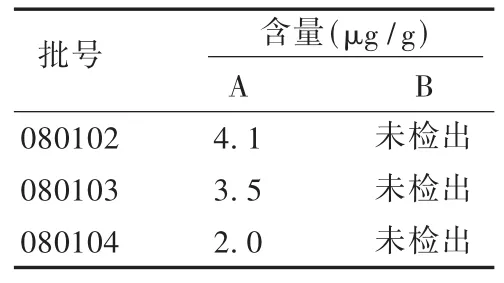
表2 样品含量测定结果(n=3)
3 讨论
在固定平衡时间时,曾对甲苯、乙醇在60,70,80,90℃下色谱响应值(峰面积)的变化进行试验,结果在80℃时两种溶剂的响应值(峰面积)最大,故选用80℃作为顶空平衡温度。
顶空平衡时间取决于被测组分分子从基质到气相的扩散速度,固定平衡温度为80℃时,曾试验甲苯、乙醇在平衡时间为5,10,20,30,40 min 时色谱响应值(峰面积)的变化,结果平衡时间30 min时达到最大值,说明在30 min时各组分已达到了气液两相平衡,故选择30 min作为顶空平衡时间。
本试验所建立的顶空气相色谱法,液体与固体共存顶空自动化进样,试验方法简便、灵敏度高、精密度及重复性好,可作为布美他尼原料药中的有机溶剂残留测定,对保证产品质量和用药安全具有实用性,可用于实际生产中的质量控制。
根据药品中常见的残留溶剂及限度[1]附录56规定及本试验的最低检测限,建议对本品中乙醇、甲苯的限度分别规定为5 mg/g和0.89 mg/g。
[1]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2005.
[2]周海钧.药品注册的国际技术要求:质量部分(ICH指导委员会)[M].北京:人民卫生出版社,2000:88-89.

