超细AgO粉末:制备及热分解非等温动力学
沈文宁冯拉俊孔珍珍冯 慧
(1西安理工大学材料学院,西安 710048)
(2陕西省动物研究所,西安 710032)
超细AgO粉末:制备及热分解非等温动力学
沈文宁*,1冯拉俊1孔珍珍1冯 慧2
(1西安理工大学材料学院,西安 710048)
(2陕西省动物研究所,西安 710032)
采用化学沉淀法,以臭氧为氧化剂制备了超细AgO粉末,并用XRD、XPS、SEM和粒度分析仪对制备的粉末进行了表征,借助热重分析法(TG)和线性升温理论对超细AgO粉末的热分解过程和非等温热分解动力学机理进行了研究。结果表明,制备的AgO属于单斜晶系,形貌为片状,其粒径分布在45~551 nm之间,大部分在200 nm左右;AgO的热分解分两步,158℃开始分解,放出氧气形成Ag2O,413℃进一步分解形成Ag;其热分解反应服从核生成和核成长为控制步骤的A2机理,热分解表观活化能为 90.26 kJ·mol-1,反应频率因子为 1.64×108s-1。
AgO;热分解;动力学;反应机理
0 引 言
过氧化银具有特殊的强氧化性、电磁性质、无毒性和广谱快速杀菌能力,在蓄电池比功率要求较高的军事、航空航天等高新技术领域和抗菌消毒领域具有广阔的应用前景[1-3]。但是,现有的制备工艺存在制备的AgO粒径粗大、纯度低、制备过程污染严重等不足[1,4-5]。另外AgO的热分解为固相反应,固相反应受相界面传热传质影响,热分解反应机理和动力学参数常随反应条件、晶型和颗粒尺度不同而变化[6-7],使人们很难掌握AgO的热稳定性规律,导致AgO的存储和应用受到很大限制。为此,本工作采用具有极强氧化性的臭氧为氧化剂,将Ag+氧化成Ag2+制备AgO超细粉末,解决了现有制备AgO过程的污染问题;利用X射线粉末衍射仪(XRD)、X射线光电子能谱仪、扫描电子显微镜(SEM)和激光粒度仪对制备的超细AgO粉末进行表征;通过热重法和对不同升温速率的TG-DTG曲线的联合采点分析,研究了超细AgO粉末的热分解过程及热分解动力学,为AgO的存储和应用提供理论依据。
1 实验部分
1.1 试 剂
AgNO3(西安有色金属研究所,A.R.),NaOH(郑州派尼化学试剂厂,A.R.),臭氧/空气混合气(WI-2317481型臭氧发生器发生,臭氧浓度为17 mg·L-1,流量为1.5 L·min-1),实验用水为实验室自制去离子水。
1.2 超细AgO粉末的制备
采用化学沉淀法制备超细AgO粉末。首先配制浓度为 0.15 mol·L-1的 AgNO3溶液 200 mL 和浓度为 5.6 mol·L-1的 NaOH 溶液 50 mL待用。然后将AgNO3溶液加入500 mL三口球形反应器中并置于恒温水浴锅内,保持水浴锅温度45±1℃,在搅拌的条件下滴加NaOH溶液,滴加的速度控制在20 mL·min-1,滴加完毕后通入臭氧/空气混合气反应5 h。待反应完成后将产物清洗、过滤,并将湿粉在70℃干燥5 h,得到AgO粉末。
1.3 表 征
采用日本岛津XRD-7000S型X射线衍射仪(Cu Kα)表征产物的晶体结构,X 射线源为Cu Kα(λ=0.154 18 nm),管电压 40 kV,管电流 30 mA,石墨单色器滤波,衍射角 2θ的扫描速度为 10°·min-1,扫描角度范围为 20°~80°。采用英国 Kratos Analytical公司AXIS ULTRA型X射线光电子能谱仪分析产物的化学组成及元素结合状态,激发源为Al Kα(1 486.7 eV),辐射功率 150 W,分析室真空优于 2×10-8Pa,以玷污碳 C1s(Eb=284.8 eV)做能量参考,测试高分辨谱通道能量为20 eV。采用日本JSM-6700F型扫描电子显微镜表征产物的形貌和大小,测试前在样品表面溅射一层Pt膜,加速电压10 kV,加速电流10 μA。采用BT-2003型激光粒度仪表征产物的粒度分布。采用WRT-3P型微量热天平仪在不同的升温速率下对样品进行热重测试,测试气氛为空气,样品用量分别为 32.92、40.42、32.50、32.67 mg,对应的升温速率分别为 5、10、15、20 ℃·min-1。
2 结果与讨论
2.1 AgO粉末的结果分析
图1为AgO粉末的XRD图,由图可见该粉末的衍射峰形尖而窄,峰形规整,表明样品的结晶度很高。在 2θ=32.0°、32.3°、34.2°、37.2°、39.4°处的 5 个主强衍射峰分别对应于单斜晶系AgO的5个特征衍射 峰 d200(0.279 nm)、d111(0.277 nm)、d002(0.262 nm)、d111(0.242 nm)、d202(0.229 nm)。在 2θ=32.8°附近的微弱衍射峰是样品中杂质Ag2O的最强特征峰。衍射强度理论指出,混合物中不同物质的含量与其对应的最强峰的强度有关,强度越强其含量越高,由于图1中AgO的最强衍射峰强度远远高于Ag2O的最强衍射峰,从而可以说明制备的粉末中AgO含量很高。

为了进一步确定合成产物为AgO,借助XPS对产物的Ag和O元素进行高分辨扫描。图2为AgO粉末经修正和计算机拟合后得到的Ag3d和O1s高分辨谱图。由图可见,Ag和O元素存在多种结合状态。图 2(a)中结合能为 368.1 eV的 Ag3d5/2峰与Gerenser[8]报道的AgO的结合能为368.1 eV一致,同时图2(b)中结合能为529.3 eV的O1s峰与标准手册中AgO的结合能一致[9],所以合成产物中Ag元素主要以AgO形式存在;结合能为367.7 eV的Ag3d5/2峰与标准手册中Ag2O(367.7 eV)结合能一致[9],说明粉末中含有少量的Ag2O。Ag2O的存在是由于氧化反应未完全,不能把初始形成的Ag2O全部转化为AgO。
图3为AgO粉末的SEM图。由图中可见,粉末基本为片状,大部分片状颗粒的直径约为200 nm,也有部分颗粒的粒径小于100 nm。
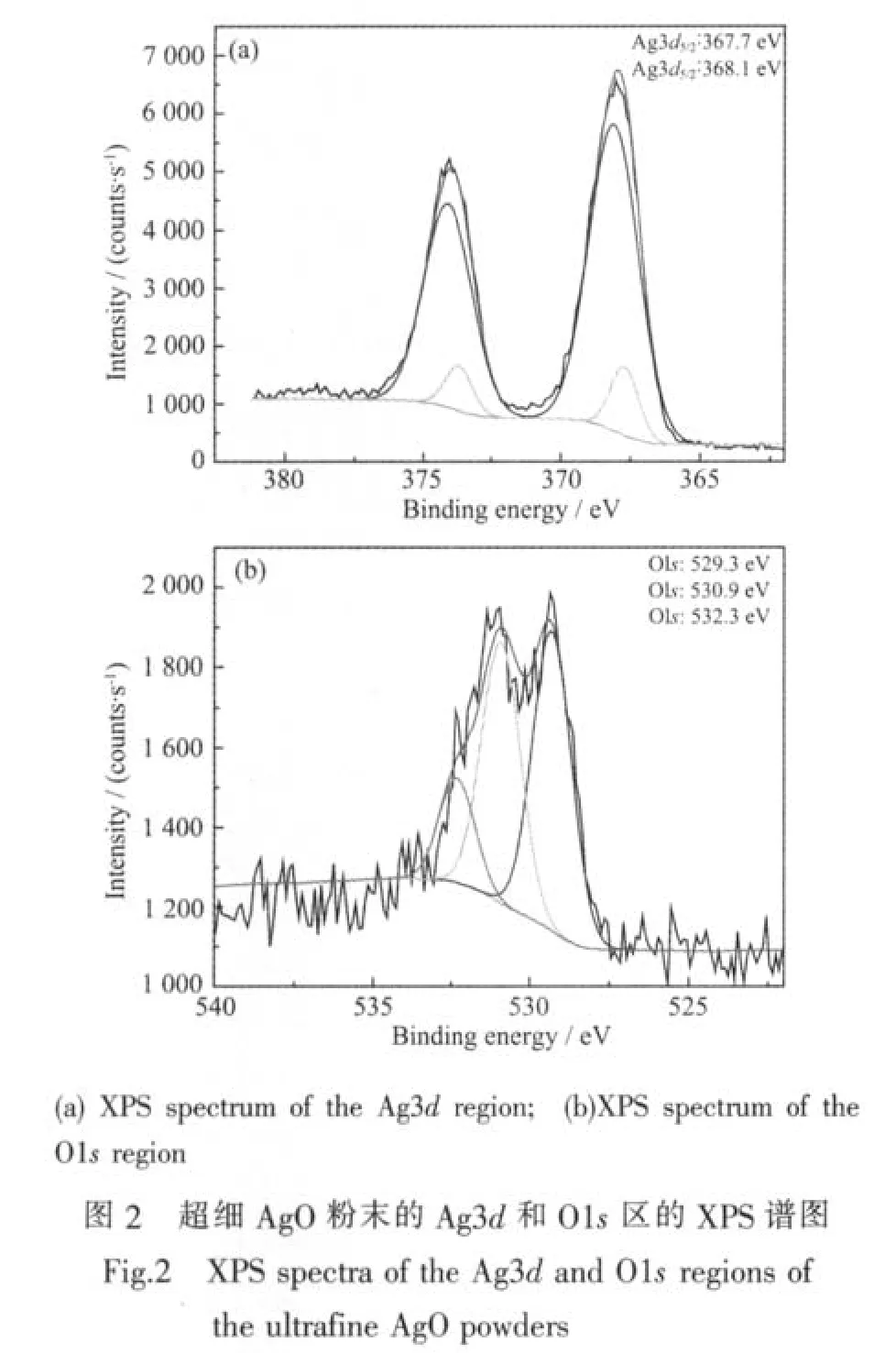

图4为AgO粉末的粒度分布测试结果。由图中可见,粉末的粒径分布在45~551 nm之间,粉末中位径为170 nm,粉末中粒径小于100 nm的颗粒占总颗粒的18.64%,属于超细粉末。

2.2 超细AgO粉末的热分解过程
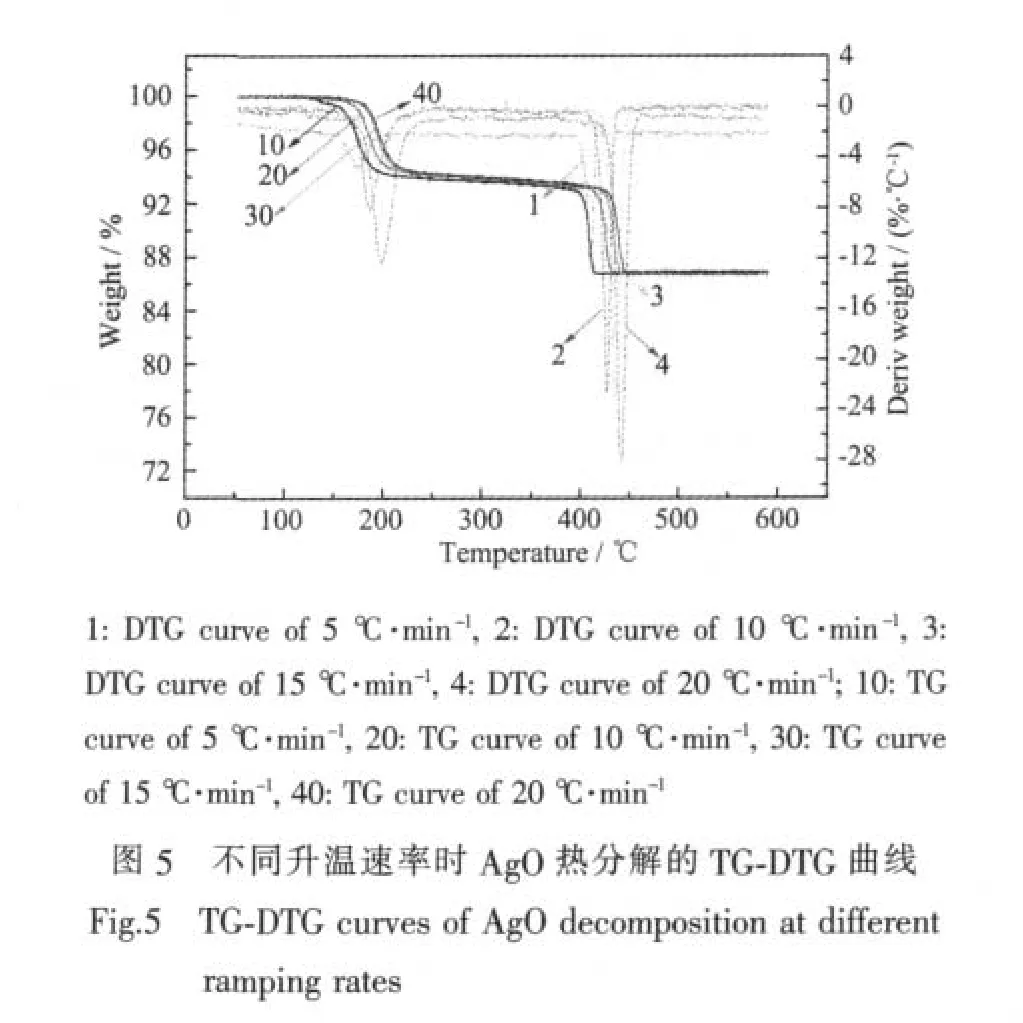
对制备的AgO粉末进行了热重(TG)测试,不同升温速率时测得的热重结果如图5所示。从图中可见,4条TG曲线在整个程序升温过程中都出现了两级失重台阶,不同升温速率对应的失重台阶的失重百分率基本一致,随着升温速率加快,AgO粉末分解的起始温度和终止温度逐渐升高,其DTG峰也更加尖锐,这表明AgO的热分解分两步。其中升温速率为15℃·min-1时,在158~235℃之间有一级失重台阶,该过程的失重百分率为6.3%,为AgO分解成Ag2O放出氧气的过程,与理论值6.5%基本相符。TG曲线中的二级失重台阶是分解形成的Ag2O进一步分解成Ag放出氧气的过程,Ag2O分解起始温度为413℃,至452℃分解完成,该分解过程的失重百分率为 6.7%,与理论值 6.9%基本相符。
2.3 超细AgO粉末热分解反应机理分析
由于AgO受热分解成Ag2O时,其晶体结构发生改变,因此引入非等温反应动力学理论确定AgO结构改变的机理。
根据非等温反应动力学理论[10],线性升温条件下的固相物质的分解反应动力学方程为:
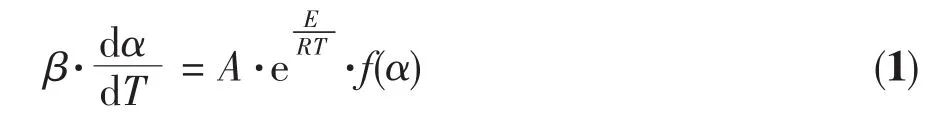
式中,α为在温度T时的反应分解分数;f(α)为动力学机理函数,为α的函数;A为频率因子(min-1);E为活化能(J·mol-1);T为反应温度(K);β为线性升温速率(℃·min-1)。
首先从单条TG曲线对固相分解反应非等温动力学进行研究,采用Doyle机理方程(2)[10-11]:
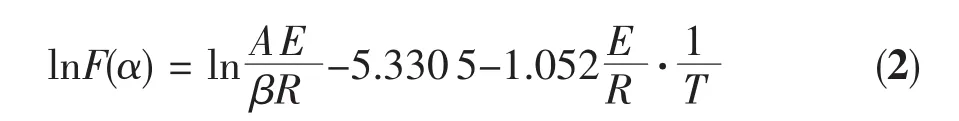
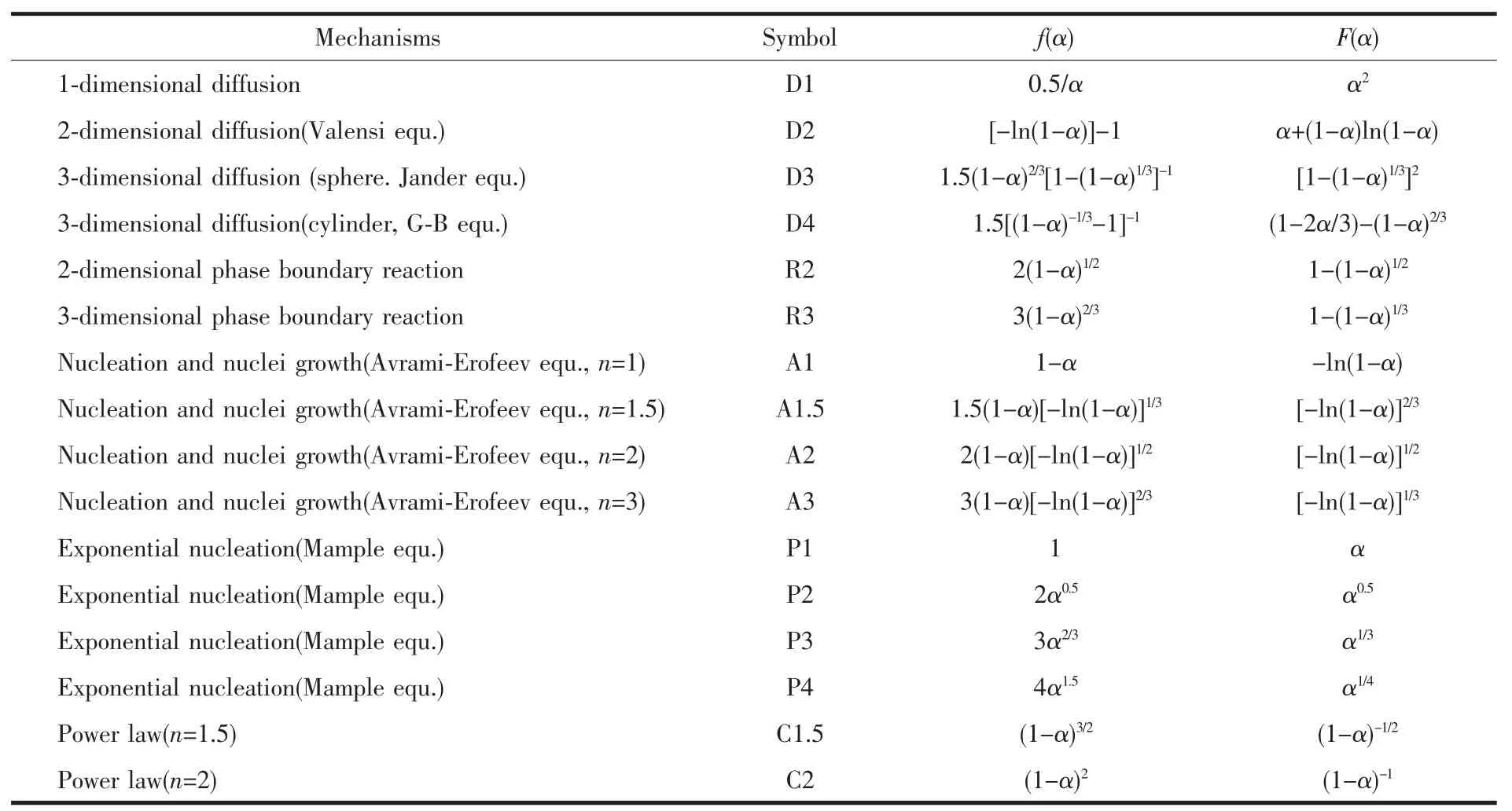
表1 常见固体热分解反应机理[12]Table1 Most frequently used mechanisms of solid state processes
为了进行对比,采用Coats-Redfern方程(3)[11]求取动力学参数:

式(3)中2RT/E项值随温度变化很小,在程序升温过程中可视为常数,故ln[F(α)/T2]对1/T作图应是一条直线,从斜率可求得表观活化能,取反应过程的平均温度,从截距求得反应频率因子A。
应用以上2种积分方法直接由试验数据α和T求算动力学参数,避开了由dα/dT求算所可能引入的计算误差,因此是较为合理的。
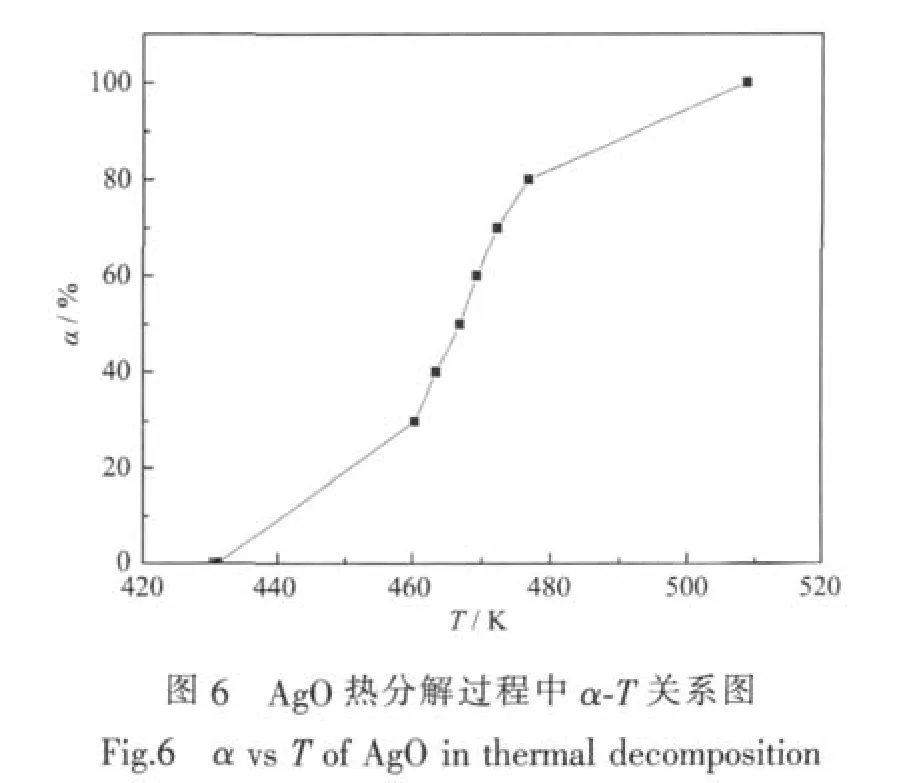
对于升温速率β=15℃·min-1获得的TG曲线,AgO分解成Ag2O过程中α-T的关系如图6所示。采用Doyle方程和Coats-Redfern方程代入α和T的试验数据,分别对AgO热分解反应动力学进行了参数计算,结果分别如表2和表3所示。由表2和表3可以看出,2种计算方法的结果比较接近,但由于应用Doyle方程的条件比Coats-Redfern方法更为严格,其拟合的线性相关性较Coats-Redfern方法普遍有所提高。

表2 各种固相反应机理对AgO热分解反应的拟合结果Table 2 Fitted results of solid state reaction mechanisms for decomposition of AgO
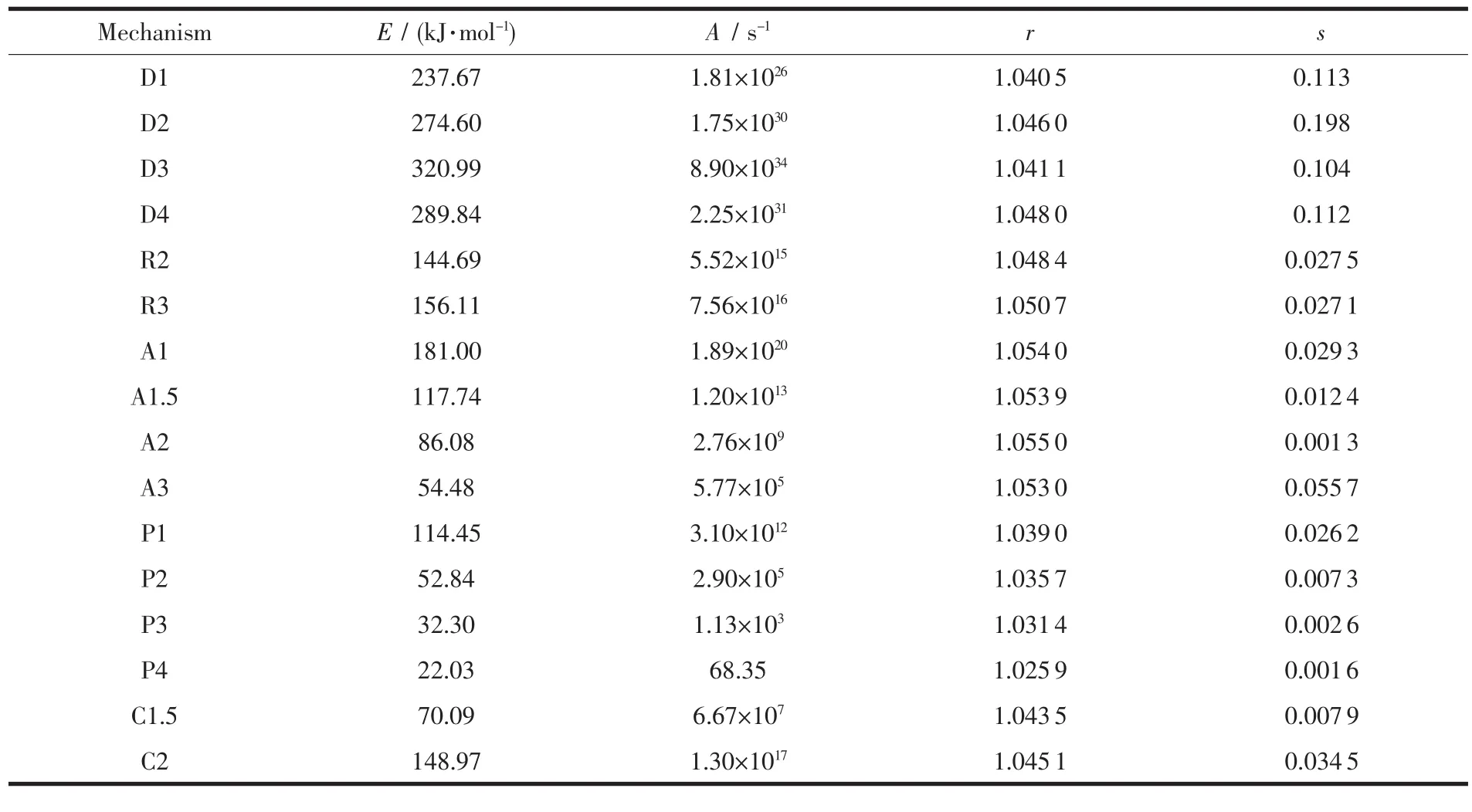
表3 各种固相反应机理对AgO热分解反应的拟合结果Table 3 Fitted results of solid state reaction mechanisms for decomposition of AgO
判断固相分解反应机理时,一般是以线性相关性r作为主要判据,如果F(α)函数式代表分解过程的真实情况,则该直线的线性相关性越佳;如果线性相关性适中时,则选取平均标准偏差作为辅助判断,确定最可能的机理函数。从表2和表3的数据可以看出,线性相关系数最大值r=1.056 1,而标准偏差最小值s=0.003 6,因此,机理模型A2即Avrami-Erofeev的核生成和核成长机理是AgO的热分解机理。根据确定的机理模型A2,利用线性相关性较好的Doyle方程求取动力学参数,计算结果为:表观活化能 E=90.26 kJ·mol-1,反应频率因子 A=1.64×108s-1。求得的热分解活化能在热分解温度范围内有22.76≤E/RT≤23.59,满 足 Doyle 方 程的20≤E/RT≤60这一假设,说明采用Doyle方程是合理的,故相应的动力学方程式为。

对于活化能和反应频率因子的计算还可用Ozawa法。Ozawa法是一种近似积分法,其特点是E的计算不涉及反应机理函数的选择,从而避免了由反应机理选择所带来的误差[13],因而可以用Ozawa法验证A2反应机理的正确性。根据Ozawa方程
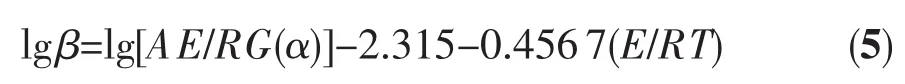
在4种不同的升温速率β下选择相同的数个α,以各α时的lgβ-1/T对式(5)用最小二乘法作线性拟合,由斜率得到如表4所示的AgO在不同α条件下的E值。由表2、表3和表4可见,不同机理模型计算得到的E值中,只有A2机理的E值与各α条件下得到的E值较吻合,从而证明了A2机理模型的正确性。因此AgO热分解过程是成核与核成长同时进行的过程,在AgO点阵上的质点由于温度升高,振动加剧后形成了能导致分解的局部反应中心而成核,分散的核中心进一步长大、扩大,分解速度加快,因而整个热分解反应过程是随着AgO表面成核与核成长,导致了其单斜结构破坏与简单立方结构的Ag2O生成的过程。

表4 在不同的α时对AgO分解阶段用Ozawa法计算得到的E值Table 4 Activation energy of AgO decomposition obtained from Ozawa method under different α
3 结 论
(1)以臭氧为氧化剂,采用化学沉淀法,在45℃制备出纯度高的AgO粉末。AgO属于单斜晶系,具有片状形貌,AgO粉末的粒径在45~551 nm之间,中位径为170 nm,小于100 nm的颗粒占总颗粒的18.64%。
(2)AgO的热分解分两步,158℃开始分解,放出氧气形成 Ag2O,413℃进一步分解成 Ag,至452℃分解完成。
(3)AgO分解机理属于以Avrami-Erofeev的核生成和核成长为控制步骤的A2机理,分解反应表观 活 化 能为 90.26 kJ·mol-1,频率因子为1.64×108s-1,相应的动力学方程式为:dα/dt=1.64×108×exp[-90.26×103/(RT)]×2(1-α)[-ln(1-α)]1/2。
[1]ZHANG Yu(张 钰).Thesis for the Master of Beijing University of Chemical Technology(北京化工大学硕士论文).2007.
[2]Smith D F,Brown C.J.Power Source,2001,96(1):121-127
[3]HUANG Han-Sheng(黄 汉 生).Det.Cos.(Riyong Huaxuepin Kexue),1996,(2):7-8
[4]MENG Fan-Ming(孟 凡 明).Thesis for the Doctorate of Sichuan University(四川大学博士论文).2004.
[5]LI Qian(李 茜),CHEN Kang(陈 康),JIAO Li-Li(焦莉莉),et al.Water Pur.Technol.(Jingshui Jishu),2008,27(1):12-15,19
[6]YUE Lin-Hai(岳林海),SHUI Miao(水 淼),XU Zhu-De(徐 铸 德),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2000,21(10):1555-1559
[7]MENG Fan-Ming(孟凡明),LI Li-Qun(李利群),XIAO Ding-Qun(肖定全).J.Funct.Mater.(Gongneng Cailiao),2004,35(2):203-205
[8]Gerenser L J.J.Vac.Sci.Technol.A,1990,8(5):3682-3691
[9]Moulder J F,Sticle W F,Sobol P E,et al.Handbook of X-Ray Photoelectron Spectroscopy.Eden Prairie:Perkin Elmer,1992.175
[10]HU Rong-Zu(胡 荣 祖),SHI Qi-Zhen(史 启 祯).Thermal Analysis Kinetics(热分析动力学).Beijing:Science Press,2001.
[11]LI Feng(李 峰),HE Jing(何 静),DU Yi-Bo(杜以波),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),1999,15(1):55-60
[12]CHU Shi-Jin(楚士晋).Thermal Analysis of Explosives(炸药热分析).Beijing:Science Press,1994.
[13]LI Qing-Lian(李青莲),CHEN Shou-Tian(陈寿田),YAO Pu(姚 朴),et al.Acta Phys-Chim Sin.(Wuli Huaxue Xuebao),2000,16(2):170-174
Ultrafine Silver Peroxides:Preparation and Non-isothermal Kinetics of Thermal Decomposition
SHEN Wen-Ning*,1FENG La-Jun1KONG Zhen-Zhen1FENG Hui2
(1School of Meterial Science and Engineering,Xi′an University of Technology,Xi′an 710048)
(2Shaanxi Institute of Zoology,Xi′an 710032)
Ultrafine silver peroxide powders were prepared by chemical precipitation method using ozone as oxidant and characterized by X-ray diffraction,X-ray photoelectron spectroscopy,scanning electron microscope and particle size analyzer.The process and kinetic behavior of thermal decomposition of ultrafine silver peroxide powders were studied by means of thermogravimetry and linear temperature theory.The results show that the prepared silver peroxide belongs to monoclinic system.The particle size is distributed in the range of 45~551 nm with a flake morphology and the most probable distribution is around 200 nm.The decomposition of silver peroxide is in two steps.First decomposition begins at 158 ℃ and silver oxide is formed by oxygen evolution.Further decomposition into silver begins at 413℃.The decomposition reaction obeys random nucleation and subsequent growth mechanism(A2)with an apparent activation energy of 90.26 kJ·mol-1and a reaction frequency factor of 1.64×108s-1.
silver peroxide;thermal decomposition;kinetics;reaction mechanism
O614.122
A
1001-4861(2010)09-1577-06
2010-04-07。收修改稿日期:2010-06-04。
*通讯联系人。E-mail:shenwenning@qq.com
沈文宁,女,25岁,博士研究生;研究方向:新型功能材料的制备及其抗菌性能。

