大麦芽中淀粉酶系活力的测定及其作用特性
何艳克,胡 飞
(华南理工大学轻工与食品学院,广东 广州 510640)
大麦芽中淀粉酶系活力的测定及其作用特性
何艳克,胡 飞
(华南理工大学轻工与食品学院,广东 广州 510640)
采用BPNPG7法、PNPβ-G3法和普鲁兰法分别测定大麦芽中α-淀粉酶、β-淀粉酶和极限糊精酶活力,探讨温度和pH值对大麦芽淀粉酶系活性的影响规律,并分析淀粉酶系的热稳定性及作用特性。结果表明:大麦芽中α-淀粉酶、β-淀粉酶和极限糊精酶的最适温度分别是70、60℃和55℃,最适pH值分别为5.5、5.5和5;α-淀粉酶热稳定性相对较高;β-淀粉酶在50℃和55℃时能保持良好的热稳定性;极限糊精酶热稳定性相对较差。α-淀粉酶、β-淀粉酶和极限糊精酶与水解体系还原糖含量有一定的关系。
大麦芽;淀粉酶;活力;测定;特性
Abstract :The activities of alpha-amylase, beta-amylase and limit dextrinase in malt were measured by BPNPG7 method, PNP β-G3 method and pullulan method, respectively. Based on this investigation, the influences of temperature and pH value on the activity of the amylases were discussed and their thermal stability and hydrolysis performance were analyzed. The results showed the optimal reaction temperature for malt alpha-amylase, beta-amylase and limit dextrinase was 70, 60℃ and 55 ℃, and the optimal reaction pH values were 5.5, 5.5 and 5, respectively. The thermal stability of the alpha-amylase was better than that of two other amylases. Malt beta-amylase could retain good thermal stability at 50℃ and 55℃. Comparatively, malt limit dextrinase had poor thermal stability. In addition, these three amylases in malt presented certain relationships between activities at different reaction temperature and reducing sugar content in hydrolysis system.
Key words:malt;amylase;activity;determination;characteristics
淀粉是啤酒酿造的重要成分,其通过多种酶协同作用形成低分子寡糖方可被酵母利用[1]。与淀粉降解密切相关的大麦芽淀粉酶有α-淀粉酶、β-淀粉酶和极限糊精酶等[2-4]。在淀粉酶解过程中,α-淀粉酶和β-淀粉酶不能水解支链糊精,两者协同作用虽可加快淀粉的降解速度,并不能改变终产物组成。极限糊精酶具有高度特异性,专门水解支链淀粉和分支糊精中的α-1,6糖苷键,提高淀粉的水解率[5-7]。尽管早在1943年Myrback[8]报道了极限糊精酶的存在,但因其含量很少且难以检测,一直以来在糖化过程中的重要作用并未受到重视。近年来,酶检测技术的不断改进为极限糊精酶性质研究提供了重要平台。目前,国外对极限糊精酶的作用、遗传控制和表达特点有了不少研究[9-12],但国内相关报道很少[13-14]。
大麦芽中α-淀粉酶、β-淀粉酶和极限糊精酶活力是决定淀粉水解速率和终产物的重要参数。因此,对大麦芽淀粉酶系的性质和作用规律进行系统评价很有必要。本实验在检测大麦芽淀粉酶系活力的基础上,系统研究α-淀粉酶、β-淀粉酶和极限糊精酶的作用特性,并探讨它们与还原糖之间的关系。
1 材料与方法
1.1 材料与试剂
大麦芽(Gairdner、Sloop、Kendel、Metcalfe 和甘啤3号) 广州麦芽公司。
BPNPG7、PNPβ-G3、普鲁兰试剂组 爱尔兰Megazyme公司;3,5-二硝基水杨酸(DNS,分析纯) 广州化学试剂厂。
1.2 仪器与设备
T6新世纪紫外-可见分光光度计 北京普析通用有限公司;HH-2高精度恒温水浴锅 江苏金坛市宏华仪器厂;PHS-25数字酸度计 上海雷磁仪器厂。
1.3 方法
1.3.1 α-淀粉酶活力的测定
采用BPNPG7法:称取1.0g麦芽粉,加2g NaCl、0.04g CaCl2和0.04g叠氮化钠,定容至200mL,室温下浸提30min,离心取上清液以备用。以0.2mL BPNPG7和α-葡萄糖苷酶混合液为底物,40℃条件下与0.2mL酶提取稀释液准确反应10min,于波长410nm处测定吸光度。
酶比活力单位定义(U/g):在40℃每分钟催化底物释放1mol对硝基苯酚所需的酶量。
1.3.2 β-淀粉酶活力的测定
采用PNPβ-G3法:称取1.0g麦芽粉,加10.0mL浸提缓冲液,室温下浸提1h,离心取上清液以用于β-淀粉酶活力测定。以0.2mL PNPβ-G3和β-葡聚糖酶混合液为底物,40℃条件下与0.2mL酶提取稀释液准确反应10min,于波长410nm处测定吸光度。
酶比活力单位定义(U/g):在40℃每分钟催化底物释放1mol对硝基苯酚所需的酶量乘以55.5,换算为Betamy1方法底物条件下每分钟释放1mol对硝基苯酚所需的酶量。
1.3.3 极限糊精酶活力的测定
采用普鲁兰法:称取1.0g麦芽粉,加入含20mmol/L Cys-HCl的0.2mol/L醋酸钠缓冲液(pH5.5)16mL,置于恒温水浴摇床上,40℃、100r/min水浴16h,离心取上清液,与普鲁兰在40℃水浴10min,于波长590nm处测定吸光度。
酶比活力单位定义(U/kg):在40℃每分钟催化底物所释放的还原糖,其还原力相当于1mg麦芽糖所需的酶量。
1.3.4 α-淀粉酶、β-淀粉酶及极限糊精酶热稳定性测定
调节α-淀粉酶、β-淀粉酶和极限糊精酶酶液的pH值分别为5.5、5.5和5,置于不同温度水浴中分别作用10~50min后迅速冷却至室温,均在40℃条件下,测定酶活力。以未进行温度处理前的初始酶活力为100%,计算残余酶活力。
2 结果与分析
2.1 不同品种大麦芽α-淀粉酶、β-淀粉酶和极限糊精酶活力
测定不同品种大麦芽中淀粉酶活力,并与DNS法[15-17]进行比较,结果如表1所示。不同品种大麦芽中α-淀粉酶、β-淀粉酶和极限糊精酶活力差异较大,Gairdner、Sloop和Metcalfe淀粉酶含量相对较高。DNS法测定结果与BPNPG7、PNPβ-G3法有一定差异。DNS法主要根据α-淀粉酶和β-淀粉酶的酶学特性采用选择性失活的技术来测定两者的酶活力,有时由于两者生化特性差异并不十分明显会干扰测定结果。BPNPG7、PNPβ-G3采用底物酶解法测定,寡聚糖分别被内源α-淀粉酶和β-淀粉酶水解后,产物再分别被α-葡萄糖苷酶和β-葡萄糖苷酶分解成还原糖和硝基苯酚后进行测定。该方法可消除其他淀粉酶的干扰,结果更为合理、准确。同时证实了极限糊精酶的存在,而且定量给出了其活力水平。
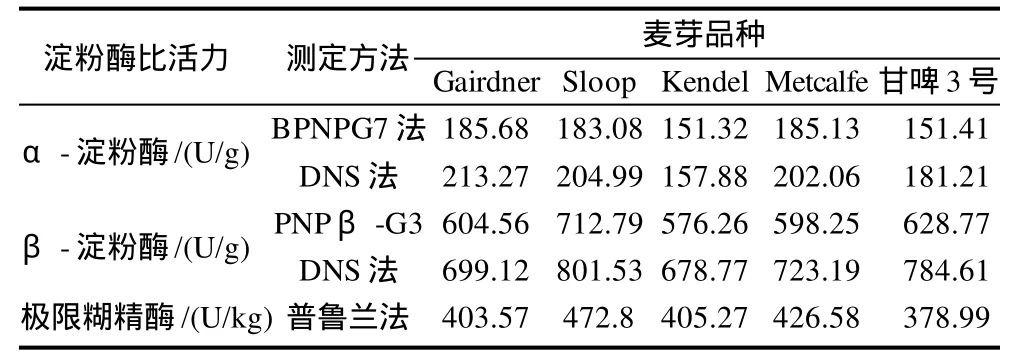
表1 麦芽中α-淀粉酶、β-淀粉酶和极限糊精酶活力Table 1 Activities of α-amylase, β -amylase and limit dextrinase in malts from different barley varieties
2.2 大麦芽中α-淀粉酶、β-淀粉酶和极限糊精酶的作用特性
2.2.1 温度和pH值对大麦芽α-淀粉酶、β-淀粉酶和极限糊精酶活性的影响
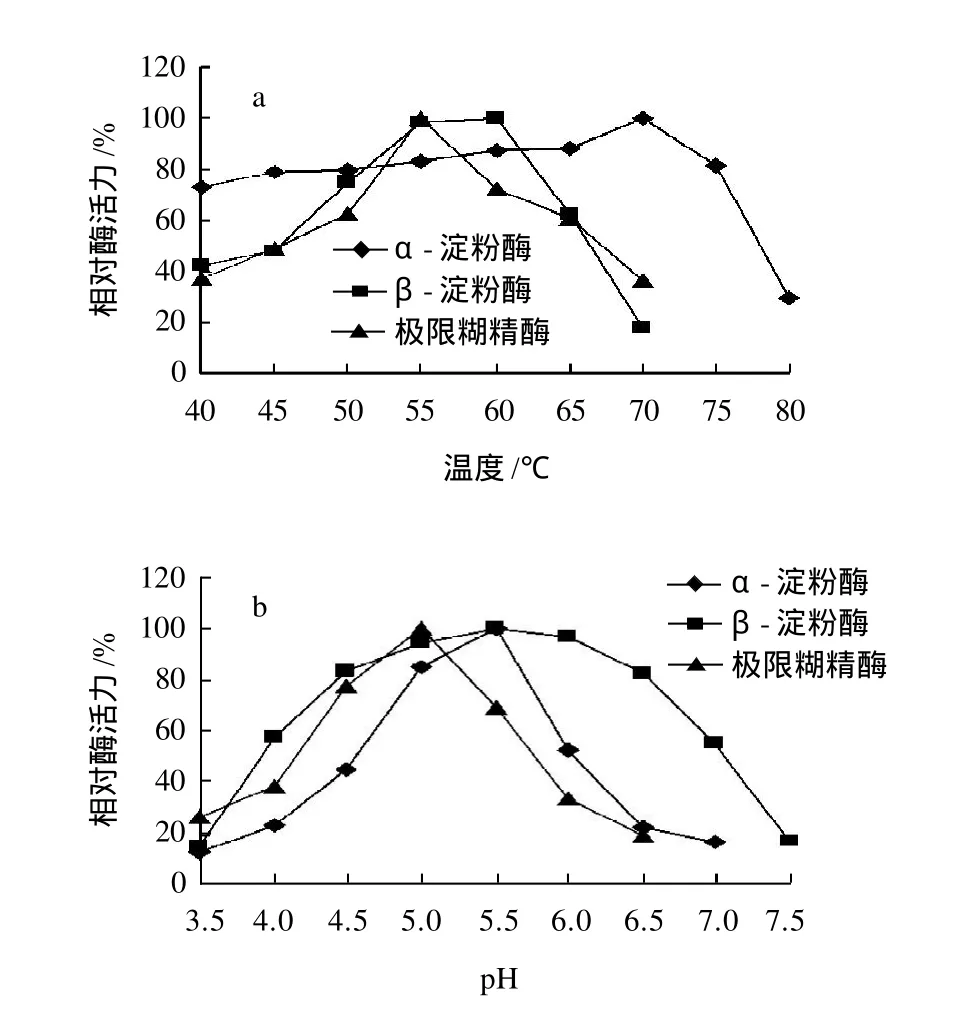
图1 温度(a)和pH值(b)对α-淀粉酶、β-淀粉酶和极限糊精酶酶活力的影响Fig.1 Effects of temperature and pH on malt α -amylase, β -amylase and limit dextrinase activities
温度和pH值是影响酶活力的关键因素,分别在不同温度和pH值条件下测定大麦芽中α-淀粉酶、β-淀粉酶和极限糊精酶活力,以最高酶活力为100%,计算各温度和pH条件下相对酶活力,结果见图1。
由图1a可知,α-淀粉酶温度作用范围较宽,40~60℃酶活力受温度影响不大,70℃左右酶活力达最大值;β-淀粉酶和极限糊精酶温度作用范围较窄,最佳酶活力温度分别为60℃和55℃左右。图1b表明α-淀粉酶和极限糊精酶受pH值影响较为明显,分别在pH值5.5和5达到最大酶活力水平;β-淀粉酶受pH值影响相对不敏感,5.5为最佳作用pH值。
2.2.2 大麦芽中α-淀粉酶、β-淀粉酶和极限糊精酶的热稳定性

图2 大麦芽α -淀粉酶(a)、β -淀粉酶(b)和极限糊精酶(c)的热稳定性Fig.2 Thermal stability of maltα -amylase, β -amylase and limit dextrinase activity
由图2可知,α-淀粉酶在60℃时较稳定,30min时酶活力仍保存87.12%;在65℃时,酶活力衰减加剧,10min后残余酶活力仅为68.96%;在70℃条件下,酶活力半衰期不足10min。β-淀粉酶在50℃和55℃条件下酶活力比较稳定,60℃时酶活力迅速下降,30min后残余酶活力为64.94%。极限糊精酶50℃时酶活力较为稳定,60℃时失活率加剧,10min后残余酶活力仅为28.18%。
2.3 α-淀粉酶、β-淀粉酶和极限糊精酶与还原糖之间的关系
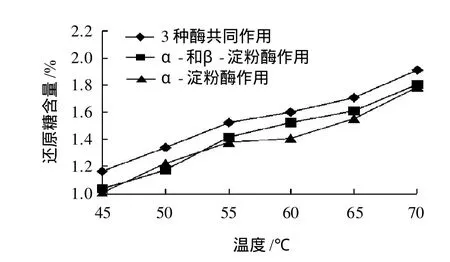
图3 α-淀粉酶、β-淀粉酶和极限糊精酶与还原糖之间的关系Fig.3 Change in reducing sugar content in hydrolysis system with reaction temperature for hydrolysis by maltα -amylase, β -amylase or limit dextrinase
α-淀粉酶、β-淀粉酶和极限糊精酶可将淀粉水解为小分子可发酵性糖,从而有利于酵母利用。可发酵性糖主要有葡萄糖、果糖、麦芽糖和麦芽三糖等,通过分析酶活力与还原糖含量之间的关系可研究淀粉酶的作用特性。由图3可知,3种酶共同作用所产生的还原糖高于α-和β-淀粉酶两酶、α-淀粉酶单酶作用体系,尤其在45~55℃三种酶共同作用体系还原糖增高趋势相对明显,推测极限糊精酶在此温度范围内发挥了作用;α-和β-淀粉酶双酶体系与α-淀粉酶单酶体系相比,55~65℃双酶体系水解效果较好。
3 结 论
本实验系统研究了大麦芽中α-淀粉酶、β-淀粉酶和极限糊精酶的特性和作用规律。结果表明:大麦芽中淀粉酶系最适作用条件不同,且热稳定性存在明显差异性。特别是极限糊精酶热稳定性相对较差,60℃条件下酶活力显著衰减。同时,极限糊精酶与还原糖含量有一定相关性,在一定环境下具有不可忽略的作用。因此,在制麦或糖化过程中,应根据各淀粉酶特性,制定合理的工艺条件,使其均能发挥最佳活力,特别是应根据极限糊精酶特性,适当延长其作用时间,以提高淀粉的水解效率。
[1] 周广田. 啤酒酿造技术[M]. 济南: 山东大学出版社, 2005.
[2] MACGREGOR A W, BAZIN S L, MACRI L J, et al. Modelling the contribution of alpha-amylase, beta-amylase and limit dextrinase to starch degradation during mashing[J]. Journal of Cereal Science, 1999, 29:161-169.
[3] WOLFGANG K. 啤酒工艺实用技术[M]. 北京: 中国轻工业出版社,1998.
[4] 汪军妹, 杨建明, 沈秋泉, 等. 大麦β-淀粉酶的遗传和环境变异及其与麦芽品质的相关[J]. 大麦科学, 2004(4): 14-17.
[5] 王洪振, 王淑范. 吉啤2号大麦发芽过程中极限糊精酶变化规律的研究[J]. 吉林师范大学学报, 2005, 26(4): 6-7.
[6] McDOUGALL G J, ROSS H A, SWANSTON J S, et al. Limit dextrinase from germinating barley has endotransglycosylase activity, which explains its activation by maltodextrins[J]. Planta, 2004, 218(4): 542-551.
[7] STENHOLM K, HOME S. A new approach to limit dextrinase and its role in mashing[J]. Journal of the Institute of Brewing, 1999, 105(4):205-210.
[8] MYRBACK K. Enzymic degradation of starch and the structure of the starch macromolecule[J]. Journal for Prakische Chemical, 1943, 162:29-62.
[9] MCCLEARY B V. Measurement of the content of limit dextrinase in cereal flours[J]. Carbohydrate Research, 1992, 227: 257-268.
[10] GIBSON T S, SOLAH V, GLENNIE HOLMES M R, et al. Diastatic power in malted barley: Contributions of malt parameters to its development and the potential of barley grain beta-amylase to predict malt diastatic power[J]. Journal of the Institute of the Brewing, 1995, 101(2):277-280.
[11] MacGREGOR E A. The proteinaceous inhibitor of limit dextrinase in barley and malt[J]. Biochimi Biophys Acta, 2004, 1696(2): 165-170.
[12] ROSS H A, SUNGURTAS J, DUCREUX L, et al. Limit dextrinase in barley cultivars of differing malting quality: activity, inhibitors and limit dextrin profiles[J]. Journal of Cereal Science, 2003, 38(3): 325-334.
[13] 李芬, 朱筱娟, 王兴智. 啤酒大麦极限糊精酶的研究进展[J]. 东北师大学报: 自然科学版, 1998(4): 68-75.
[14] 王云飞, 王清路, 黄丹. 大麦芽中极限糊精酶活性测定条件的研究[J]. 中国酿造, 2008(18): 59-60.
[15] 闻年云. 啤酒糖化用α-淀粉酶活力的测定方法[J]. 广州食品工业科技, 1995(3): 35-37.
[16] 李雯, 邵远志, 陈维信. 淀粉酶活性测定方法的改进[J]. 植物生理学通讯, 2005(5): 655-656.
[17] 田亚平, 郭鸿飞, 肖光焰, 等. 一种麦芽β-淀粉酶的纯化和特性研究[J]. 食品工业科技, 2003, 24(9): 22-24.
Activity Determination and Characteristics of Malt Amylases
HE Yan-ke,HU Fei
(College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510640, China)
Q556
A
1002-6630(2010)15-0236-04
2010-04-25
广东省科技计划项目(2007A020100001-12)
何艳克(1986—),女,硕士研究生,主要从事谷物化学与工程研究。E-mail:yuanhang1014@163.com

