植酸及几种酚酸对牛奶蛋白体外消化率的影响
林海伟,赵阳阳,欧仕益,*,杜淑霞,2,黄才欢
(1.暨南大学食品科学与工程系,广东 广州 510632;2. 广东轻工职业技术学院食品与生物工程系,广东 广州 510300)
植酸及几种酚酸对牛奶蛋白体外消化率的影响
林海伟1,赵阳阳1,欧仕益1,*,杜淑霞1,2,黄才欢1
(1.暨南大学食品科学与工程系,广东 广州 510632;2. 广东轻工职业技术学院食品与生物工程系,广东 广州 510300)
研究植酸和几种酚类物质(阿魏酸、单宁、水杨酸、对-羟基苯甲酸)在常温和灭菌条件下(121℃,20min)对牛奶蛋白体外消化率的影响。结果表明:植酸和4种酚类物质均降低蛋白质消化率,降幅为5%~27%;反应后延长静置时间可进一步降低蛋白质消化率;增加胃蛋白酶浓度可使蛋白体外消化率提高1%~9%。
植酸;酚酸;牛奶蛋白;体外消化率
Abstract :Pure milk samples with separately added phytic acid and phenolic compounds such as ferulic acid, tannin, salicylic acid and p-hydroxybenzoic acid at different levels were subjected to standing at normal temperature for 1 h or sterilization at 121 ℃for 20 min followed by cooling to the normal temperature prior to pepsin hydrolysis in order to investigate the effects of phytic acid these phenolic compounds on the in vitro digestibility of milk proteins. The results indicated that all these compounds added alone resulted in a decrease in digestibility of milk proteins by 5%-27%. Prolonged length of standing time after cooling to the normal temperature (in the case of milk samples subjected to sterilization) resulted in a higher protein digestibility. Moreover,with increasing pepsin concentration, protein digestibility in vitro increase by 1%-9%.
Key words:phytic acid;phenolic acid;milk proteins;protein digestibility in vitro
大豆中富含酚类物质,目前已经分离出12种异黄酮,异黄酮总含量高达1.72%[1]。其他酚类物质有大豆单宁、对-羟基苯甲酸、水杨酸、阿魏酸、原花青素、槲皮素、杨梅素、绿原酸、对-香豆酸等[1-2]。Rawel等[3-4]通过对不同酚类及黄酮类与大豆蛋白和乳清蛋白的反应研究,发现这些酚类及其衍生物会导致蛋白中的赖氨酸、半胱氨酸、色氨酸明显降低,影响蛋白质的吸收。
植酸是大豆次生代谢产物,其含量高达17.9mg/g干质量[5]。由于植酸为含有6个磷酸基团的大分子化合物,会与矿物离子和蛋白质螯合,降低蛋白质消化率[6]。一些研究发现,植酸抑制蛋白酶对蛋白质的水解[7-8]。
本研究探讨酚类和植酸对牛奶蛋白消化率的影响,以期为目前市场上以大豆蛋白和牛奶蛋白为主体开发的“双蛋白奶”提供参考。
1 材料与方法
1.1 材料与试剂
纯牛奶 市售。
胃蛋白酶(10000NFU/mg) 广州市齐云生物技术有限公司;阿魏酸(纯度98%) 上海试剂一厂;植酸(水溶液,含量70%) 嘉善巨枫化工厂;单宁酸 天津市福晨化学试剂厂;对-羟基苯甲酸 国药集团化学试剂有限公司;水杨酸 天津市大茂化学试剂厂;其他所用试剂均为国产分析纯。
1.2 仪器与设备
YXQ手提式压力蒸汽灭菌器 上海华线医用核子仪器有限公司;HH-4恒温水浴锅 江苏金坛市宏体仪器厂;KDN-08A定氮仪、KDN-08消化炉 上海新嘉电子有限公司。
1.3 方法
1.3.1 植酸和几种酚类物质添加量对蛋白质体外消化率的影响
分别配制体积分数为1%植酸溶液和浓度为0.01mol/L的单宁、阿魏酸、水杨酸、对-羟基苯甲酸溶液。取50mL具塞试管,各加35mL纯牛奶,分别加入0、5、10、15mL上述酚类物质溶液和植酸溶液,用蒸馏水定容至50mL,在振荡器上充分混合,设置以下处理:1)在常温下静置反应1h;2)用蒸汽灭菌器在121℃反应20min,冷却。各取5mL反应液于50mL试管中,加入15mL 1mg/mL的胃蛋白酶溶液(活性10000NFU/mg,用0.1mol/L盐酸配制),摇匀,于37℃恒温水浴锅酶解2h,酶解后各加入15mL 质量分数为10%的三氯乙酸溶液终止反应,过滤,取滤液用半微量凯式定氮法测定蛋白质,按下式计算蛋白质的体外消化率[9],各处理重复3次。
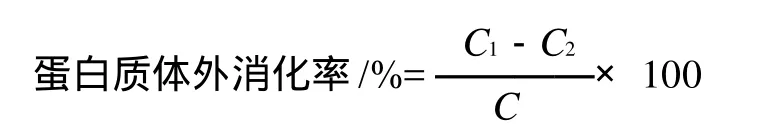
式中:C1为滤液中氮含量;C2为胃蛋白酶中氮含量;C为样品中氮含量。
1.3.2 不同胃蛋白酶质量浓度对反应液蛋白质体外消化率的影响
取1.3.1节植酸和酚类物质添加量分别为15mL的反应液5mL于50mL具塞试管中,分别加入1、2、4、6 mg/mL胃蛋白酶溶液15mL,按1.3.1节方法测定胃蛋白酶质量浓度对蛋白质的体外消化率。
1.3.3 反应后静置时间对蛋白质体外消化率的影响
选择1.3.1节植酸和酚类物质添加量分别为15mL的反应体系,冷却(对121℃反应),分别静置1、6、12、24h加1mg/mL胃蛋白酶溶液15mL,酶解后按1.3.1节方法测定蛋白质体外消化率。
1.4 统计分析
2 结果与分析
2.1 植酸和酚类物质添加量对牛奶蛋白体外消化率的影响
表1 常温下植酸和酚类物质添加量对牛奶蛋白体外消化率的影响(±s,n=3)Table 1 Effects of phytic acid and phenolic compounds added at varying amounts on the in vitro digestibility of unsterilized milk proteins (±s,n=3)

表1 常温下植酸和酚类物质添加量对牛奶蛋白体外消化率的影响(±s,n=3)Table 1 Effects of phytic acid and phenolic compounds added at varying amounts on the in vitro digestibility of unsterilized milk proteins (±s,n=3)
注:同列肩标字母不同,差异显著(P≤0.05)。下同。
添加量/mL 牛奶蛋白质体外消化率/%植酸 单宁 阿魏酸 水杨酸 对-羟基苯甲酸0 98.4±0.96d 95.6±0.61d 95.8±0.45d 93.0±0.74c 96.1±0.56d5 83.2±0.89a 86.6±0.95c 89.2±0.31c 87.5±0.70a 94.3±0.47c10 93.4±0.93c 84.2±0.80b 87.9±0.55b 89.9±0.82b 84.0±0.78a15 91.2±0.74b 79.5±0.55a 79.6±0.74a 88.7±0.74ab87.8±0.66b
由表1可以看出,常温下在牛奶中加入植酸和几种酚类物质都会显著降低牛乳蛋白消化率,且添加单宁和阿魏酸样品随着其添加量的增加而消化率降低;其余几种添加物中,蛋白质消化率降低程度不如单宁和阿魏酸明显。
表2 灭菌条件下(121℃,20min)植酸和酚类物质添加量对牛奶蛋白体外消化率的影响(±s,n=3)Table 2 Effect of phytic acid and phenolic compounds added at varying amounts on the in vitro digestibility of sterilized milk proteins(±s,n=3)
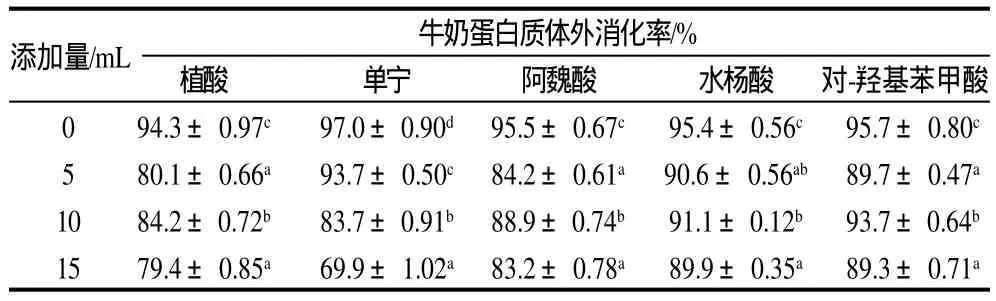
表2 灭菌条件下(121℃,20min)植酸和酚类物质添加量对牛奶蛋白体外消化率的影响(±s,n=3)Table 2 Effect of phytic acid and phenolic compounds added at varying amounts on the in vitro digestibility of sterilized milk proteins(±s,n=3)
添加量/mL 牛奶蛋白质体外消化率/%植酸 单宁 阿魏酸 水杨酸 对-羟基苯甲酸0 94.3±0.97c 97.0±0.90d 95.5±0.67c 95.4±0.56c 95.7±0.80c5 80.1±0.66a 93.7±0.50c 84.2±0.61a 90.6±0.56ab 89.7±0.47a10 84.2±0.72b 83.7±0.91b 88.9±0.74b 91.1±0.12b 93.7±0.64b15 79.4±0.85a 69.9±1.02a 83.2±0.78a 89.9±0.35a 89.3±0.71a
“双蛋白奶”加工过程中必须灭菌,因此实验设置了灭菌处理(121℃,20min)。由表2可知,灭菌后,添加植酸进一步降低牛奶蛋白质消化率。单宁在添加量较大(10、15mL)时消化率的降低比常温时降低更显著。水杨酸及对-羟基苯甲酸与常温时比均有提高消化率趋势。
2.2 不同胃蛋白酶质量浓度对反应液中蛋白质体外消化率的影响
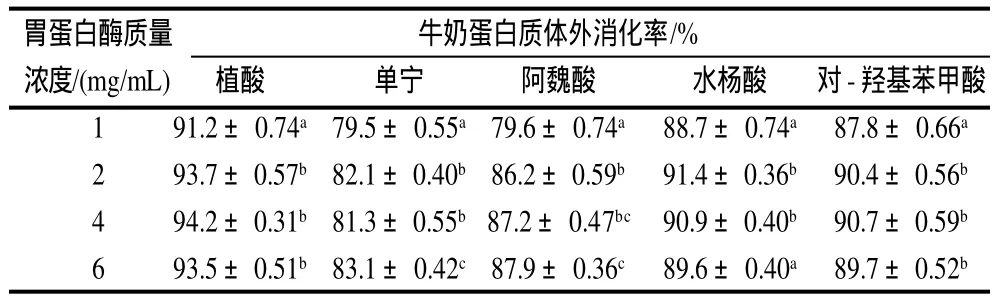
表3 常温下胃蛋白酶溶液质量浓度对牛奶蛋白体外消化率的影响Table 3 Effect of pepsin concentration on the in vitro digestibility of unsterilized milk proteins
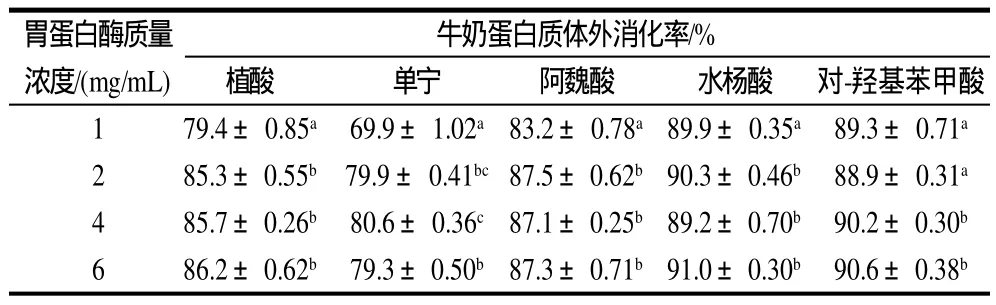
表4 灭菌条件下(121℃,20min)胃蛋白酶溶液质量浓度对牛奶蛋白体外消化率的影响Table 4 Effect of pepsin concentration on the in vitro digestibility of sterilized milk proteins
由表3、4可以看出,各样品的蛋白质消化率随胃蛋白酶溶液质量浓度增大均有所提高,常温下添加阿魏酸的样品消化率随其质量浓度增加显著提高,其他的略有提高;灭菌条件下添加植酸、单宁的样品消化率随胃蛋白酶液质量浓度增加有9.4%~10.7%的提高,水杨酸和对-羟基苯甲酸提高较少。在两个条件下,胃蛋白酶溶液质量浓度在2mg/mL及以上时,蛋白质消化率变化不大。但是整体相对未添加植酸和酚类物质消化率仍呈现降低趋势。
2.3 反应后静置时间对蛋白质体外消化率的影响

表5 常温下不同静置时间对牛奶蛋白体外消化率的影响Table 5 Effect of length of standing time on the in vitro digestibility of unsterilized milk proteins
由表5、6可以看出,两种条件下蛋白质的消化率随时间的延长逐步减小,但是减小幅度不大,在1.3%~3.6%之间,而且12h以后消化率基本稳定。在灭菌条件下静置时间的延长对蛋白质的消化率影响不大,应是在灭菌时植酸及酚类物质与蛋白质的互作已经基本完成。
2.4 植酸和酚类抑制蛋白质消化的机理探讨
植酸抑制蛋白质消化的机理可能是:植酸螯合的二价金属离子与蛋白质之间形成“桥梁”,从而使蛋白质聚合而难于被酶作用,并依据同样机理而使酶蛋白活性下降[6,8]。
在蛋白质酶解过程中,酚类不仅与被降解蛋白发生互作,也与酶互作从而降低蛋白酶活性。Kroll等[10]研究发现,加入0.28mmol/g蛋白质的绿原酸可使胰蛋白酶、胃蛋白酶和菠萝蛋白酶的活性分别降低60%、40%和80%。因此,食用酚类与蛋白质互作物后,蛋白质的生物效价将显著降低。

图1 蛋白质中赖氨酸与酚类及其氧化物醌的反应模式[11]Fig.1 Reaction pathways of phenolic compounds or quinone with lysine in proteins
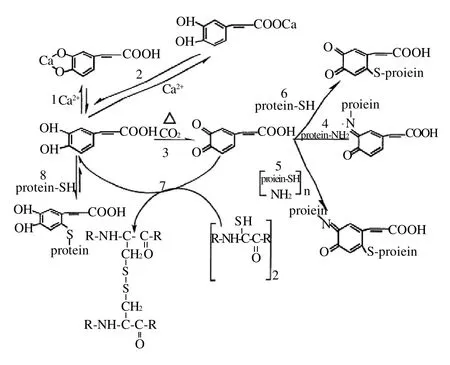
图2 蛋白质中半胱氨酸与酚类反应模式[10,12]Fig.2 Reaction pathways of phenolic compounds with cysteine in proteins
酚类物质可能依据以下机理降低蛋白质消化率。一是通过氢键与蛋白质结合,从而阻止酶解,如单宁与蛋白质作用产生沉淀;二是与蛋白质中的赖氨酸和半胱氨酸反应使蛋白质交联(图1、2),产生新的共价键而难于酶解。加热条件下酚类更易氧化成醌,因此蛋白质交联更严重,消化率也降低。
3 结 论
植酸、阿魏酸、单宁酸、水杨酸、对-羟基苯甲酸与牛奶蛋白在常温和灭菌条件下反应均降低牛奶蛋白体外消化率,降低程度随上述物质的添加量和反应温度的增加而增加,整体降幅为5%~27%;反应后延长静置时间会进一步降低牛奶蛋白质的消化率;增加胃蛋白酶质量浓度可使其消化率恢复1%~9%。
[1] SAKTHIVELU G, AKITHA M K, GIRIDAR P. Isoflavone composition,phenol content, and antioxidant activity of soybean seeds from India and Bulgaria[J]. Journal of Agricultural and Food Chemistry, 2008, 56:2090-2095.
[2] KIM E H, KIM S H, CHUNG J I, et al. Analysis of phenolic compounds and isoflavones in soybean seeds (Glycine max Merill) and sprouts grown under different conditions[J]. European Food Research and Technology, 2006, 222: 201-208.
[3] RAWEL H M, CZAJKA D, ROHN S K, et al. Interaction of different phenolic acids and flavonoids with soy proteins[J]. Biological Macromolecules, 2002, 30: 137-150.
[4] RAWEL H M, KROLL J , HOHL C, et al. Model studies on reactions of plant phenols with whey proteins[J]. Nahrung/Food, 2001, 45(2): 72-81.
[5] 张酶申, 沈爱光, 熊晓辉, 等. 酶对大豆中植酸降解作用的研究[J].大豆科学, 1999, 18(3): 269-272.
[6] DURANTI M, GIUS C. Legume seeds: protein content and nutritional value[J]. Field Crops Research, 1997, 53: 31-45.
[7] DUODUA K G, TAYLORA J R N, BELTONB P S, et al. Factors affecting sorghum protein digestibility[J]. Journal of Cereal Science,2003, 38: 117-131.
[8] TARADE K M, SINGHAL R S, JAYRAM R V, et al. Kinetics of degradation of saponins in soybean flour during food processing[J].Journal of Food Engineering, 2006, 76: 440-445.
[9] EIKHALIL E A I, El TINAY A H, MOHAMED B E, et al. Effect of malt pretreatment on phytic acid and in vitro protein digestibility of sorghum flour[J]. Food Chemistry, 2001, 72: 29-32.
[10] KROLL J, RAWEL H M, ROHN S. Reactions of plant phenolics with food proteins and enzymes under special consideration of covalent bonds[J]. Food Science and Technonology Research, 2003, 9(3): 205-218.
[11] 欧仕益. 大豆非蛋白成分与蛋白质的互作[J]. 中国乳品工业, 2010,38(1): 48-50.
[12] OU S Y, KWOK K C, KANG Y J. Changes in in vitro digestibility and reactive lysine of soy protein isolate after formation of film[J]. Journal of Food Engineering, 2004, 64(3): 301-307.
Effects of Phytic Acid and Phenolic Compounds on the in vitro Digestibility of Milk Proteins
LIN Hai-wei1,ZHAO Yang-yang1,OU Shi-yi1,*,DU Shu-xia1,2,HUANG Cai-huan1
(1. Department of Food Science and Engineering, Jinan University, Guangzhou 510632, China;2. Department of Food Bioengineering, Guangdong Industry Technical College, Guangzhou 510300, China)
Q946.81;TS252.1
A
1002-6630(2010)15-0087-04
2009-12-27
林海伟(1985—),男,硕士研究生,研究方向为植物蛋白及生物能源。E-mail:linhw1985@126.com
*通信作者:欧仕益(1963—),男,教授,博士,研究方向为食品化学及功能性食品。E-mail:tosy@jnu.edu.cn
——“单宁”

