高效阴离子交换色谱-脉冲安培检测食品中糖的应用进展
李仁勇,梁立娜,牟世芬
1(中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室,北京,100085)
2(戴安中国有限公司应用研究中心,北京,100085)
高效阴离子交换色谱-脉冲安培检测食品中糖的应用进展
李仁勇1,2,梁立娜1,2,牟世芬1
1(中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室,北京,100085)
2(戴安中国有限公司应用研究中心,北京,100085)
高效阴离子交换色谱-脉冲安培检测法(HPAEC-PAD)测定糖具有灵敏度高,分离效果好,无需衍生等优势,是糖类分析技术的一次重要技术革新。文中重点讨论了近十几年来该检测技术在分析食品中糖方面的应用进展。
高效阴离子交换色谱,脉冲安培检测,食品,糖
糖类物质是一类多羟基醛类或酮类化合物及其衍生物或聚合物,是自然界中分布极为广泛的一类有机化合物,是生命体维持生命活动所需能量的主要来源。糖类化合物还参与许多生命活动,具有调节神经功能和促进代谢等作用。按其结构单元的不同,可分为单糖、低聚糖、多糖、糖系衍生物(典型如糖醇、糖胺、糖醛酸、磷酸化糖等)和结合糖。不同种类的糖的功能不尽相同,因而准确测定食品中各种糖含量很重要。
采用高效阴离子交换色谱-脉冲安培检测法(high performance anion exchange chromatographypulsed amperometric detection,HPAEC-PAD)测定糖类,是糖类分析技术的一次飞跃,该技术自20世纪80年代出现并发展至今已趋于成熟。HPAEC-PAD分析糖,具有样品前处理简单,无需衍生,灵敏度高,线性范围宽,无需有机溶剂,分离柱效高等优势,可用于各种食品中的单糖、低聚糖、多糖(单体聚合度<80)、糖醇、糖胺、糖醛酸及一些其他糖类衍生物的直接分析。随着美国分析家协会(American Organization of Analytical Chemists,AOAC)自1995年以来先后颁布了《AOAC 995.13-速溶咖啡中的糖》,《AOAC 996.04-甘蔗和甜菜糖蜜中的糖》,《AOAC 997.08-食品中的果聚糖》,《AOAC 2000.11-食品中的葡聚糖》,《AOAC 2000.17-粗蔗糖中痕量葡萄糖和果糖的测定》和《AOAC 2001.02-特定食品中反式低聚半乳糖的测定》6项食品行业相关的标准方法之后,HPAEC-PAD逐步成为糖检测的首选方法,在国内外食品行业中得到了广泛的应用。
1 基本原理
常见糖类物质在水中的pKa值见表1。由表1可知,常见单、双糖和糖醇的pKa值一般在l2~14,常见糖醛酸和糖胺的pKa都小于7。当所处碱性溶液的pH值≥l2时,大多数糖类化台物均能部分或全部以阴离子的形式存在,因而可以采用阴离子交换色谱柱,以强碱性溶液为淋洗液进行分离。由于糖分子结构中还存在疏水部分,因而糖的分离机理除阴离子交换外,还有疏水性吸附作用。糖类化合物在阴离子交换分离柱上的保留能力主要取决于糖类化合物所带的电荷数、分子大小、组成和结构[1]。
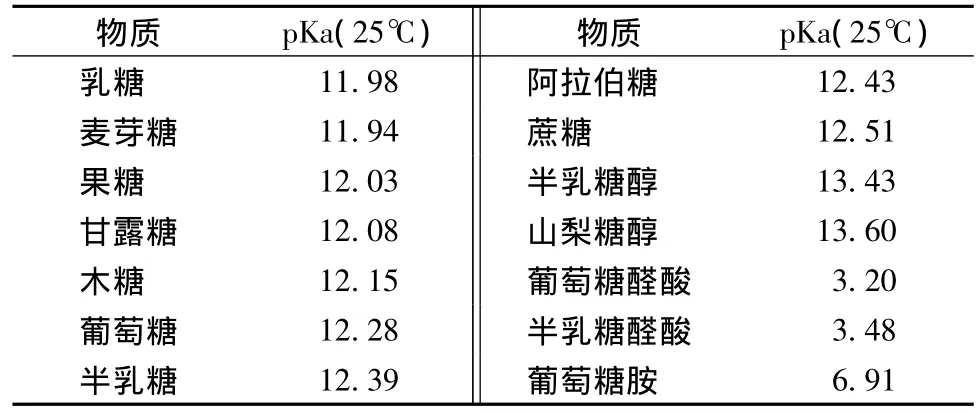
表1 常见糖类化合物在水中(25℃时)的电离常数
安培检测是通过测量电化学活性物质在适当的施加电位下发生氧化或还原反应时所产生的电流变化从而测定该物质的一种检测技术。糖的分离是在碱性条件下完成,而金电极的检测条件通常为碱性,且金电极表面还可为糖的电化学氧化反应提供反应环境,因而金电极检测和阴离子交换分离相互间具有良好的匹配性。由于糖的氧化反应产物会覆盖在电极表面产生不可逆的污染,因而需选择不同的施加电位对电极表面进行清洗与活化,使电极能够连续工作,即为脉冲安培检测。对糖类化合物的测定,早期多使用三电位波形。但长期使用发现在该电位波形下,电极表面容易腐蚀,且重现性较差[1]。Rocklin等[2]于1998年提出了新的四电位波形,大大提高了电极的使用寿命和长期稳定性,使得糖检测技术又向前迈进一大步。
2 应用进展
2.1 单糖和双糖分析
蜂蜜是最常见的天然滋补食品之一,其各种糖分含量是影响蜂蜜质量的重要因素。欧盟、美国和日本对进口蜂蜜中葡萄糖、果糖、蔗糖含量都有要求,对蔗糖含量的要求尤为严格。崔鹤等[3]对离子色谱-脉冲安培检测蜂蜜中葡萄糖、果糖、蔗糖的方法进行了研究,采用CarboPac PA1分离柱和脉冲安培检测器,50 mol/L NaOH作淋洗液可使蜂蜜中的葡萄糖、果糖、蔗糖得到较好分离和检测。由于利益的驱使,蜂蜜的掺假现象层出不穷,近年来又出现了常规方法很难判别的植物源性糖浆掺假。Christophe等[4]建立了一套判别蜂蜜糖浆掺假的方法,利用阴离子交换-脉冲安培检测分析不同批次和不同程度添加糖浆的蜂蜜样品中蔗糖和麦芽糖的增减情况,并通过线性判别分析和偏最小二乘法统计最终判别未知样品的掺假情况。实验中还发现,任何以淀粉糖浆喂养蜜蜂得到的蜂蜜也可以根据此法判别出掺假。
侯玉柱等[5]使用HPAEC-PAD测定了糕点中水溶性半乳糖、葡萄糖、木糖、果糖、蔗糖、乳糖和麦芽糖。以水浸提、经过脱脂、除蛋白和膜过滤处理糕点样品,以NaOH溶液梯度淋洗程序在CarboPac PA10阴离子交换柱上分离待测7种糖,对于萨其玛、饼干、面包、蛋糕、酥饼等样品均具有较好的适用性。该方法目前已被引入到标准方法《GB/T 23780-2009糕点质量检验方法》中作为单、双糖测定的第二推荐方法。
牛奶的加热或者储藏过久会引起组分的变化,从而影响它的营养价值,甚至造成奶制品变质。乳果糖是乳糖在牛奶热处理过程中的异构化产物,其含量测定被国际奶制品组织建议作为评价产品是巴氏法灭菌,超热处理和已灭菌的指示剂,能否分离乳果糖和乳糖并准确测定乳果糖的含量极为关键。曾文芳等[6]以5 mmol/L NaOH+1 mmol/L醋酸钠在CarboPac PA1色谱柱上等度淋洗成功地对牛奶中的乳糖和乳果糖进行测定,结果表明该方法具有良好的重现性、线性关系和加标回收率,以及较低的检测限。
婴儿配方奶粉的假冒事件常有发生,Lisa等[7]提出,以离子色谱法测定乳基、豆基和蛋白水解液配方的婴儿配方食品中的葡萄糖、果糖、蔗糖、乳糖和麦芽糖,找到不同配方食品中糖含量存在的明显特征,以作为企业控制产品质量的依据。
此外,食品中的不同种类糖的含量还可以作为贮藏时间的依据,例如Cristina等[8]研究了白兰地在贮藏过程中葡萄糖、果糖、阿拉伯糖、乳糖和木糖的浓度变化,通过检测白兰地样品中这些糖类尤其是阿拉伯糖的含量来估算酒的保存时间,准确率高达80%以上。
2.2 低聚糖分析
天然低聚果糖广泛分布于多种蔬菜和水果中,Homme[9]等研究了CarboPac PA100色谱柱分离脉冲安培检测蔗果二糖、蔗果三糖、蔗果四糖、菊粉二糖和菊粉三糖的方法,并通过此方法用于测定新鲜的苹果、梨、李子和香蕉以及烩干果中低聚果糖的含量,发现这些水果中均不含有菊粉三糖和蔗果四糖。Max Feinberg等[10]则利用HPAEC-PAD确定不同加工食品中的蔗果二糖、蔗果三糖、蔗果四糖和三氯蔗糖的糖特性,从而更好对食品加工过程和质量进行严格控制。
啤酒生产原料中的麦汁含有丰富的糖类物质尤其是低聚麦芽糖,通过工艺调节控制麦汁中糖的组成可生产出多种风味和口感丰富的啤酒产品。潘媛媛等[11]建立的HPAEC-PAD同时测定单糖和低聚麦芽糖等11种糖的方法,可应用于啤酒和麦汁样品的糖组分测定。该方法前处理简单,检测灵敏度高。
低聚半乳糖是一种天然存在于动物乳汁中的低聚糖,尤以母乳中含量高,除具有常见低聚糖的功能外,低聚半乳糖具有可被双歧杆菌发酵的特性,因而可显著增殖双歧杆菌,有效抑制有害病原菌和腐败菌。Cristina等[12]检测了多种市售发酵酸奶中的3-半乳二糖、6'-半乳糖基乳糖、3-半乳糖基葡萄糖和3'-半乳糖基乳糖。结果发现,含有双歧杆菌的酸奶中低聚半乳糖的含量高于含有干酪乳杆菌的即饮酸奶,但均高于不含杆菌的酸奶。此外,低聚半乳糖在4℃保存下含量变化不大,因而其含量可反应产品的来源性信息,这将有助于溯源了解生产条件的差异,并最终起到优化生产工艺提高产品功能性的作用。
大豆低聚糖是大豆中可溶寡糖的总称,主要由棉子糖、水苏糖、蔗糖等组成。此外大豆制品中还含有少量的葡萄糖、果糖和半乳糖等。准确测定大豆及大豆制品中糖的组和含量已成为评价大豆及其产品营养价值、科学选种以及大豆制品生产工艺监控等必须解决的问题。李仁勇等[13]建立了测定豆腐水中常见的3种单糖,以及蔗糖、蜜二糖、棉子糖和水苏糖等大豆低聚糖的方法。以NaOH淋洗液梯度淋洗,7种糖在CarboPac PA 10高效阴离子交换柱上在30 min内完成分离,适用于大豆及大豆制品中常见糖组分的分析。
不同来源样品中低聚糖含量和种类会存在差异,测定低聚糖含量可以为外源性掺假提供证据,近年来公布执行的《GB/T 21533-2008蜂蜜中掺假淀粉糖浆的测定——离子色谱法》就是采用类似方法。由于蜂蜜中不含5糖以上的寡糖,而淀粉糖浆则均含5糖以上的低聚糖,在经过凝胶体积排阻法去除样品中果糖、葡萄糖,将寡糖富集后直接经阴离子交换色谱-电化学检测器检测,5糖以上低聚糖的存在可作为蜂蜜中淀粉糖浆的判定指标。若样品在麦芽五糖和麦芽六糖色谱峰之间、麦芽六糖和麦芽七糖色谱峰之间有2个典型的“指纹峰簇”P1和P2,则可由此判断蜂蜜中掺入果葡糖浆。而若掺入麦芽糖浆,在麦芽五糖~麦芽六糖、麦芽六糖~麦芽七糖以及麦芽七糖之后则存在3个典型的“指纹峰簇”P1、P2和P3[14]。
2.3 多糖分析
由于脉冲安培检测法是利用糖在电极表面的氧化还原反应直接检测,无需衍生且具有极高的灵敏度,给常规检测器上响应很低的多糖分析提供了一个好工具,不断改进的高效离子交换柱技术已使得聚合度小于80的多糖组成的直接分析成为可能。Kristine等[15]利用Bio-Gel P-6凝胶柱将多糖组分分成不同的聚合度片段分别测定以确定多糖的分子质量组成,并研究了聚合度在3~65的麦芽多糖在安培检测器上的响应情况,方法应用于糯玉米淀粉、小麦粉、马铃薯和扁豆样品中支链淀粉的测定。Haska等[16]则研究了不同品种和产地的小麦粉中的果聚糖情况,通过HPAEC-PAD确定样品中果聚糖的分子质量分布,并发现不同组分的果聚糖聚合度基本不超过19,且不同分子质量的分布情况也类似。
对于聚合度更高的多糖,更多会通过适当的酶水解或者酸水解手段将多糖分解为单体结构后再检测。Anis等[17]研究了3种酿酒葡萄和2种苹果的果皮中的多糖含量,通过合适的酸水解步骤将果皮多糖转化为一系列单糖和糖醛酸,并由此反推得到果皮中的各种多糖的组成情况。大蒜多糖具有抗氧化、抗病毒等保健作用,欧云付等[18]将大蒜多糖水解为单糖后,在AminoPac PA10阴离子交换色谱柱上,以NaOH溶液淋洗,脉冲安培检测器检测了鼠李糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖、果糖的含量。实验结果表明,大蒜多糖主要由果糖和葡萄糖组成,此外还有少部分半乳糖、甘露醇。
羊栖菜为多年生大型海藻,目前在我国南方海区已经大量人工养殖,是重要的出口创汇海藻资源。近年研究表明,羊栖菜多糖具有调节机体免疫、抗肿瘤、抗氧化、降血脂等作用。王培培等[19]采用高效离子色谱法分析褐藻糖胶中单糖组成,其主要含有岩藻糖,半乳糖,甘露糖,葡萄糖醛酸,葡萄糖,木糖,葡萄糖胺和甘露糖醛酸。实验发现选育羊栖菜褐藻胶中古罗糖醛酸、葡萄糖、甘露糖和氨基葡萄糖含量均明显高于野生羊栖菜,从而为羊栖菜多糖资源的开发利用提供参考。
2.4 糖醇、糖胺及其他糖类衍生物分析
糖醇是一种多元醇,由糖分子上的醛基或酮基还原成羟基而成。因其具有不产生龋齿、对血糖值上升无影响,且能为糖尿病人提供一定热量,所以作为营养性甜味剂,广泛应用于无糖食品行业中。唐坤甜等[20]建立了同时分析无糖食品中的糖和糖醇的HPAEC-PAD方法,检测了14种无糖食品和低糖食品中的丙二醇、肌醇、甘油、木糖醇、山梨醇、甘露醇、半乳糖醇、葡萄糖、果糖、蔗糖和麦芽糖等12种糖,借以有效控制无糖食品的质量,规范无糖食品市场。通过CarboPac MA1与CarboPac PA10两种色谱柱的对照实验,验证了方法的准确性和可靠性。
二糖醇如麦芽糖醇,异麦芽糖醇和乳糖醇具有负热量、低吸湿性,高稳定性和良好的膨胀性等特点,越来越多的用于食品工业。Tommaso等[21]研究了麦芽糖醇、异麦芽糖醇、乳糖醇,以及其他常见糖类在CarboPac PA 100色谱柱上的同时测定方法,使用40 mmol/L NaOH和1 mmol/L醋酸钡为流动相,脉冲安培法检测。加入醋酸钡化学消除淋洗液中碳酸根,以期获得满意的重现性,并有效改善分离和峰形灵敏度。另外由于等度淋洗且无需柱再生,在此条件下样品分析时间可控制在25 min内。方法能够适用于太妃糖果、饼干、巧克力等十几种食品的二糖醇测定。
Tommaso等[22]开 发 了12 mmol/L NaOH和1 mmol/L醋酸钡等度分离洗脱肌醇、半乳糖醇、甘露醇、半乳糖、葡萄糖、果糖、蔗糖、棉子糖和水苏糖的色谱条件,并成功应用于橄榄根和叶的纯水提取物中水溶性糖类化合物的分析。该方法的创新之处在于,在短短25 min内等度分离了肌醇、糖醇、常见单糖、双糖以及三糖(棉子糖)和四糖(水苏糖)。
糖胺是糖的羟基为氨基所取代的一类化合物的总称,常见的主要是葡萄糖胺。葡萄糖胺为组成关节软骨的主要营养成分,具有促进形成关节软骨组织,预防关节炎发生的作用,常添加在有益于关节健康的膳食中。张思维等[23]以AminoPac PA 10阴离子交换色谱柱分离,金电极脉冲安培检测了葡萄糖胺。所建立的方法的线性范围宽,检出限达0.01 mg/L,而与其共存的糖类对葡萄糖胺的测定基本不存在干扰,可适合于各种保健食品中葡萄糖胺的准确分析。
唾液酸是一种存在于高等动物体内的氨基九碳糖,在多方面起到重要的生理功能,例如母乳中唾液酸成分能帮助婴儿抵抗肠道感染并促进智力发育。唐坤甜等[24]建立了阴离子交换色谱分离-脉冲安培检测测定牛乳及制品中2种常见唾液酸N-乙酰神经氨酸和N-羟乙酰神经氨酸的方法。实验中利用优化的酸水解法将唾液酸从低聚糖和糖蛋白中释放出来,并以 CarboPac PA20阴离子交换柱作分离柱,在NaOH和醋酸钠淋洗液梯度淋洗下20 min内可完成分析。此方法被应用于15种牛乳和牛乳制品的唾液酸分析中。
三氯蔗糖是一种蔗糖的氯代产物,是近年来兴起的一种添加于食品饮料中的非营养性甜味剂。VALORAN等[25]结合了高效阴离子交换和脉冲安培检测器这两种产品,开发了10min等度分离三氯蔗糖的测定条件,并应用于一种添加人造甜味剂三氯蔗糖的红树莓软饮料中三氯蔗糖的分析。若要同时分析样品中的其他糖类,则需要使用时间稍长的梯度条件分离。
3 结论
经过20多年的发展,HPAEC-PAD检测糖类化合物的分析检测技术已经趋于成熟和完善,可用于各种食品中的单糖、低聚糖、多糖、糖醇、糖胺、糖醛酸以及其他糖类衍生物的分析。相对于传统的检测手段,HPAEC-PAD法具有无需衍生,高灵敏度,线性范围宽,色谱柱分离高效等特点。伴随着离子色谱仪的普及,会越来越多地应用于食品中各种糖的分析,并且在相关糖类检测的国家标准方法制订中有所体现。
此外,HPAEC-PAD法检测糖成分时因为灵敏度高而不会丢失低含量糖组分的信息,研究低聚糖和多糖组成时信息更为全面。食品中的低聚糖分析,植物、动物和真菌多糖的分子量分布和结构研究近期还将是发展重点,而这些研究很可能会进一步借助离子色谱与质谱的联用技术更好地对这些糖进行定性和定量。
伴随着分离度更优的色谱柱乃至毛细管柱、整体柱等的研究,稳定、可靠的新型脉冲安培检测器和新型电极材料的研制,高效阴离子交换色谱-脉冲安培检测糖分析技术具有更为广阔的应用空间。
[1]牟世芬,于泓,蔡亚岐.糖的高效阴离子交换色谱-脉冲安培检测法分析[J].色谱,2009,27(5):667-674.
[2]Roy D Rocklin,Alan P Clarke,Michael Weitzhandler.Improved long-term reproducibility for pulsed amperometric detection of carbohydrates via a new quadruple-potential waveform[J].Anal Chem,1998,70:1496-1501.
[3]崔鹤,李戈,纪雷,等.离子色谱脉冲安培法测定蜂蜜中的葡萄糖、果糖、蔗糖[J].化学分析计量,2001,10(1):25-26.
[4]Christophe Cordella,Julio S L T.Militao,Marie-Claude Clement,et al.Detection and quantification of honey adulteration via direct incorporation of sugar syrups or beefeeding:preliminary study using high-performance anion exchange chromatography with pulsed amperometric detection(HPAEC-PAD)and chemometrics[J].Analytica Chimica Acta,2005,531:239-248.
[5]侯玉柱,元晓梅,蒋明蔚,等.离子色谱法测定糕点中的单、双糖的研究[J].食品与发酵工业,2009,35(2):134-137.
[6]曾文芳,时巧翠,陈永欣,等.离子色谱电化学测定牛奶中的乳糖和乳果糖[J].食品科学,2006,27(5):205-207.
[7]Lisa A Kaine,Karen A Wolnik.Detection of counterfeit and relabeled infant formulas by high-pH anion-exchange chromatography-pulsed amperometric detection for the determination of sugar profiles[J].Journal of Chromatography A,1998,804:279-287.
[8]Cristina Martiänez Montero,M Del Carmen Rodriäguez Podero,Dominico Antonio Guileän Saä Nchez,et al.Sugar contents of brandy de jerez during its aging [J]J.Agric Food Chem,2005,53:1058-1064.
[9]L'homme C,Peschet J L,Puigserver A,et al.Evaluation of fructans in various fresh and stewed fruits by high-performance anion-exchange chromatography with pulsed amperometric detection[J].Journal of Chromatography A,2001,920:291-297.
[10]Max Feinberg,Jinadevi San-Redon,Audrey Assié.Determination of complex polysaccharides by HPAE-PAD in foods:Validation using accuracy profile[J].Journal of Chromatography B,2009,877:2388-2395.
[11]潘媛媛,梁立娜,蔡亚岐,等.高效阴离子交换色谱-脉冲安培检测法分析啤酒和麦汁中的糖[J].色谱,2008,26(5):626-630.
[12]Cristina Martinez-Villaluenga,Alejandra Cardelle-Cobas,Nieves Corzo,et al.Study of galactooligosaccharide composition in commercial fermented milks[J].Journal of Food Composition and Analysis,2008,21:540-544.
[13]李仁勇,梁立娜,牟世芬,等.离子色谱一脉冲安培检测白醋和豆腐水中单糖和大豆低聚糖[J].分析化学,2009,37(5):725-728.
[14]GB/T 21533-2008.蜂蜜中掺假淀粉糖浆的测定-离子色谱法[S].
[15]Kristine Koch,Roger Andersson,Per Aman.Quantitative analysis of amylopectin unit chains by means of high performance anion-exchange chromatography with pulsed amperometric detection[J].Journal of Chromatography A,1998,800:199-206.
[16]Haska L,Nymana M,Andersson R.Distribution and characterisation of fructan in wheat milling fractions[J].Journal of Cereal Science,2008,48:768-774.
[17]Anis Arnous,Anne S Meyer.Quantitative prediction of cell wall polysaccharide composition in grape(Vitis vinifera L.)and apple(Malus domestica)skins from acid hydrolysis monosaccharide profiles[J].J Agric Food Chem,2009,57:3611-3619.
[18]欧云付,尹平河,赵玲,等.离子色谱法测定大蒜中的糖[J].光谱实验室,2006,23(3):629-632.
[19]王培培,于广利,杨波,等.选育羊栖菜与野生羊栖菜中褐藻胶与褐藻糖胶组成分析[J].中国海洋药物杂志,2009,28(3):39-43.
[20]唐坤甜,林立,梁立娜,等.无糖和低糖食品中的糖和糖醇同时分析的阴离子交换色谱一脉冲安培检测法研究[J].食品科学,2008,29(6):327-331.
[21]Tommaso R I Cataldi,Cristiana Campa,Innocenzo G Casella,et al.Determination of maltitol,isomaltitol,and lactitol by high-pH anion-exchange chromatography with pulsed amperometric detection[J].J Agric Food Chem,1999,47:157-163.
[22]Tommaso R I Cataldi,Giovanna Margiotta,Lucia Iasi,et al.Determination of sugar compounds in olive plant extracts by anion-exchange chromatography with pulsed amperometric detection[J].Anal Chem,2000,72:3902-3907.
[23]张思维,郑波,邹晓莉.高效阴离子色谱法测定保健食品中的盐酸氨基葡萄糖[J].色谱,2009,27(1):117-119.
[24]唐坤甜,梁立娜,蔡亚岐,等.高效阴离子交换色谱-脉冲安培检测法测定牛乳及制品中的唾液酸[J].分析化学,2008,36(11):1535-1538.
[25]Valoran P Hanko,Jeffrey S Rohrer.Determination of sucralose in splenda and a sugar-free beverage using high-performance anion-exchange chromatography with pulsed amperometric detection[J].J Agric Food Chem,2004,52:4375-4379.
ABSTRACTDetermination of carbohydrates with High Performance Anion Echange Chromatography-Pulsed Amperometric Detection(HPAEC-PAD)is a important technological innovation to carbohydrates analysis techniques for its high sensitivity,good separation,no derivatization and other advantages.This article focused on the advance in the application for over a decade in food carbohydrates analysis with this method.
Key wordshigh performance anion exchange chromatography,pulsed amperometric detection,food,carbohydrates
Application Advance in Analysis of Food Carbohydrates with High Performance Anion Exchange Chromatography-pulsed Amperometric Detection
Li Ren-yong1,2,Liang Li-na1,2,Mou Shi-fen1
1(State Key Laboratory of Environmental Chemistry and Ecotoxicology,Research Center for Eco-Environmental Sciences,Chinese Academy of Sciences,Beijing 100085,China)
2(Application Research Center,Dionex China,Beijing 100085,China)
硕士,助理工程师。
2010-06-29,改回日期:2010-07-01

