影响重组CHO C28细胞HBsAg表达的重要因素
高连胜 李 阳
1 材料与方法
1.1 实验材料
DMEM培养基根据研究结果筛选后,选用了部分进口产品和国产产品相结合的方法进行,而小牛血清则全部选用国产产品。利用自制蒸馏水,在配制DMEM基础液前再使用0.1um滤器进行过滤。
1.2 实验条件及方法
实验组将一支P26代CHO-C28细胞种子传出来的90个单层转瓶细胞按每组15瓶分成六个实验组,即A组、B组、C组、D组、E组、F组(分组见表1)。
将每个单层瓶的细胞传入1个三层转瓶中,细胞生长液PH控制在6.8~7.4之间,细胞培养温度为37℃恒温,转机转速为8转/h,培养48 h后,更换1次细胞生长液。
维持上述细胞培养条件,三层转瓶细胞培养48小时后,将细胞生长液更换为细胞维持液。细胞维持液PH控制在6.8~7.4之间,细胞培养温度为37℃,细胞培养转机转速提高到15转/ h,细胞培养时间为48 h,收取细胞培养液。按此条件共收取20次维持液。每次收取维持液后,抽取样品作血凝滴度试验,检测每组HBsAg表达量(具体结果见表3)。
2 结果与分析
2.1 结果
2.1.1 生长液阶段细胞培养
CHO C28细胞经单层培养瓶一传一,传入三层培养瓶中,使用生长液细胞培养8 h后,镜下观察细胞贴壁生长情况。其中,A组、C组、D组和F组细胞贴壁率可达85%,B组和E组细胞贴壁率约为80%。各组细胞形态以圆形、椭圆形为主,细胞排列松散,可见梭形细胞生长。
生长液细胞培养24 h后,镜下观察细胞贴壁生长情况。A组、C组、D组和F组细胞贴壁率可达95%以上,细胞排列紧密,梭形细胞均在80%以上。其中,A组和D组细胞生长情况更为良好,梭形细胞约占85%左右。B组和E组细胞贴壁率为90%左右,细胞排列较紧密,梭形细胞占在70%左右。
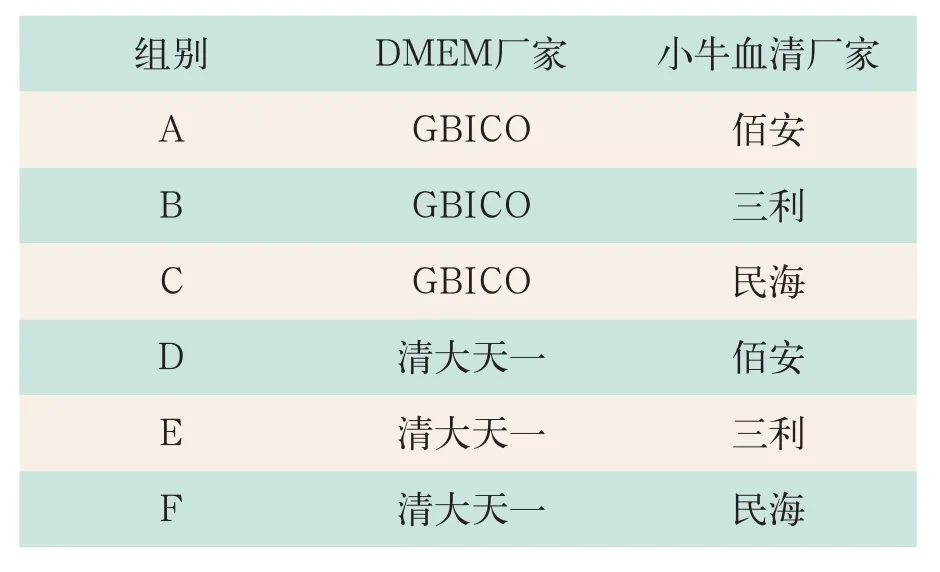
表1 CHO-C28细胞培养实验组的分组情况
各组细胞通过不同培养液的培养后,A组、C组、D组和F组细胞生长贴壁情况、细胞形态、细胞生长速度等指标较好于B、E组的细胞(结果见表2)。
2.1.2 维持液阶段细胞培养
细胞培养进入维持液阶段后,各组细胞均出现脱落现象,镜下观察细胞贴壁生长情况。其中,A组、C组、D组和F组细胞贴壁紧密,细胞成片脱落现象较轻。B组和E组细胞排列较紧密,细胞成片脱落现象严重。对各组作血凝滴度实验测定HBsAg表达量(结果见表3)。
2.2 分析
由于六个实验组的细胞是来源于一支细胞种子,且最初分组时各组细胞生长情况基本相同,同时在配制各组培养液时除成分不同,其他的条件均保证相同。因此,我们可以认定是细胞培养液中血清质量造成细胞生长培养过程中出现上述现象。细胞维持液阶段的生长状态与收取20次维持液的血凝滴度表明A、C、D、F组细胞脱落现象较轻,收取的细胞培养液中抗原表达量较高。其中发现进口DMEM与国产DMEM在细胞培养过程中,质量表现均非常稳定。但从生产成本上考虑,选择国内某公司提供的DMEM作为C28细胞的基础培养基。全部由国内厂家提供的小牛血清在细胞生长液和维持液阶段表现都很稳定,两种血清质量差异不明显,能保证我们CHO-C28细胞的正常生长。
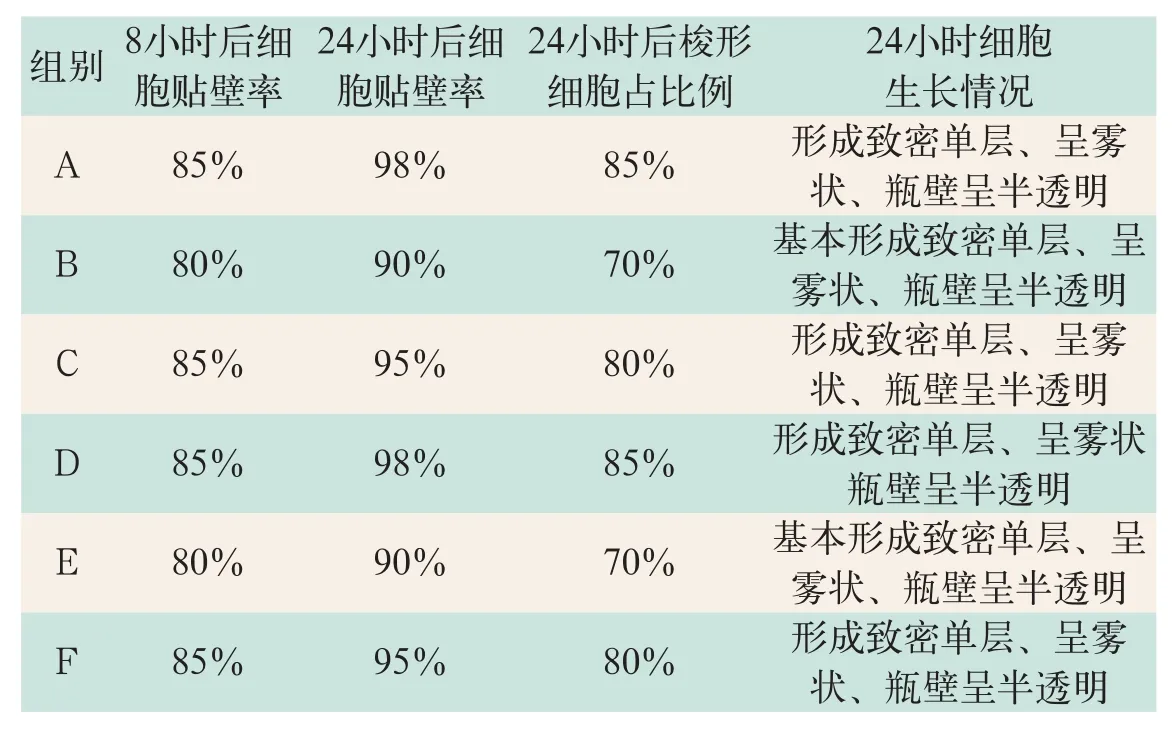
表2 生长液阶段CHO-C28细胞培养实验结果
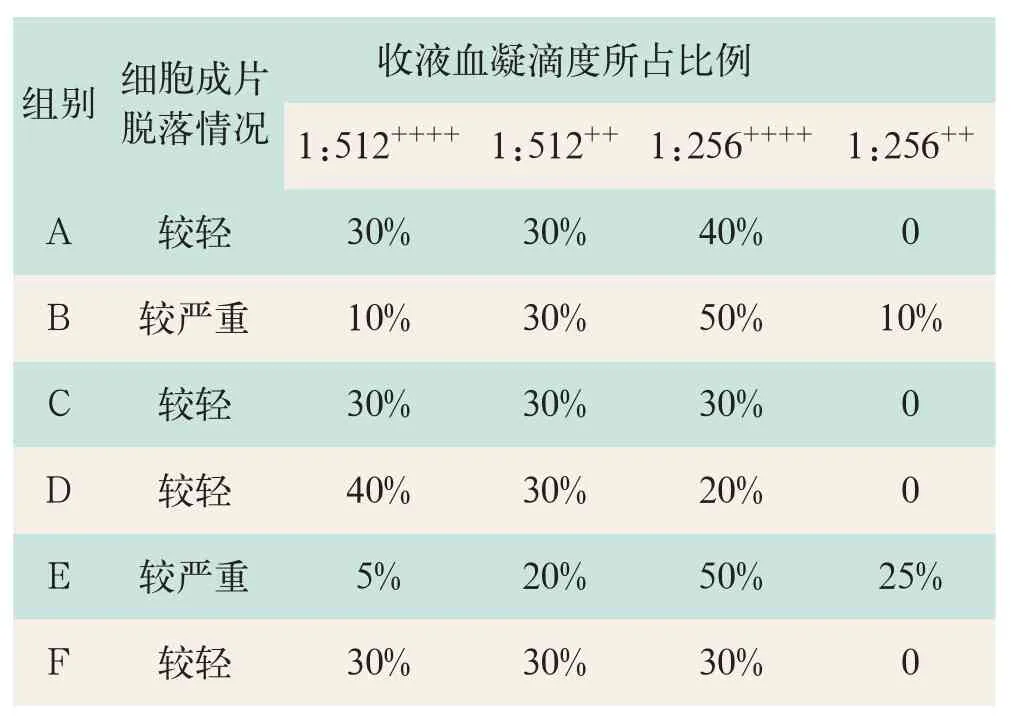
表3 CHO-C28细胞培养维持液阶段血凝滴度实验结果
3 讨论
在重组乙肝疫苗生产过程中,影响CHO-C28细胞HBsAg表达量的因素有很多,包括温度、PH值、DMEM、小牛血清、蒸馏水的质量,细胞培养液配制时添加补充液体的比例、细胞传代时胰酶活性及胰酶消化时间、操作人员技术熟练程度等。本文仅就DMEM、和小牛血清两种主要原料在乙肝疫苗生产过程中对细胞培养的重要影响进行了初步实验和分析,其他条件还有待今后进一步逐一实验和探讨。
在乙肝疫苗生产过程中,应对原辅料的进货渠道严格把关。做到严格执行SOP,保证每种原辅料的质量合格,减少批间差,确保生产的乙肝疫苗批批合格。
[1]金立杰,孙俊业.重组CHO乙肝疫苗细胞培养收换液改进[J].工艺,2002(4):37-39.
[2]李玉,姚伟,张岩锐,等.重组CHO细胞培养过程中代谢产物对细胞分泌HBsAg的影响[J].医药生物技术,2002,9(4).
[3]孙祥明,张元兴.重组CHO细胞培养过程中氨对细胞代谢的影响[J].2001(3).

