大黄鱼肌肉生长抑制素基因外显子Ⅱ遗传多态性分析
杨斌,薛良义,叶秀丽,董小敬
(宁波大学生命科学与生物工程学院,浙江 宁波 315211)
大黄鱼肌肉生长抑制素基因外显子Ⅱ遗传多态性分析
杨斌,薛良义,叶秀丽,董小敬
(宁波大学生命科学与生物工程学院,浙江 宁波 315211)
肌肉生长抑制素是控制动物骨骼肌生长发育的重要细胞因子,采用PCR-SSCP和测序方法分析了150尾大黄鱼样本肌肉生长抑制素基因(myostatin)外显子Ⅱ的单核苷酸多态性,结果发现,外显子Ⅱ中有10个多态位点,分别是29、131、206、261、231、243、265、273、297和300位。其中131位点T →A突变引起相应的氨基酸由L→Q,265位点T→C突变引起相应氨基酸由C→R,261位点A→G突变引起相应氨基酸由S→G,231位点的T→C突变引起相应氨基酸由W→S,273位点的C→T突变引起相应的氨基酸由R→W,297位点的A→G突变引起相应氨基酸由I→V,243位点的G→A突变引起相应氨基酸由D→N,300位点的G→A突变引起相应氨基酸由E→K。29位点A →G和206位点C→A均属于同义突变。存在6种基因型,他们的基因频率分别是0.57、0.23、0.10、0.04、0.02、0.04,该基因位点的杂合度为0.33。
大黄鱼;肌肉生长抑制素基因;单链构象多态性;生长性状
Abstract:Myostatin (MSTN )as an important cytokine controls the growth and development of skeletal muscle in animals.Ten single nucleotide polymorphisms (SNPs)were totally identified in the exon Ⅱof MSTN gene from 150(70 of one –year old and 80 of two-year old)large yellow croakers,Pseudosciaena crocea,individuals by PCR-SSCP and sequencing.The ten polymorphic sites were located at 29(A→G),131(T→A),206(C→A),231(T→C),243(G→A),261(A→G),265(T→C),273(C→T),297(A→G)and 300(G→A).Base mutations at sites 131,265,261,231,273,297,243 and 300 resulted in amino acid substitutions of L→Q,C→R,S→G,W→S,R→W,T→V,D→N and E→K,respectively.However,base mutations at sites 29 and 206 did not cause amino acid substitution.There were six genotypes in the examined population,whose frequency was 0.57、0.23、0.10、0.04、0.02and 0.04,respectively.The heterozygosity of MSTN locus was 0.33.
Keywords:Pseudosciaena crocea; MSTN; SSCP; growth trait
生长分化因子 8(growth and differentiation factor-8,GDF-8)基因最先由MePherron等从小鼠骨骼肌cDNA文库中筛选得到,因它对小鼠骨骼肌的生长起抑制作用,故又称为肌肉生长抑制素基因(myostatin,MSTN)[1]。在斑马鱼(Danio rerio)中,通过转基因和RNAi技术抑制该基因的功能,试验鱼的肌肉明显较正常鱼发达,证实该基因参与鱼类肌肉生长的负调控[2,3]。目前已在斑马鱼(Danio rerio)、溪红点鲑(Salvelinus fontinalis)、虹鳟鱼(Oncorhynchus mykiss)、银大麻哈鱼(Oncorhynchus kisutch)、大麻哈鱼(Salmo salar)和金头鲷(Sparus aurata)等多种鱼类中克隆得到了MSTN基因[4-15]。近来研究发现鱼类MSTN基因在结构上与高等脊椎动物有高度的相似性,但在组织表达上存在较大差异。哺乳动物中,MSTN基因除了在小鼠的骨骼肌中表达,在猪的乳腺、牛的蒲肯野氏纤维和心肌细胞中也有一定程度的表达[16,17]。在鱼类,MSTN基因除了在骨骼肌中表达,还在眼球、鳃丝、脑、肠、生殖腺、脂肪等组织中表达,表达范围比哺乳类要广泛[8,17]。
单核苷酸多态性(Single nucleotide polymorphisms,SNPs)是生物体基因组中存在最广泛的一类变异,称为第3代分子标记,在基因组和基因功能研究中具有重要的作用。单链构象多态性(single-strand conformation polymorphism,SSCP)作为检测基因多态性的方法,简便、快速、灵敏,不但可用于检测基因点突变和短序列的缺失和插入,而且还被用于DNA定量分析,监测PCR诊断实验中的交叉污染情况。已有研究表明,牛、猪、鸡等畜禽MSTN突变等位基因与动物肌肉产量相关,如比利时蓝牛的MSTN基因外显子Ⅲ缺失11bp造成移码突变,使缺失突变后面的第14位密码子变为终止密码子,合成无功能的MSTN蛋白,使其骨骼肌数量是其他品种的4倍[18,19]。鸡MSTN基因外显子I的两个点突变,造成Bsh1236I和Msp I酶切位点的消失,导致其胸重肌和胸肌率显著提高[20]。目前对鱼类MSTN基因与生长相关性的报道有本实验室之前发表的大黄鱼MSTN基因外显子I遗传多态性分析[21]。大黄鱼是中国的名贵鱼类,也是重要的海水养殖鱼类,笔者在克隆大黄鱼 MSTN 基因的基础上,对该基因外显子Ⅱ的遗传多态性及与生长的相关性进行了初步分析,以期为寻找与生长性状相关的候选标记位点打下基础[15]。
1 材料和方法
1.1 材 料
150尾大黄鱼样本(其中1龄70尾,2龄80尾)取自浙江象山港同一网箱养殖群体,经测量体质量、体长后,用无菌剪刀取肌肉组织分装于 1.5ml离心管,并迅速置于液氮罐中带回实验室,-70 ℃保存备用。
1.2 方 法
1.2.1 基因组DNA的提取 采用常规的酚-氯仿法提取。
1.2.2 PCR扩增 根据本实验室克隆的大黄鱼MSTN 基因序列(GenBank AY842934),使用Primer 5.0软件设计出一对扩增引物 W2F:5’-AGCCGAGTCCGTCGTCCAAG-3’和 W2R: 5’-ATAAAGGTTCAGCTCACCAGTCC-3’,由上海英骏生物技术有限公司合成。预期扩增目的片段为MSTN 基因的外显子Ⅱ,长度为371bp。
PCR 反应体系: 10×PCR buffer 2.5 μl,25 mmol/L MgCl21.5 μl,dNTP(每种 10 mmol/L)0.5μl,引物(每种 20 μmol/L)各 0.5μl,TaqDNA 聚合酶 1U,模板DNA 50 ng,反应总体积为25 μl。反应条件:94 ℃预变性3 min,30个循环(94 ℃,30 s;54.5℃,30 s;72 ℃,30 s),72 ℃延伸 10 min,4 ℃保存。
1.2.3 单链构象多态性分析 取PCR产物10 μl放入灭菌的小离心管中,加入 2μl变性上样缓冲液(95%甲酰胺、0.05%溴酚蓝、20 mmol/L EDTA);98 ℃水浴变性10 min,冰浴5 min;12%非变性聚丙烯酰胺凝胶(Acro /Bis为29:1)电泳8~9 h(10 V/cm);0.2%硝酸银染色。
1.2.4 克隆和测序 对具单链构象多态性的PCR扩增片段用PCR产物纯化试剂盒(上海生工)进行纯化,步骤参照其说明书。纯化产物的连接采用PMD18–T Vector试剂盒(大连宝生物公司),转化菌株为DH5α。阳性克隆经PCR法鉴定后,送上海生物工程有限公司测序。
1.2.5 数据统计分析 基因频率按公式Pi=[2(ii)+(ij1)+(ij2)+…+(ijn)]/2N计算,Pi为第i个等位基因的频率,i为纯合复等位基因,j1,j2…jn分别为与i共显的第1至n个等位基因。基因型频率的计算方法为:基因型频率=基因型个体数/测定群体总数。群体杂合度(Heterozygosity)根据Nei公式计算:
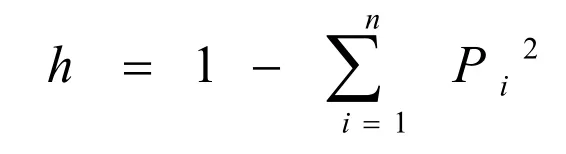
式中:h为群体内该基因位点的杂合度,为该位点所具有的等位基因数,Pi为该位点上第i个等位基因频率。
多态信息含量(polymorphism information content,PIC)按照Botstein等。(1980)公式计算:

式中Pi、Pj分别为种群中第i、j个等位基因频率,n为等位基因数。
利用 SPSS 软件包中的 GLM (General linear model )分析不同基因型对大黄鱼体质量和体长的影响。
2 结果与分析
2.1 目的片段PCR扩增
经PCR扩增的目的片段如图1,与预期扩增长度相符,且条带亮度较好,没有非特异性条带,可用于SSCP分析。
2.2 SSCP分析
将PCR产物进行SSCP分析,并经测序验证,结果表现出6种基因型,其中两条带型的有两种,分别命名为AA,CC型;3条带型的有3种,分别命名为 AB,AC,AD,4条带型的有 1种,命名为AE。

图1 大黄鱼MSTN基因外显子ⅡPCR扩增电泳图Fig.1 Electrophotogram of PCR product of Exon Ⅱof MSTN in the large yellow croaker

图2 150尾大黄鱼MSTN基因外显子Ⅱ聚丙烯酰胺凝胶电泳带型示意图Fig.2 Schematic diagram above shows results of PCR-SSCP on MSTN Exon Ⅱ of 150 large yellow croakers
2.3 MSTN基因不同基因型外显子Ⅱ的序列测定
对不同基因型的PCR产物进行纯化回收测序,并与GeneBank中登录的序列(AY842934)进行比对,发现AA型与AY842934序列一致,其他基因型均存在不同程度的单核苷酸突变。在外显子II中有 10 个突变位点,分别是 29(A →G)、131(T→A)、206(C→A)、261(A→G)、243(G→A)、300(G→A)、265(T→C)、231(T→C)、273(C→T)、297(A→G)。其中 131位点 T →A突变引起相应的氨基酸由L→Q,265位点T→C突变引起相应氨基酸由C→R,261位点A→G突变引起相应氨基酸由S→G,231位点的T→C突变引起相应氨基酸由W→S,273位点的C→T突变引起相应的氨基酸由R→W,297位点的A→G突变引起相应氨基酸由I→V,243位点的G→A突变引起相应氨基酸由D→N,300位点的G→A突变引起相应氨基酸由E→K。29位点A →G和206位点C→A均属于同义突变,未引起氨基酸的变化(表1)。AB型和AC型外显子Ⅱ部分序列见图4。
运用EBI网站里的Transeq工具,将不同基因型的大黄鱼MSTN基因外显子Ⅱ序列翻译为氨基酸序列,分析不同基因型大黄鱼MSTN基因外显子Ⅱ序列碱基突变引起的相应氨基酸序列变化(图5)。
2.4 外显子Ⅱ的基因型及基因频率
在150尾大黄鱼肌肉样本中AA型个体最多有85尾,其次是AB型,共有34尾,突变基因型AE个体最少只有3尾。AA、AB、AC、AD、AE、CC这6种基因型的基因频率分别为0.57、0.23、0.10、0.04、0.02、0.04。等位基因A、B、C、D、E的频率分别为0.763、0113、0.09、0.024、0.01。经过计算,150尾大黄鱼肌肉样本的基因的杂合度为0.33,多态信息含量PIC=0.37。

图3 大黄鱼MSTN基因外显子Ⅱ测序图(A图为AB型外显子Ⅱ序列,突变发生在外显子Ⅱ29位A→G,B图为AC型外显子Ⅱ序列,突变发生在外显子Ⅱ131位T→A)Fig.3 Sequence analysis of MSTN gene Exon Ⅱ of the large yellow croaker

图4 大黄鱼MSTN基因外显子Ⅱ不同基因型序列编码的氨基酸序列Fig.4 Sequences of Amino acid translated from MSTN gene Exon Ⅱof the large yellow croaker with different genetypes
3 讨 论
近年来国内外的很多研究都证明了MSTN基因具有突变和多态性并影响到了生物的生长发育等性状,如McPherron等发现比利时蓝牛中MSTN基因缺失11 bp,导致该基因阅读框架发生改变,分子活性区域消失,出现肌肉特别发达的双肌牛,皮埃蒙特牛的MSTN基因外显子I中C突变成A,外显示子3中G突变成A,从而导致双肌牛[22]。在人类中也发现了一个MSTN基因的天然突变,外显子I的G→A 突变,导致108 bp长度的mRNA被错误剪辑,使MSTN基因编码的蛋白质长度减少,丧失其功能,其表型与MSTN基因敲除小鼠的表型类似,骨骼肌比正常人要发达。国内对鸡(Gallus gallus)、猪(Sus scrofa)、绵羊(Ovis aries)等的研究也表明MSTN 存在多态性[20,23-26]。在本研究中,大黄鱼MSTN基因外显子Ⅱ存在多处单碱基突变,除了同义突变外,还有导致氨基酸水平上发生改变的错义突变,如L→Q,C→R,S→G,W→S,R→W,I→V,D→N和E→K,使得大黄鱼MSTN基因外显子Ⅱ的PCR-SSCP结果较为复杂。
群体的杂合度是表示在被检测的位点上群体中的杂合子频率,群体平均杂合度的高低反应了群体的遗传一致性程度,平均杂合度越高,群体的遗传一致性就越低,其遗传多样性越高。本试验中的大黄鱼MSTN基因外显子Ⅱ杂合度h为0.33,远低于大黄鱼MSTN基因3’-UTR区内(CA)n微卫星序列微卫星序列[28]的杂合度(0.93),也低于大黄鱼MSTN 基因外显子Ⅰ[21]的杂合度(0.709)。显示该群体中MSTN基因外显子Ⅱ的一致性较高,表明大黄鱼MSTN基因外显子Ⅱ在遗传过程中较上述两个序列更为保守。据单淇[32]报道,长江流域瑞昌、宁河和长沙3地鳙鱼mtDNA D-loop区段限制性片段的杂合度分别为0.6883、0.4459和0.2379。由于基因、基因互作和基因组背景效应的复杂性,群体杂合度和性状之间不是简单的相关关系,因此有必要进一步研究大黄鱼MSTN基因各外显子群体杂合度和生长性状的关系[29,30]。
多态信息含量是基因多态信息高低的一个指标,当 PIC>0.5时,该基因座为高度多态基因座,标记可提供信息较多,当0.25<PIC<0.5时,为中度多态基因座,标记提供的信息较合理;当 PIC<0.25时,为低度多态基因座,标记提供的信息较差[27]。本文分析中的大黄鱼MSTN基因外显子Ⅱ的PIC为0.37,属于中度多态基因座位,较之前本实验室研究的大黄鱼MSTN基因3’-UTR区内(CA)n微卫星序列,以及大黄鱼MSTN基因外显子I序列的多态信息含量要低,这与群体杂合度的结果一致[21,28]。在哺乳动物中,东北马鹿的MSTN基因多态信息含量为0.17,说明该基因在高等动物中可能更加保守[31]。
MSTN基因多态性与相关性状间的关系,近年来在家禽畜中已有较多的报道,如李绍华等的研究表明,大白猪(Sus scrofa)MSTN基因的外显子Ⅱ有3种基因型,外显子Ⅲ有2种基因型,外显子Ⅱ的多态性与生产性状不相关,而外显子Ⅲ的多态性与猪的背膘厚呈显著性相关[25]。在的大黄鱼MSTN基因的研究中,外显子Ⅰ的多态性与与大黄鱼体重、体长呈显著性相关[21],这些结果表明MSTN基因不同的外显子多态性对动物的生长性状具有不同的影响。在本研究中,仅对1龄和2龄大黄鱼MSTN基因外显子Ⅱ的单核苷酸多态性进行了分析,并将以此为基点探讨分析大黄鱼MSTN基因外显子Ⅱ与生长性状的关系。
致谢:宁波大学生命科学院薛良义教授对本文写作进行了指导和帮助,实验室成员黄伟、李婷、董海阳、刘晓飞等参加象山养殖场取样工作,在此一并致谢。
[1]McPherron A C,Lawler A M,Lee S J.Regulation of skeletal muscle mass in mice by a new TGF-β superfamily member [J].Nature,1997,387(6628): 83-90.
[2]Xu C,Wu G,Zohar Y,et al.Analysis of myostatin gene structure,expression and function in zebrafish [J].J Experi Biol,2003,206(22): 406724079.
[3]Acosta J,Carp io Y,Borroto I,et al.Myostatin gene silenced by RNAi show a zebrafish giant phenotype [J].J Biotechnol,2005,119(4): 3242331.
[4]Amali A A,Lin C J,Chen Y,et al.Up-regulation of muscle-specific transcription factors during embryonic somitogenesis of zebrafish(Danio rerio)by knock-down of myostatin-1 [J].Dev.Dyn,2003,229: 847-856.
[5]Roberts S B,Goetz F W.Differential skeletal muscle expression of myostatin across teleost species,and the isolation of multiple myostatin isoforms [J].FEBS Lett,2001,491(3): 212-216.
[6]Rescan PY,Jutel I,Ralliere C.Two myostatin genes are differentially expressed in myotomal muscles of the trout(Oncorhynchus mykiss)[J].J.Exp.Biol.,2001,204 (Pt 20): 3 523-3 529.
[7]Qstbye T,Galloway T F,Nielsen C,et al.The two myostatin genes of Atlantic salmon (Salmo salar)are expressed in a variety of tissues[J].Eur.J.Biochem,2001,268(20): 5 249-5 257.
[8]Maccatrozzo L,Bargelloni L,Radaelli G,et al.Characterization of the myostatin gene in the gilthead seabream (Sparus aurata):sequence,genomic structure,and expression pattern [J].Mar.Biotechnol,2001,3: 224-230.
[9]Rodgers B D,Weber G M,Sullivan C V,et al.Isolation and characterization of myostatin complementary deoxyribonucleic acid clones from two commercially important fish: Oreochromis mossambicus and Morone chrysops [J].Endocrinology,2001,142:1 412-1 418.
[10]Rodgers B D,Weber G M.Sequence conservation among fish myostatin orthologues and the characterization of two additional cDNA clones from Morone saxatilis and Morone Americana [J].Comp.Biochem.Physiol,Part B,2001,129(223): 597-603.
[11]Kocabas A M,Kucuktas H,Dunham R A,et al.Molecular characterization and differential expression of the myostatin gene in channel catfish (Ictalurus punctatus)[J].Biochim.Biophys.Acta,2002,1575(13): 99-107.
[12]Maccatrozzo L,Bargelloni L,Patarnello P,et al.Characterization of the myostatin gene and a linked microsatellite marker in shi drum(Umbrina cirrosa,Sciaenidae)[J].Aquaculture,2002,205(122):49-60.
[13]Gregory D J,Waldbieser G C,Bosworth B G.Cloning and characterization of myogenic regulatory genes in three Ictalurid species [J].Animal Genetics,2004,35: 425-430.
[14]叶寒青.花鲈肌肉生长抑素基因(MSTN)克隆,表达及其基因打靶载体的构建.2006,中国海洋大学博士论文.
[15]Xue L,Qian K,Qian H,et al.Molecular cloning and characterization of the myostatin gene in croceine croaker,Pseudosciaena crocea [J].Mol Biol Rep,2006,33: 129-136.
[16]Ji S Q,Losinski R L,Cornelius S G.Myostatin expression in porcine tissues: tissue specificity and developmental postnatal regulation [J].Am J Physiol,1998,275: 1 265-1 273.
[17]Sharma M,Kambadur R,Matthews K G,et al.Myostatin,a transforming growth fator-beta superfamily member,is expressed in heart muscle and is upregulated in cardiomyocytes after infarct [J].J.Cell.Physiol.1999,180(1): 1-9.
[18]Mc Pherron A C,LEE S J.Double muscling in cattle due to mutations in the myostatin gene [J].Proc Natl Acad Sci USA,1997,94(23): 12457-12461.
[19]Grob l,Martin L J,Poncelet D,et a1.A deletion in the bovine myostatin gene cause the double-muscled phenotype in cattle [J].Nat Genet,1997,17(1): 71-74.
[20]朱智,吴登俊,徐宁迎.鸡Myostatin基因单核苷酸多态性及其对屠体性状的遗传效应分析 [J].遗传,2007,29 (5): 5932598.
[21]薛良义,李婷.大黄鱼肌肉生长抑制素基因外显子I遗传多态性分析 [J].水产科学,2008,27(10): 503-506.
[22]Mc Pherron A C,Se-Jin Lee.Suppression of body fat accumulation in myoatatin-deficient mice [J].J Clin Invst,2002,109(5): 595-601.
[23]Schuelke M,Wagner K R,Stolz L E,et al.Myostatin mutation associated with gross muscle hypertrophy in a child [J].Engl Med,2004,350: 2 682-2 688.
[24]顾志良,朱大海,李宁,等.鸡Myostatin基因单核苷酸多态性与骨骼肌和脂肪生长的关系 [J].中国科学(C辑),2003,33 (3):273-280.
[25]李绍华,熊远著,郑嵘,等.猪MSTN基因多态性及其SNPs的研究 [J].遗传学报,2002,29(4): 3262331.
[26]张慧玲,史洪才,罗淑萍,等.绵羊肌肉生长抑制素基因外显子Ⅰ单核苷酸多态性分析 [J].新疆农业大学学报,2007,30 (4):21-24.
[27]Botstein D,White R L,Skolnick M,et al.Construction of a genetic linkage map in man using restriction fragment length polymorphisms [J].AmJ Hum Genet,1980,32 (3): 3142331.
[28]薛良义,孙升.大黄鱼肌肉生长抑制素基因微卫星序列多态性分析 [J].中国生物化学与分子生物学报,2008,24(10): 980-985.
[29]刘国庆,孙业良.极近杂交绵羊微卫星基因杂合度与与生长性能的关系 [J].南京农业大学学报,2006,29(1): 67-71.
[30]刘桂琼.猪个体基因杂合度对肉质的影响 [J].南京农业大学大学学报,2003,26(1):56-60.
[31]巴恒星.东北马鹿Myostatin基因单核苷酸多态性研究 [J].特产研究,2009,(1):11-13.
[32]单淇.3个群体鳙鱼mtDNA D-loop区段的限制性片段长度多态性分析 [J].中国水产科学,2006,13(2):174-179.
Gentic polymorphism analysis of exon Ⅱ in MSTN gene from large yellow croaker,Pseudosciaena crocea
YANG Bin,XUE Liang-yi,YE Xiu-li,DONG Xiao-jing
(College of Life Science and Biotechnology,Ningbo University,Ningbo 315211,China)
Q959.483; Q31
A
1001-6932(2010)05-0554-06
2009-10-12;
2009-12-28
国家863项目(2006AA10A405)和国家自然科学基金(30871916)
杨斌(1982-),男,浙江人,硕士。研究方向:海洋生物基因资源,电子邮箱:bluestar180@sina.com
薛良义,教授,从事水产生物技术研究。电子邮箱:xueliangyi@nbu.edu.cn

