不同血瘀造模对B16荷瘤鼠肝转移模型的影响
潘永明,杨玉伟,刘瑞敏,陈亮,朱科燕,屠珏,何欢,陈民利
(浙江中医药大学动物实验研究中心/比较医学研究中心,杭州 310053)
研究报告
不同血瘀造模对B16荷瘤鼠肝转移模型的影响
潘永明,杨玉伟,刘瑞敏,陈亮,朱科燕,屠珏,何欢,陈民利
(浙江中医药大学动物实验研究中心/比较医学研究中心,杭州 310053)
目的比较不同血瘀造模对B16荷瘤鼠肝转移模型的影响。方法取60只6周龄雌性C57BL/6J小鼠,随机分为正常对照组、单纯荷瘤组、BS1(利血平法)组、BS2(游泳复合高分子右旋糖酐法)组、BS3(寒凝复合肾上腺素法)组和BS4(地塞米松复合肾上腺素法)组,首先根据中医理论用不同造模方法形成血瘀模型,然后经脾接种B16黑色素瘤建立肝转移模型。用激光多普勒观察小鼠耳廓微循环变化,并在接种后第15天小鼠眼眶取血,检测红细胞免疫功能和血清唾液酸酶(SA)含量的变化,并麻醉处死动物,观察肝转移情况。结果①单纯荷瘤组和各血瘀荷瘤组小鼠的耳廓微循环血流均明显减少(P<0.01),以BS2组降低显著。②单纯荷瘤组和各血瘀荷瘤组小鼠的红细胞免疫功能亦明显降低(P<0.01),血清SA含量显著升高(P<0.05,P<0.01),以BS2和BS3组变化明显。③肝转移发生率:单纯荷瘤组、BS2组和BS3组均为100%,BS1组为80%,BS4组为60%,肝转移抑制率: BS2组、BS3组、BS1组和BS4组分别为-71.76%、3.90%、16.42%、100.6%。④荷瘤鼠肝转移的肝重与其耳廓微循环血流、红细胞免疫功能和唾液酸酶含量具有显著的相关性(P<0.05,P<0.01)。结论不同血瘀造模对B16荷瘤鼠肝转移模型肝转移发生程度具有明显的影响,应注意血瘀模型的选择,且其与红细胞免疫功能低下有关。
血瘀;B16黑色素瘤;肝转移;红细胞免疫功能;小鼠
侵袭与转移是恶性肿瘤最显著的特征之一,由于其转移过程的复杂和难以控制,已严重影响人类的生活质量。近年来,大量文献表明肿瘤患者血流学变化特征是血液呈高黏滞状态,出现“浓、黏、凝、聚”改变,证实肿瘤与血瘀密切相关[1,2],故目前活血化瘀中药抗肿瘤转移作用研究大多建立在脾虚血瘀证或正常动物为基础复制肿瘤转移模型[3-5],但往往研究结果与临床疗效差异较大,导致活血化瘀中药抗恶性肿瘤的作用备受争论[3]。而现代化中医药研究迫切需要具有中医证候特点的病证结合动物模型,使中医药科研工作更加科学化,客观化,同时满足中西医学的研究需要,是中西医结合研究的基础与难点[6]。由于血瘀证动物模型方法众多,其不同造模方法对中药抗肿瘤转移评价结果是否存在影响均未有报道。为此,本文利用不同造模方法复制四种血瘀模型,并在其基础上建立病证结合的血瘀证肿瘤肝转移模型,比较不同血瘀造模方法对B16荷瘤鼠肝转移模型的影响,从而为活血化瘀中药的筛选和作用机理的研究提供理想和可靠的动物模型。
1 材料与方法
1.1 实验动物与瘤株
选用6周龄雌性SPF级C57BL/6J小鼠60只,体质量(18±2)g,购自上海斯莱克实验动物有限公司[SCXK(沪)2007-0005],动物饲养及无菌手术均在浙江中医药大学动物实验研究中心SPF级动物实验设施中进行[SYXK(浙)2008-0115]。B16黑色素瘤瘤株,购自杭州昊天生物技术有限公司。
1.2 主要仪器与试剂
DRT4/PRM2型激光多普勒,英国Moor Instruments;Nikon YS100型光学显微镜,日本尼康公司;E12140型电子天平,美国Ohaus公司;DU800紫外分光光度计,Beckman Coulter;利血平注射液,广东邦民制药厂有限公司;盐酸肾上腺素注射液,福州海王福药制药有限公司;地塞米松磷酸钠注射液,浙江仙琚制药股份有限公司;Dextran T-500,BoYun Biotech;唾液酸(SA)试剂盒,批号:20090914,由南京建成生物工程研究所提供;酵母多糖冻干试剂,由上海长海医院免疫室提供。
1.3 实验方法
1.3.1 实验分组:适应性饲养1周后随机分为6组:①正常对照组;②单纯荷瘤组:非血瘀(NBS)组;③BS1组:血瘀1组(利血平法);④BS2组:血瘀2组(游泳复合高分子右旋糖酐法);⑤BS3组:血瘀3组(寒凝复合肾上腺素法);⑥BS4组:血瘀4组(地塞米松复合肾上腺素法),每组10只。
1.3.2 瘤细胞培养及接种:取对数生长期小鼠B16黑色素瘤细胞,吸弃培养液,PBS液洗2遍,然后0.25%胰酶消化1 min后,再PBS液清洗2遍,加PBS液吹打,1000 r/min 4℃离心10 min,收集细胞,重悬于PBS液中。细胞计数后,调细胞悬液浓度为3×106/mL,将细胞悬液置于冰上,用于小鼠脾脏接种。
1.3.3 血瘀证模型制备:①正常对照组:不做任何处理;②单纯荷瘤组:每天股四头肌注射生理盐水每只鼠0.2 m L,连续17 d;③BS1组:参照文献[3],每天股四头肌注射利血平注射液0.1 mg/(kg·bw),连续17 d,造成血瘀;④BS2组:参照文献[8,9]并加以改进,将小鼠放入水温(43±0.5)℃,水深25 cm的水槽中游泳,当全组50%鼠出现自然沉降时,全组停止游泳,连续17 d,并在游泳后第17天,小鼠尾静脉快速注入10%高分子右旋糖酐生理盐水液1.0 g/(kg·bw),造成血瘀;⑤BS3组:参照文献[10],每日每只小鼠肌注生理盐水0.2 mL,连续16 d,于第17天每只皮下注射肾上腺素0.02 mL,共2次,两次间隔4 h。在第1次注射后2 h,将小鼠浸入冰水5 min,造成血瘀;⑥BS4组:参考文献[11]并加以修改,小鼠每天肌注地塞米松磷酸钠0.5 mg/(kg·bw),连续16 d;第17天于每只皮下注射肾上腺素0.04 mL。除正常对照组外,小鼠均于第18天制作肝转移模型。
1.3.4 肝转移模型建立:用水合氯醛腹腔注射麻醉小鼠,取仰卧位固定,左上腹剪毛,常规消毒,在小鼠的左侧肋弓下缘垂直切开,暴露脾脏,在脾脏的上极注入0.1 m L B16黑色素瘤细胞悬液,用棉签轻压针孔,然后关闭腹腔,缝合创面。
1.3.5 观察指标:①每天观察各组小鼠的饮食、毛色、精神活动、粪便等一般情况;②分别在造模第17天和第31天,应用激光多普勒测定小鼠耳部微循环变化;③红细胞免疫功能测定:红细胞C3b受体花环率(E-C3bR)、红细胞免疫复合物花环率(E-ICR)参照郭峰方法[12,13];④接种肿瘤细胞14d后,所有小鼠眼眶取血,分离血清,测定唾液酸酶(SA)含量;⑤动物麻醉处死后,肉眼观察脏器的病理变化和计算小鼠肝转移发生率:肝转移发生率(%)=每组肝转移的动物数/每组总的动物数×100%。同时取肝脏称重,计算肝转移抑制率:肝转移抑制率(%)=(单纯荷瘤组平均肝重–血瘀证荷瘤组肝重)/(单纯荷瘤组平均肝重–正常对照组平均肝重)×100%。
1.4 数据统计学处理
2 结果
2.1 各组小鼠一般情况观察
接种瘤株前,正常对照组和单纯荷瘤组小鼠食欲正常,毛色光泽,行动活泼,体重增长良好,粪便正常。BS1组小鼠造模后体重下降明显,并出现轻微畏寒、肢冷、食欲下降、稀便、聚堆、活动减少等表现; BS2组小鼠随造模时间的延长,游泳时间明显缩短,被毛不光泽,大便略稀,精神萎顿,活动减少等表现; BS3组小鼠造模后出现心跳加快、活动减少、肢体尾部苍白、蜷缩等寒凝表现;BS4组小鼠造模后体重明显下降,活动减少,食欲降低,被毛不光泽等。期间,体重增长情况以正常对照组和单纯荷瘤组>BS3组>BS2组>BS4组和BS1组。
在接种瘤株时,因麻醉或手术原因造成BS2组和BS3组各有3只小鼠死亡,单纯荷瘤组1只死亡;接种后1~3d小鼠体重均有下降,活动减少;3 d后各组小鼠体重均有不同程度的恢复,活动增加;接种10 d后,正常对照组和BS4组小鼠活动、食欲较好,而其余各组小鼠均出现饮食减少,腹部明显膨隆,精神萎靡,体重较术前明显上升;至接种后第14天处死前,正常对照组小鼠无死亡,单纯荷瘤组自然死亡2只,BS2组和BS3组均自然死亡1只,BS1组因取血后死亡3只。
2.2 各组小鼠耳廓微循环的变化
结果显示,血瘀造模后,四种造模方法的血瘀组小鼠耳廓微循环血流明显低于正常对照组和单纯荷瘤组(P<0.01);接种瘤株14 d后,单纯荷瘤组耳廓微循环血流亦明显降低(P<0.01),而其他各血瘀组仍明显低于正常对照组(P<0.01),与单纯荷瘤组比,BS2组降低显著(P<0.05),见表1。
表1 各组小鼠耳廓微循环血流的比较(±s,每100 g组织m L/min)Tab.1 Comparison of the blood flow in auricular microcirculation in different groups

表1 各组小鼠耳廓微循环血流的比较(±s,每100 g组织m L/min)Tab.1 Comparison of the blood flow in auricular microcirculation in different groups
注:与正常对照组比较,**P<0.01;与单纯荷瘤组比较,△P<0.05,△△P<0.01。Note:**P<0.01 vs.normal control group;△P<0.05,△△P<0.01 vs.NBS group.
组别(Group)动物数(n)17thd n 31thd正常对照组(Normal control)10 43.71±6.62 10 41.64±4.76单纯荷瘤组(NBS)10 41.24±11.27 7 29.34±5.36**BS1组(BS1)10 23.46±5.61**△△7 33.17±4.84**BS2组(BS2)10 27.73±5.42**△△6 21.98±5.81**△BS3组(BS3)10 28.17±5.88**△△6 25.30±6.14**BS4组(BS4)10 24.81±5.91**△△10 29.21±7.61**
2.3 对红细胞免疫功能的影响
结果显示,肿瘤肝转移发生后,单纯荷瘤组和各血瘀组小鼠的红细胞免疫功能均发生明显紊乱,出现E-C3bR低下,E-ICR升高(P<0.01)。与单纯荷瘤组比,BS2组和BS3组小鼠E-C3bR显著低于单纯荷瘤组(P<0.01),且BS1组、BS2组和BS3组EICR均显著高于单纯荷瘤组(P<0.05,P<0.01),但BS4组均略高于单纯荷瘤组(P>0.05),见表2。
2.4 对血清唾液酸酶(SA)含量的影响
与正常对照组比,单纯荷瘤组和各血瘀证荷瘤组小鼠SA含量均出现显著升高(P<0.05,P<0.01);与单纯荷瘤组比,除BS4组小鼠SA显著低于单纯荷瘤组(P<0.05)外,其余各血瘀荷瘤组小鼠SA均略高于单纯荷瘤组,但差异无显著性(P>0.05),见图1。
表2 各组小鼠红细胞免疫功能的比较(±s,%)Tab.2 Comparison of erythrocyte immune function in different groups
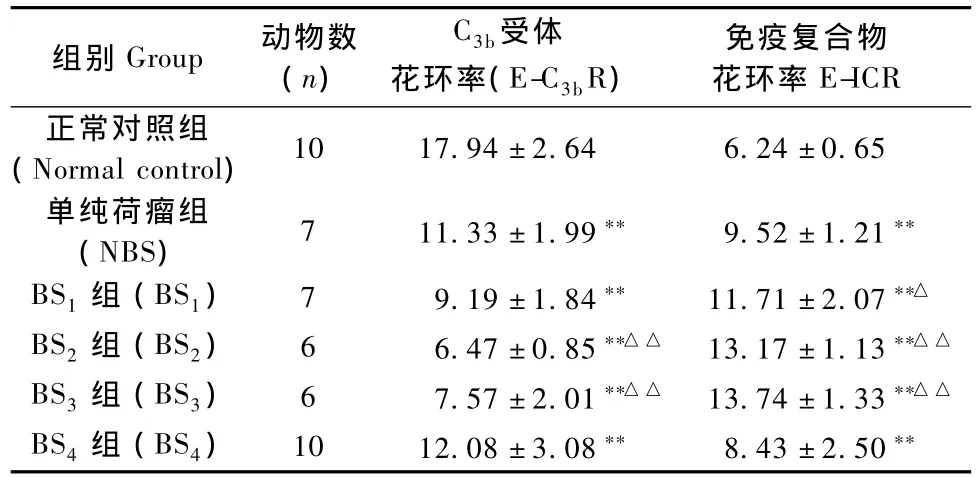
表2 各组小鼠红细胞免疫功能的比较(±s,%)Tab.2 Comparison of erythrocyte immune function in different groups
注:与正常对照组比较,**P<0.01;与单纯荷瘤组比较,△P<0.05,△△P<0.01。Note:**P<0.01,vs.normal control group;△P<0.05,△△P<0.01,vs NBS group.
组别Group动物数(n) C3b受体花环率(E-C3bR)免疫复合物花环率E-ICR正常对照组(Normal control)10 17.94±2.64 6.24±0.65单纯荷瘤组(NBS)7 11.33±1.99**9.52±1.21**BS1组(BS1)7 9.19±1.84**11.71±2.07**△BS2组(BS2)6 6.47±0.85**△△13.17±1.13**△△BS3组(BS3)6 7.57±2.01**△△13.74±1.33**△△BS4组(BS4)10 12.08±3.08**8.43±2.50**

注:与正常对照组比较,**P<0.01;与单纯荷瘤组比较图1各组小鼠血清SA含量的比较Note:△P<0.05。Note:**P<0.01 vs.normal control group;△P<0.05 vs NBS group.Fig.1 Comparison of serum SA contents in different groups
2.5 对肿瘤转移的影响
接种瘤株14d后麻醉处死小鼠,经剖检发现正常对照组小鼠肝脏色泽鲜红、有光泽,表面光滑,质地柔软,体积均一;而其他组小鼠均发生了不同程度的肿瘤肝转移。其中单纯荷瘤组、BS2组和BS3组肝转移发生率均为100%,BS1组为80%,且肝脏呈暗灰色,质较硬,肝被膜表面及切面可见芝麻粒样大小不等的黑色转移灶,呈分散或成堆浸润生长,脾脏亦有一定大小的瘤块形成,其他脏器未见转移灶。BS4组肝转移发生率为60%,且该组小鼠肝脏表面的转移灶较其他荷瘤鼠明显减少,脾脏瘤块亦缩小显著,肝脏色泽较其他荷瘤组好。另外,发生肝转移的小鼠剖腹后可见腹腔内均有不等量的血性腹水,尤其是自然死亡时,小鼠体内可见腹腔内较多血性腹水,气味腥臭。肝脏呈暗灰色,各叶表面及切面均有黑色的转移灶,呈多发性弥散分布,其大小不一,而未发生转移的小鼠肝脏表面光滑、质地柔软,见表3。
与正常对照组比,除BS4组外,其他荷瘤组小鼠肝重增加显著(P<0.01),而BS4组肝重显著低于单纯荷瘤组(P<0.01),与正常对照组相当;从肝转移抑制率来看,BS2组能促进肝转移,而BS1组、BS3组和BS4组肝转移抑制率分别为16.42%、3.90%和100.6%,以BS4组差异有显著性(P<0.01),见表3。
2.6 荷瘤鼠肝转移的肝重与耳廓微循环血流、红细胞免疫功能、唾液酸酶的相关性
相关分析发现,荷瘤鼠肝转移的肝重与耳廓微循环血流(r=-0.440)、红细胞C3b受体花环率(E-C3bR,r=-0.472)呈显著负相关(P<0.01);而与红细胞免疫复合物花环率(E-ICR,r=0.502,P<0.01)和血清唾液酸酶(SA,r=0.343,P<0.05)呈显著正相关。
表3 各组小鼠肝转移发生率、抑制率及肝重比较(±s)Tab.3 Comparison of hepatic metastasis incidence rate,inhibition ratie and liver weight in different groups
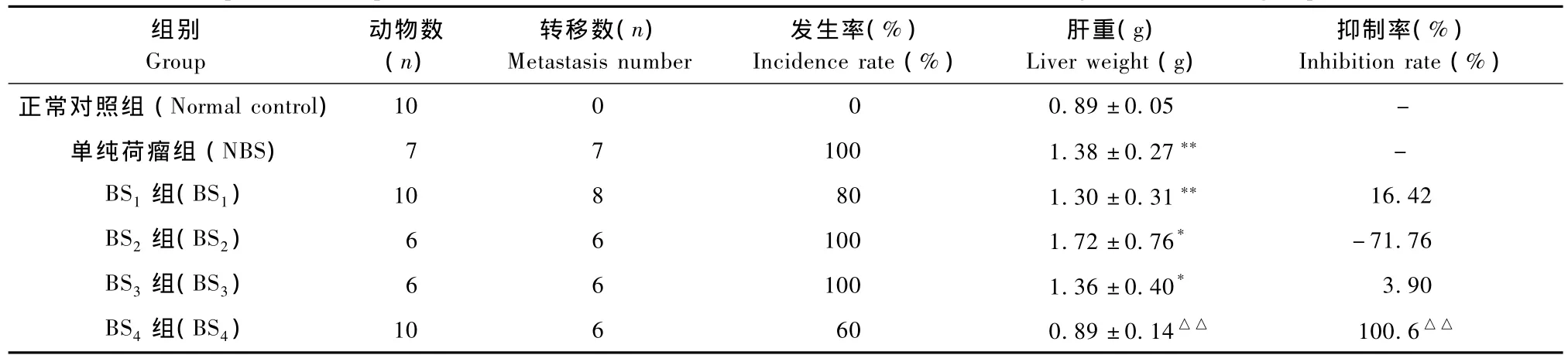
表3 各组小鼠肝转移发生率、抑制率及肝重比较(±s)Tab.3 Comparison of hepatic metastasis incidence rate,inhibition ratie and liver weight in different groups
注:与正常对照组比较,*P<0.05,**P<0.01;与单纯荷瘤组比较,△△P<0.01。Note:*P<0.05,**P<0.01 vs.normal control group;△△P<0.01 vs NBS group.
组别Group动物数(n)转移数(n) Metastasis number发生率(%) Incidence rate(%)肝重(g) Liver weight(g)抑制率(%) Inhibition rate(%)正常对照组(Normal control)10 0 0 0.89±0.05-单纯荷瘤组(NBS)7 7 100 1.38±0.27**-BS1组(BS1)10 8 80 1.30±0.31**16.42 BS2组(BS2)6 6 100 1.72±0.76*-71.76 BS3组(BS3)6 6 100 1.36±0.40*3.90 BS4组(BS4)10 6 60 0.89±0.14△△100.6△△
3 讨论
中医学历来从整体观出发,认为恶性肿瘤的发生、发展,主要是由于正气虚损、阴阳失衡、脏腑功能失调,留滞客邪(致病因子),致使气滞血瘀、痰凝毒聚、相互胶结、蕴郁成肿瘤[14]。可见,瘀滞是肿瘤转移最主要的病理基础,而肝脏是恶性肿瘤转移的常见靶器官之一,故本文以建立血瘀模型为基础,并利用小鼠B16黑色素瘤细胞脾脏接种,复制肿瘤肝转移模型,模拟了肿瘤自发血行转移的过程,其与临床肿瘤发生、发展过程有一定的相似性。研究发现,四种造模方法形成的血瘀模型小鼠耳廓微循环均出现明显的障碍,相关分析显示耳廓微循环血流与肝重呈显著的负相关,且发现游泳复合高分子右旋糖酐法和寒凝复合肾上腺素法形成的血瘀模型均能加重荷瘤鼠的血瘀程度,提示气血瘀滞可能是肿瘤的发生发展中非常重要的一个环节。
众所周知,机体的免疫功能与肿瘤的发生、发展亦有着密切联系。机体免疫系统能清除癌细胞,从而抑制肿瘤转移,这一事实已得到公认[15]。现代研究认为红细胞免疫在抗肿瘤免疫机理中亦占有重要地位,已证实红细胞有识别、粘附、浓缩和杀灭抗原的功能,并有清除循环免疫复合物的能力,还参与机体免疫调控[16,17]。红细胞膜上的CR1是红细胞发挥免疫功能的重要物质基础,唾液酸是C3b受体的重要物质基础,其能够抑制肿瘤细胞增殖及转移[18,19]。研究发现,四种血瘀模型均能引起荷瘤鼠红细胞免疫功能发生明显降低和血清SA含量升高,且其与肝转移肝重密切相关,表明红细胞免疫功能低下可能是导致肿瘤细胞进一步生长和扩散的重要原因之一,与杨运高等[15]研究结果相一致;另外,结果显示四种血瘀造模方法对红细胞免疫的变化依次以游泳复合高分子右旋糖酐法、寒凝复合肾上腺素法和利血平法三种方法较好。
研究结果显示四种血瘀造模方法对荷瘤鼠肝转移程度具有明显的不同,其中利血平法、寒凝复合肾上腺素法和地塞米松复合肾上腺素法形成的血瘀状态能减少肿瘤肝转移,其部分结果与金莉等[4]报道脾虚血瘀证较为一致,而地塞米松复合肾上腺素法形成的血瘀证肿瘤肝转移小鼠具有较高的抑制率,其可能与造模中使用了地塞米松有关,据报道,地塞米松不仅能诱导体外肿瘤细胞凋亡,还能在体内诱导裸鼠宫颈癌移植瘤凋亡发生,显著抑制肿瘤生长,并存在一定程度的剂量依赖效应[20]。而游泳复合高分子右旋糖酐法形成的血瘀状态能明显促进肿瘤肝转移,可能与其在这四种造模方法中其血瘀和红细胞免疫低下程度最严重有关。可见,以游泳复合高分子右旋糖酐法形成的血瘀证荷瘤鼠肝转移模型较好,也提示活血化瘀中药抗肿瘤肝转移筛选中,应根据药物的特点,选择理想的血瘀造模方法,确保药物疗效和评价的准确性。
[1]田同德,储真真,陈信义.恶性肿瘤高凝状态与血瘀证相关性及中医防治对策研究[J].北京中医药,2009,28(6):425-427.
[2]钱彦方.活血化瘀中药对肿瘤形成和转移的影响[J].中医杂志,2008,49(10):942-945.
[3]金莉,刘鲁明.血瘀状态下荷瘤小鼠肝转移的特点及相关机制研究[J].中华中医药学刊,2007,25(1):75-78.
[4]陈培丰,刘鲁明,陈震,等.三七醇提液对恶性肿瘤肝转移的干预作用[J].中西医结合学报,2006,4(5):500-503.
[5]张中冕,段芳龄,张明智.脂质体猪苓多糖抗肝转移癌作用的研究[J].胃肠病学和肝病学杂志,1999,8(3):180-182.
[6]王键,赵辉,李净,等.多因素复合制作气虚血瘀证脑缺血动物模型的实验研究[J].中国实验动物学报,2001,9(4): 216-220.
[7]华何与,杨运高,张红栓.论气虚血瘀与肿瘤转移[J].国医论坛,2000,15(2):23-25.
[8]张红宇,高菊珍,张晓华.补阳还五汤对气虚血瘀证大鼠血液流变学的影响[J].云南中医学院学报,2000,23(3):10-11.
[9]张艳,贾丹辉,付润芳,等.息痛颗粒对血瘀型动物微循环的影响[J].中成药,2005,27(11):1350-1352.
[10]徐立,时乐,李祥,等.加减桃红四物汤醇提物对寒凝血瘀模型小鼠微循环和凝血时间的影响[J].江苏中医药,2008,40(11):121-122.
[11]杨耀芳,王赛前,封美佳,等.土鳖虫对血瘀大鼠红细胞CR1活性及抗心磷脂抗体水平的影响[J].细胞与分子免疫学杂志,2005,21(1):53-56.
[12]郭峰.红细胞免疫及其调节功能的测定方法[J].免疫学杂志,1990,6(1):60-63.
[13]郭峰,虞紫茜,赵中平.红细胞免疫功能的初步研究[J].中华医学杂志,1982,62(11):715-716.
[14]刘嘉湘.扶正抗癌益寿延年[J].中国中西医结合杂志,2003,23(8):614.
[15]杨运高,王程,王学良.红细胞免疫低下与肿瘤转移及活血化瘀方药的调节[J].湖南中医杂志,2004,20(6):52-54.
[16]温志震,郑彤.白血病患者红细胞免疫功能、恶性肿瘤相关物质群和端粒酶活性变化及意义[J].兰州大学学报医学版,2008,34(1):20-22.
[17]戴书新,张月君.关于红细胞在肿瘤免疫中的作用研究进展[J].中华全科医学,2008,6(8):851-852.
[18]季宇彬,汲晨锋,邹翔,等.2种仙人掌多糖对S180小鼠红细胞免疫功能影响的研究[J].中国中药杂志,2005,30 (9):690-693.
[19]狄茜,李扬,孟艳,等.前列腺癌PC-3M细胞株膜结合型唾液酸酶的活性测定与基因表达[J].吉林大学学报(医学版),2002,28(4):344-345.
[20]徐波,曾建华,钟玲.地塞米松诱导裸鼠宫颈癌移植瘤凋亡的实验研究[J].中国妇幼保健,2008,23(11):1547-1550.
Effect of Differen.Methodsof M aking M odels of Blood Stasis Syndrom e on Hepatic M etastasis in Tum or-Bearing M ouse M odels
PAN Yong-ming,YANG Yu-wei,LIU Rui-min,CHEN Liang,ZHU Ke-yan,TU Jue,HE Huan,CHEN Min-li
(Zhejiang Chinese Medical University Laboratory Animal Research Center,Hangzhou 310053,China)
ObjectiveThe aim of this study was to compare the effect of different methods of making models of blood stasis syndrome on hepatic metastasis of tumors.M ethods 60 C57BL/6J mice(female,6 weeks old)were divided into six groups equally:normal control group,non stasis group,BS1(induced by reserpine)group,BS2(induced by swimm ing and high polymer dextran)group,BS3(induced by cold coagulation and adrenalin)group,and BS4(induced by dexamethasone and adrenalin)group.Models of blood stasis syndrome were generated by different methods in the mice and then hepatic metastases were induced in C57BL/6J mice by intrasplenic injection of B16 melanoma cells.The auricular microcirculation was measured by laser Doppler flowmetry.Blood was collected and the changes of serum SA level and erythrocyte immune function were detected at 14 days after tumor cell inoculation.Changes of hepatic metastasis were also observed.Results(1)The blood flow in auricular m icrocirculation was significantly decreased in the simple tumorbearing group and other blood stasis groups(P<0.01),especially in the BS2group.(2)The erythrocyte immune function of mice were significantly lowered in the simple tumor-bearing group and other blood stasis groups(P<0.01),while serum SA contents were remarkably raised(P<0.05,P<0.01),especially in the BS2and BS3groups.(3)The hepatic metastasis incidence rate was 100%in simple tumor-bearing group,BS2and BS3groups,80%in the BS1group and 60% in the BS4group.The hepatic metastasis inhibition rates of the BS2,BS3,BS1and BS4groups were-71.76%,3.90%,16.42%and 100.6%,respectively.(4)There was a significant correlation between the weight of liver with tumor metastasis and the auricular microcirculation,red cell immune function,and SA level(P<0.05,P<0.01).ConlusionThere is an apparent effect of different methods of making models of blood stasis syndrome on the hepatic metastasis in B16melanoma-bearing mice.The change of erythrocyte immune function seems to be also related to this effect.It is also correlated with the decrease of erythrocyte immune function.Therefore,attention should be paid to select appropriate model of blood stasis syndrome in particular studies.
Blood stasis syndrome;B16 melanoma cells;Hepatic metastasis;Erythrocyte immune function;Mice
R-332
A
1005-4847(2010)04-0326-05
2009-12-28
浙江省教育厅科研基金项目(20071093);浙江省卫生高层次创新人才培养工程项目。
潘永明(1979-),男,助理研究员,从事实验动物和动物实验教学科研工作。E-mail:pym918@126.com
陈民利(1963-),女,教授,研究方向:实验动物与比较医学。Email:minlichen01@yahoo.com.cn
——护肾

