兰索拉唑片的制备工艺筛选及研究
符永红,莫文纹,卢芳梅,林白云
(海南凯健制药有限公司,海南 海口 571000)
兰索拉唑片的制备工艺筛选及研究
符永红,莫文纹,卢芳梅,林白云
(海南凯健制药有限公司,海南 海口 571000)
目的 研究兰索拉唑片的处方工艺,并进行筛选及释放度、溶出度测定,稳定性考察。方法采用反相 HPLC法测定含量和释放度测定法。结果 采用辅料制成空白颗粒与兰索拉唑原料混合压片制成的片剂比较质量稳定。结论 本品工艺成熟,质量稳定。
兰索拉唑片;工艺筛选;空白颗粒压片;稳定性
兰索拉唑(Lansoprazole)为新型抑制胃酸分泌的药物,对幽门螺杆菌也有抑制作用,在保护和促进胃黏膜溃疡愈合、降低溃疡复发率等方面具有良好作用[1-2]。因为兰索拉唑原料及片剂对光、热、湿比较敏感,本文通过对兰索拉唑片的处方工艺筛选、释放度、溶出度测定和稳定性考察等,为选择合适的处方工艺提供依据。
1 设备、仪器试剂与药品
1.1 设备 F-20B万能粉碎机,ZS-350漩涡振荡筛,GHL-250高速混合机,FL-120型沸腾干燥机,ZP-35D型旋转式压片机,BG-150D型高效包衣机。
1.2 仪器与试剂 岛津 LC-10ATVP高效液相色谱仪系统:LC-10ATVP泵,SPD-10ATVP检测器,Class-色谱数据处理仪,梅特勒电子天平,ZRS-8G智能溶出试验仪,岛津 UV-2450紫外分光光度计。兰索拉唑对照品(含量 99.8%)、原料及片剂(15 mg/片)为海南凯健制药厂研发部合成室和生产管理部提供;甲醇为色谱纯,其他试剂为分析纯。
1.3 药品 兰索拉唑对照品(中国药品生物制品检定所提供),乳糖(荷兰 DMO),预胶化淀粉(湖州展望药业有限公司),交联羧甲基纤维素钠(德国JRS),硬脂酸镁(湖州展望药业有限公司),包衣粉(上海卡乐康包衣技术有限公司)。
2 实验方法
2.1 制备工艺及处方筛选 兰索拉唑对酸极不稳定,在湿、热条件下其稳定性也受一定的影响。从制剂处方及工艺考虑,应避免酸、湿、热对兰索拉唑的影响,因此本工艺采用空白辅料制粒再与原料混合,以避免湿法制粒和干法制粒条件下的湿、热对原料的影响,从而提高片剂的稳定性。兰索拉唑几乎不溶于水,故采用水溶性辅料乳糖为填充剂[3],以提高溶出度。交联羧甲基纤维素钠为崩解剂,硬脂酸镁为润滑剂。制备工艺:兰索拉唑过 80目筛备用。辅料过 80目筛后混合均匀(硬脂酸镁除外),混粉加水,过20目筛制粒,湿颗粒干燥至干燥失重:2%-5%之间,用18目整粒。颗粒外加硬脂酸镁和兰索拉唑总混均匀取样检测,按照颗粒含量用 Ф7 mm浅凹冲压片。我们采用下述辅料进行处方试制与筛选工作,处方组成见表1。
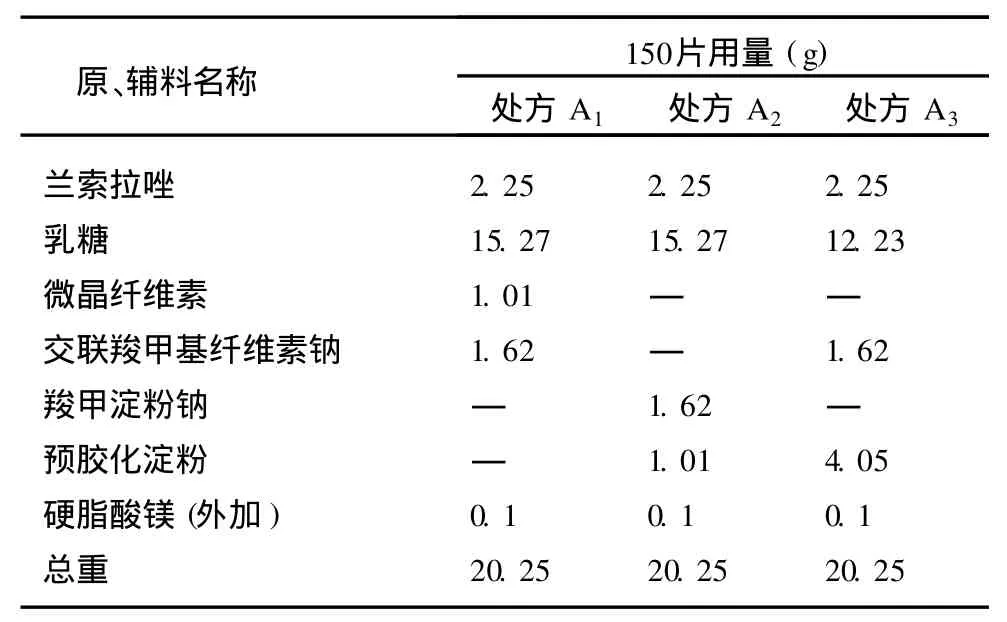
表1 兰索拉唑片(片芯)处方组成
2.2 方法 本品为肠溶制剂,按中国药典 2000年版附录 XI XD缓释、控释制剂指导原则及兰索拉唑片的中华人民共和国卫生部标准(试行)[WS-135(X-107)-98],选择在 PH6.8磷酸盐缓冲液中考察片芯溶出度[4],采用中国药典 2000年版二部附录 XC第一法,PH 6.8磷酸盐缓冲液1 000 ml为溶剂,转速为 100 r/min,分别于 20 min、45 min取样,按紫外分光光度法在 284 nm的波长处测定吸收度,计算溶出量。以片芯的外观性状、崩解及溶出度检查项为指标,考察处方性质,结果见表2。3个处方检测结果相比较,样品的各项检测结果均无明显差异,较为接近;溶出量均大于 75%,均符合中国药典2000年版附录 XI XD缓释、控释制剂指导原则对溶出量的要求。因此需对以上 3个处方进行放大批量制备,进一步进行影响因素考察,处方筛选[5]。
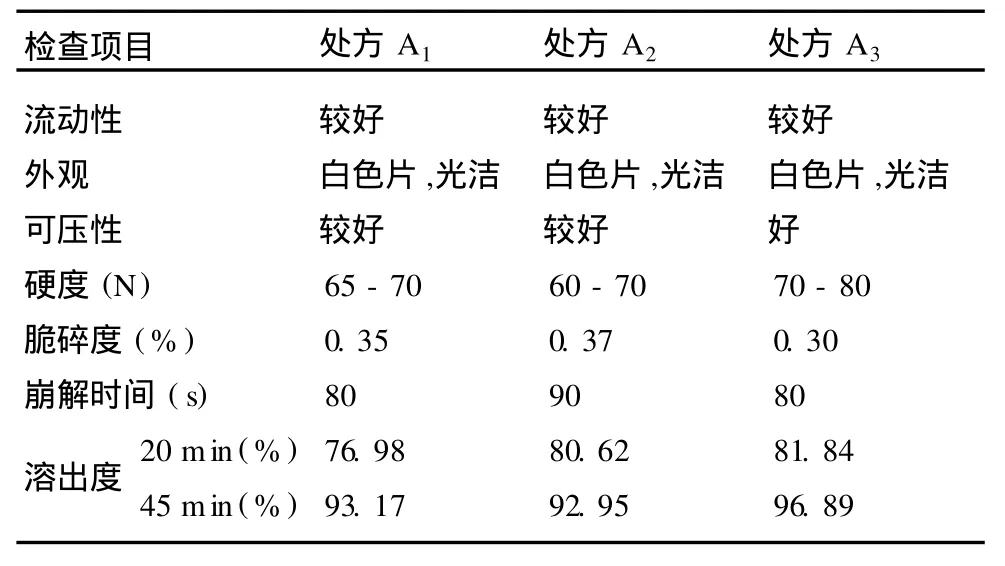
表2 兰索拉唑片片芯处方性质
2.3 包肠溶衣层增重筛选 在处方放大前进行包肠溶衣试验,以确定片剂的包衣量达到中国药典 2000年版附录 XIXD缓释、控释制剂指导原则中对肠溶片的控释要求。以处方 A1为基础进行 2000片放大,进行片剂包衣验证。按处方设计要求需对片剂进行包隔离衣及肠溶衣。采用处方 A1制备片芯,筛选肠溶衣层增重对稳定性及释放度的影响。片芯进行隔离层包衣增重 4.0%-4.5%。肠溶衣层增重分别为 3%-4%、4%-5%、5%-6%,在已包隔离衣的片芯上进行三种不同肠溶衣增重,所得肠溶衣片依次标记为 C1、C2、C3。
2.4 释放度考察 照释放度测定法[中国药典2000年版二部附录 XD第二法(二)],采用溶出度测定法(中国药典 2000年版二部附录 XC第一法),以 0.1 mol/L盐酸溶液 500 ml为溶剂,转速为每分钟 100转,依法操作,经 120 min时停转,立即将转篮升出液面,供试片不得有裂缝或崩解现象。随即将转篮浸入 PH6.8磷酸盐缓冲液 1 000 ml的溶剂中,转速不变,依法继续操作,再分别经5min、10 min、20 min、30 min、45 min、60 min,取溶液,有机系滤膜滤过,照分光光度法(中国药典 2000年版二部附录I VA)在 284 nm波长处测定吸收度;另精密秤取兰索拉唑对照品 15 mg,置 100 ml量瓶中,加乙醇10ml溶解,用 PH6.8磷酸盐缓冲液稀释至刻度 100 ml,摇匀,精密量取 1 ml,置10ml量瓶中,用 PH 6.8磷酸盐缓冲液稀释至刻度10ml,摇匀,作为对照品溶液,同法测定吸收度,计算每片的释放度,结果见表3、表4、表5。结果分析:(1)不同肠溶衣增重的 C1与C2、C3在酸中进行检测,C1于 2 h时出现衣膜破裂的现象,C2、C3酸中无破裂现象。(2)不同肠溶衣增重的 C2与 C3在酸中均衣膜完好,在 PH 6.8磷酸盐缓冲液中的释放度有区别:45 min前的取样点,C2释放度快于 C3,60 min时释放完全。(3)采用处方A1的处方组成制备的片芯,隔离层增重为 4%-5%,肠溶衣增重为 4%-5%,所得兰索拉唑片与对照片相比,释放度行为无明显区别,说明处方与工艺可行,进一步考察稳定性,进行影响因素试验。

表3 兰索拉唑片不同肠溶层增重释放度测定结果(Q%)

表4 兰索拉唑片对照片释放度测定结果

表5 兰索拉唑片酸中释放量测定结果(%)
2.5 处方放大影响因素考察进行处方筛选对以上3个处方分别放大1 000片,进行处方的影响因素考察处方筛选。处方组成见表6。制备工艺:兰索拉唑过80目筛备用。辅料过80目筛后混合均匀(硬脂酸镁除外),混粉加水,过20目筛制粒,湿颗粒干燥至干燥失重为3%-5%之间,用18目整粒。颗粒外加硬脂酸镁和兰索拉唑总混均匀取样检测,按照颗粒含量用 Ф7 mm浅凹冲压片。片芯包隔离衣(控制增重 4%-5%)、肠溶衣(控制增重4%-5%)、干燥后进行影响因素试验。试验条件—高温60℃:包衣片放于塑料瓶中,放60℃烘箱内试验,分别于第5天、第10天取样检测;高湿 RH 92.5%饱和硝酸钾水溶液:包衣片放于塑料瓶中,放于RH 92.5%箱内试验,分别于第5天、第10天取样检测;光照试验(4 500+500)lx低温光照仪:包衣片放于表面皿中,分别于第5天、第10天取样检测。本品为肠溶制剂,所以在PH 6.8磷酸盐缓冲液中考察包衣片溶出度,采用中国药典2000年版二部附录 XC第一法,PH 6.8磷酸盐缓冲液1 000 ml为溶剂,转速为100 r/min,分别于45 min取样,按紫外分光光度法在284 nm的波长处测定吸收度,计算溶出量。检测结果分析:
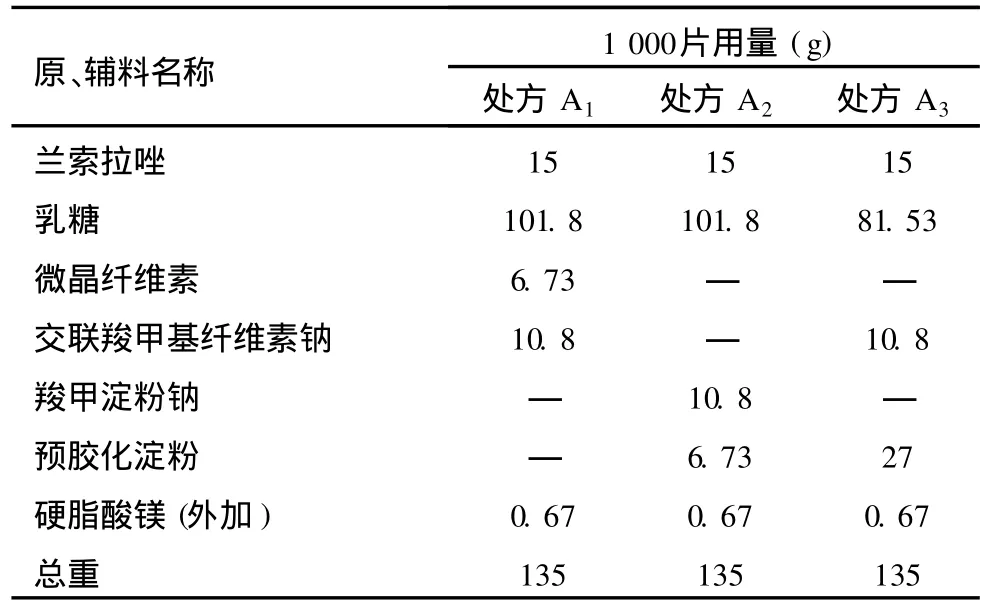
表6 兰索拉唑片影响因素试验处方筛选
2.5.1 有关物质检测0d检测结果:A1、A2、A3处方检测结果相近,无明显差异。60℃5 d检测结果:A1较高达 1.60%,明显高于 A2、A3,A2、A3无明显差异,略比0d偏高。60℃10 d检测结果:A1较高达 2.28%,明显高于 A2、A3,A2、A3有显著增长。RH 92.5% 高湿5d检测结果:A1、A2、A3均无明显增长。RH 92.5%高湿10d检测结果:A1、A2有显著增长,A3略有增长但不明显。光照试验5d检测结果:A1、A2、A3处方有关物质无明显变化。光照试验10d检测结果:A1、A2略有增长,其中 A1增长较大,A3处方有关物质无明显变化。
2.5.2 崩解时限检测 A1、A2、A3处方经影响因素试验后,其崩解时间与0d样品崩解时间相比较均无明显的变化。
2.5.3 溶出度检测0d检测结果:A1、A2处方溶出度相比较略低,差异较大。A3处方溶出量较A1、A2处方溶出量高。60℃5d检测结果:A1、A2溶出度较0d相比较无明显变化,但不高,A3与0d相比较有较明显的降低。60℃10 d检测结果:A1、A2、A3溶出度均略有下降,并且溶出量基本一致。RH 92.5%高湿5d检测结果:A1、A2、A3溶出量均无明显变化。RH 92.5%高湿10d检测结果:A1、A2、A3溶出量均无明显变化。光照试验5d检测结果:A1、A2、A3溶出度与0d相比较无明显变化。光照试验10 d检测结果:A1、A2、A3溶出度与0d相比较无明显变化。
2.5.4 结果分析 从以上影响因素试验检测结果分析,A3处方较 A1、A2处方稳定。其0d溶出度较高,而 A1、A2溶出度较低。经影响因素试验后,A3处方在高温 60℃的溶出度略有下降,其他均无明显变化。有关物质检测结果表明,A3处方在高温60℃试验中略有增加,与 A1、A2处方相比较增长较小。在其他状况下其变化值不大。以上 3个处方试验检测结果进行分析比较,我们认为 A3处方可作为最终的放大处方。
2.6 影响因素试验 试验样品、要求及批号:按 A3处方进行兰索拉唑片制备,批号:030901,按中国药典 2000年版二部附录药物稳定性指导原则,分别在照度(4 500±500)lx、(60±2)℃以及相对湿度 92.5%的条件下进行影响因素试验。强光照射试验:将试验样品置于 LS-2000A型低温光照仪中,照度维持在(4 500±500)lx,分别于第 5天和第 10天取样检查,结果为:外观性状和有关物质与0d相比无变化。高温试验:将试验样品置于玻璃平皿中,60℃的恒温箱中放置10d,于第 5天和第 10天取样,进行检测。结果:除含量没有变化外,外观性状、增失重、有关物质均有明显变化。高湿度试验:将试验样品放入平皿中,置于相对湿度 92.5%的环境中(含饱和 KNO3溶液的干燥器中),于 25℃下放置10d,于第 5天和第 10天取样,进行各项检查。经 60°C放置10d后,兰索拉唑片的含量、释放度未见明显改变,片子颜色加深,有关物质有增加趋势,表明本品应置阴凉处保存;在高湿环境中放置10d后,兰索拉唑片的含量、释放度均未见明显改变,但片子衣膜吸湿,发黏,变为浅粉色,有关物质有增加趋势,提示兰索拉唑片应采用防潮包装材料,并在干燥条件下保存;在光照条件下放置10d后,外观、释放度、含量检测结果均无明显改变,有关物质略有增加,说明本品应遮光保存。试验中有关物质的 HLPC图谱未附。结论:经初步的稳定性考察,表明兰索拉唑片对湿、热均较敏感,片子吸湿衣膜发黏,提示应采用防潮的包装材料,在阴凉干燥处密封保存。稳定性进一步考察结果见长期试验和加速试验。
2.7 放大试验及处方工艺考察 采用处方 A3的原、辅料组成与制备工艺,进行三批放大试验,每批按10 000片投料,批号 031001、031002、031003。以实际产品数量与理论产量相比计算收率,三批放大试验的收率分别为 85.68%、84.98%、84.98%。三批放大样品释放度检验结果表明,批与批之间重现性好,同批个体差异小,45 min释放度大于 75%,60 min释放完全,符合药典要求,说明制剂的组方合理,采用乳糖与预胶化淀粉制成空白颗粒工艺稳定。分别对3个处方进行进一步考察稳定性,进行影响因素试验,根据实验结果,最后选择处方 A3作为兰索拉唑片的确定处方。
3 结 论
采用乳糖与预胶化淀粉制成空白颗粒后再与处方中的原料及硬脂酸镁直接混合均匀后压片的工艺简单、可行,且避免了兰索拉唑原料与辅料混合湿法制粒对湿、热和光的影响和干法制粒对热的影响;使用本工艺能更好的保证兰索拉唑片的质量稳定。
[1]Hideain,Nobuhiroi,Hiroshis.Differences in the anti-secrerory action of the proton-j pump in hibitorAG21749(lansoprazole)and the his tamine H2receptor antagonist famotidine in rats and dogs[J].Japan J Pharmacol,1991,55∶425.
[2]Omoyuki I,Hiroshis,MasafumiN,et al.Lansoprazole a novel benzi midazole proton pump inhibitor and its relared compounds have selective activity against helicobacta pylori[J].Antimicrob Agents Chemothe,1991,3∶490.
[3]庄意冰,黄息芳,彭 玲,等.兰索拉唑肠溶片的研究[J].中国药学杂志,1999,34(3)∶169-171.
[4]曾小耘,郑若纯,庄静波,等.兰索拉唑肠溶片及肠溶胶囊溶出度的比较[J].中国药房,2001,12(3)∶171.
[5]张正全,胡海英,邓基伟,等.兰索拉唑肠溶片处方及工艺的改进[J].华西药学杂志,2007,22(6)∶643-645.
R975+.2
A
1003—6350(2010)15—105—04
2010-03-10)
符永红(1976—),女,海南省定安县人,制药工程师,学士。
