白色念珠菌天冬氨酸蛋白酶重组蛋白的表达及纯化
王一存,苏全平,槐艳艳,王 丽
(东北师范大学生命科学学院,吉林长春130024)
白色念珠菌天冬氨酸蛋白酶重组蛋白的表达及纯化
王一存,苏全平,槐艳艳,王 丽
(东北师范大学生命科学学院,吉林长春130024)
以白色念珠菌为实验材料,利用玻璃珠破碎法、PCR技术克隆白色念珠菌天冬氨酸蛋白酶基因,根据基因重组技术构建Sap2原核表达载体,使之表达蛋白并且将目的蛋白纯化.将获得的Sap2蛋白免疫兔子,进行Western blot分析,研究了白色念珠菌天冬酰胺蛋白酶的免疫学原性.
白色念珠菌;Sap2;原核表达载体;Western blot
0 引言
白色念珠菌(Candida albicans)是寄生于正常人口腔、上呼吸道、肠道及阴道的正常菌群,一般在正常机体中数量较少,不会引起疾病,但当机体免疫功能下降或正常菌群相互制约作用失调,白色念珠菌会大量繁殖并侵入深层组织,引起系统性白色念珠菌感染[1].
近年来白色念珠菌致病性的研究已取得了很大进展,其中分泌性天冬氨酸蛋白酶(secreted aspartyl proteinase,Sap)是近年来的研究热点,Sap产量高的白色念珠菌株对黏膜上皮细胞的粘附性比产量低的菌株高.天冬氨酸蛋白酶家族共包括10个家族成员Sap1~Sap10,分别由10个基因编码[2-4].在感染进展的不同阶段白色念珠菌合成和分泌的Sap类型有所不同,当侵入到机体深部或者血液系统时,合成和分泌的Sap2明显高于其他成员.Sap2其相对分子量质量为41000,能降解多种人体蛋白,去除宿主的防御屏障作用,有助于白色念珠菌的传播,还能刺激细胞产生多种细胞因子.
白色念珠菌SAP2基因没有内含子,本研究利用 PCR方法直接从白色念珠菌基因组中获得SAP2序列,利用PET-28质粒构建杂合质粒,经诱导表达的蛋白含有组氨酸标签,可通过镍柱纯化重组蛋白,然后再检测重组蛋白免疫动物的情况,为下一步研究Sap2的功能奠定基础.
1 材料与方法
1.1 材料
E.coL iDH5α,E.coL iBL21,PET-28,白色念珠菌Candida albicans,均由本实验室保存.
1.2 主要试剂
限制性内切酶EcoR I/Xho I,T4DNA连接酶,Taq DNA poLymerase购自 Takara公司;dN TP IPTG为Sigma公司产品,咪唑为BBI公司产品.
1.3 实验方法
1.3.1 白色念珠菌SAP2基因的提取
(1)白色念珠菌DNA的提取.离心收集1.5 mL过夜培养的菌体,将细胞悬浮于50μL STES缓冲液中,向其中加入等体积酸洗过的玻璃珠后每管加入20μL TE,再加入等体积混合的酚-氯仿60μL振荡1 min.12000 r/min离心5 min,收集上清0℃乙醇沉淀15 min,4℃12000 r/min离心10 min,70%乙醇洗涤干燥15 min,40μL TE溶解,电泳检验[5].
(2)PCR获得目的序列.根据SAP2的序列设计引物,根据PET-28的酶切位点图谱分析,内侧引物上游设计为EcoR I的酶切位点GAATTC,下游设计为Xho I的酶切位点CTCGAG.
外侧上游引物:GTTGATTCCTCTTGGTTGA;
外测下游引物:TTTATTCCACCCCTTCATCTTA.
内侧上游引物:GCCGGAATTCCAAGCTGTCCCAGTGACTTT;内侧下游引物:GCCGCTCGAGGGTCAAGGCA GAAATACTGG.
PCR体系为:第一轮RCR反应体系:ExTaq 12.5μL,外侧上下游引物各1μL,白色念珠菌DNA3 μL,超纯水7.5μL,依次按以下步骤操作:预变性94℃4 min,94℃1 min,53℃40 s,72℃1.5 min,30个循环,72℃10 min.然后以第一轮PCR的反应产物为模板进行第二轮PCR,反应体系为:ExTaq 12.5 μL,内侧上下游引物各1μL,模板2μL,超纯水8.5μL,按照相同的条件进行PCR反应,1%琼脂糖凝胶电泳检验,回收SAP2,并用Eco R I和Xho I双酶切.
1.3.2 SAP2重组质粒的构建
将PET-28菌种接入LB培养基中,37℃培养过夜,常规方法提取质粒,37℃EcoR I和Xho I双酶切3 h,1%琼脂糖凝胶电泳证明酶切完全后,利用胶回收试剂盒回收完全切开的载体[6].
将经过双酶切的SAP2片段和载体片段以3∶1(体积比)的比例16℃过夜连接,形成SAP2和PET-28重组质粒.
1.3.3 感受态细胞的制备及转化
(1)感受态细胞的制备.从平板上挑取新活化的 E.coliDH5α单菌落,接种于4 mL LB液体培养基中,37℃条件下100 r/min振荡培养过夜.取1 mL培养液转入100 mL LB中,37℃振荡培养至对数生长期D(600)≈0.5,将培养液转入50 mL离心管中,冰上放置10 min.4℃条件下,5000 r/min离心10 min,弃上清.加入10 mL冰预冷的0.1 mol/L的CaCl2,用移液枪轻轻吹打,使细胞悬浮.然后4℃, 5000 r/min离心10 min,弃上清.再加入4 mL冰预冷的0.1 mol/L的CaCl2溶液,轻轻悬浮细胞.将制备的感受态细胞200μL加入50μL甘油,混匀,-80℃保存备用.E.coliBL21感受态细胞以同样的方法制备并保存.
(2)重组质粒的转化.将连接产物加入到感受态细胞中,用移液枪轻轻吹打均匀,置于冰上30 min, 42℃水浴热激1.5 min,冰上放置1~2 min,然后加入800μL的LB培养基,150 r/min,37℃振荡培养1 h.最后,3000 r/min离心5 min,扔掉部分上清,用移液枪轻轻吹打均匀,使细菌充分悬浮后均匀涂布于含 Kan的筛选平板上.37℃倒置过夜培养.
1.3.4 重组质粒的筛选鉴定
挑单克隆,接种于4 mL LB培养液中100 r/min 37℃过夜培养,次日小量提取质粒,用EcoR I、Xho I酶切后琼脂糖凝胶电泳,初步鉴定为阳性克隆.筛选的阳性克隆送上海生工生物工程技术服务有限公司测序.
1.3.5 SAP2基因的诱导表达
用测序正确的重组质粒转化 E.coliBL21.挑取单克隆保存菌液,并进行重组蛋白的表达.取20μL菌种,加入含100μg/mL Kan 4 mL的LB培养基中,100 r/min 37℃过夜培养,以1∶100的比例(体积比)将上述菌液加入到含100μg/mL Kan的LB培养基中,200 r/min培养3 h,摇菌至D(600)≈1.0,加入IPTG至终浓度1 mmol/L分别诱导表达5 h.8000 r/min离心10 min,收集菌体,按照每毫升菌体加25μL 1×PBS进行悬浮后SDS-PAGE电泳.考马斯亮兰染色以鉴定目的蛋白是否表达.
1.3.6 Sap2蛋白的提取纯化
将20 mmol/L PBS溶解菌体沉淀后,冰浴中超声波破碎.将细菌破碎液以9000 r/min高速离心20 min,分别收集沉淀和上清液,SDS-PA GE电泳检验目的蛋白存在于上清还是沉淀中.
8 mol/L尿素溶解沉淀,过夜,9000 r/min离心20 min,10 mL PBS洗镍柱,镍柱纯化蛋白时取上清过柱,依次用20,40,100,200,500 mmol/L咪唑洗脱液5 mL洗脱并收集洗脱液,然后SDS-PAGE电泳检验,处理镍柱子使其再生.将获得的蛋白洗脱液加入到透析袋中,分别用6 mol/L尿素2 h,4 mol/L尿素2 h,2 mol/L尿素2 h,PBS 2 h进行梯度透析.硅胶干燥浓缩.
1.3.7 Western blot鉴定Sap2的免疫原性
取健康兔子血清作为阴性对照后进行两次免疫,第一次注射1 mg Sap2蛋白,两周后第二次注射0.5 mg Sap2蛋白,以免疫后的兔血清作为材料进行Western blot检验.20μg Sap210%聚丙烯酰胺凝胶电泳,80 V电转移3 h至PVDF上,印迹膜用5%(体积分数)脱脂牛奶4℃封闭过夜;1∶100(体积比)稀释的兔血清37℃孵育1 h,TBST缓冲液洗膜3次,每次10 min;1∶1000(体积比)稀释的HRP标记的羊抗兔二抗室温孵育1 h,TBST缓冲液洗膜3次,每次10 min,AEC显色.
2 结果
2.1 白色念珠菌总DNA的鉴定
提取纯净的白色念珠菌总DNA是合成高质量SAP2的关键因素.1%琼脂糖凝胶电泳证明,提取的白色念珠菌DNA质量较好,具有单一的目的条带,未见其他杂DNA污染条带.紫外分光光度计分析表明DNA的纯度较高,结果见图1.

图1 白色念珠菌的总DNA电泳图
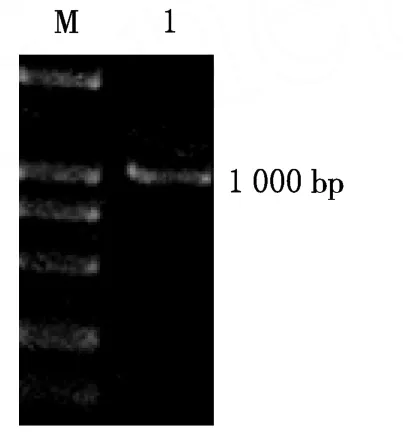
图2 SAP2DNA片段PCR扩增产物电泳图
2.2 SAP2 PCR扩增产物的鉴定
SAP2的引物在内侧引物下游添加Xho I的酶切位点CTCGAG,上游添加EcoR I的酶切位点GAATTC,以利于其正确插入载体.利用设计的引物进行巢式PCR,PCR扩增产物的电泳结果表明在1000 bp附近有一条带,片段大小与预计结果相符,见图2.
2.3 PET-28-SAP2重组质粒的构建与鉴定
PET-28序列有EcoR I的酶切位点GAATTC和Xho I的酶切位点CTCGAG.将获得的SAP2插入载体中,用此连接产物转化 E.coL iDH5α菌,挑取菌落将菌落扩增后提取质粒,经过EcoR I、Xho I双酶切鉴定,结果与预测相符.
琼脂糖凝胶电泳可见两条带,小片段在1000 bp附近,与SAP2的PCR产物位置相同,与预期的白色念珠菌SAP2基因片段大小一致.测序表明,原核表达质粒PET-28-SAP2构建正确,见图3.

图3 PET-28-SAP2双酶切鉴定电泳图
2.4 Sap2蛋白的表达及鉴定
原核表达质粒PET-28-SAP2转化BL21后,37℃条件下经IPTG诱导表达、SDS-PAGE电泳、考马斯亮兰染色后发现在转化PET-28-SAP2的细菌表达的蛋白电泳中出现一条明显的条带.SAP2目的蛋白的相对分子质量约为41000,融合蛋白的相对分子质量应该为41000左右,41000对应的位置有与预期结果相符的条带,表明融合蛋白表达成功.分别诱导1,2,3,4,5,6 h后收集菌体,经过SDS-PAGE电泳可见诱导5 h蛋白表达量最高;分别以0,0.2,0.4,0.6,0.8,1 mmol/L IPTG诱导表达5 h,确定最佳诱导浓度为0.8 mmol/L,见图4.
2.5 Sap2蛋白的纯化
将超声破碎后的裂解液离心,分别取上清和沉淀进行SDS-PAGE电泳分析,结果证明沉淀中含有重组蛋白.所以重组蛋白是以包涵体和可溶性蛋白两种形式存在的.
采用10倍镍柱床体积的20 mmol/L咪唑洗柱,用20 mmol/L PBS配制的20,40,100,200,500 mmol/L咪唑洗脱液梯度洗脱,以获得纯度较高的融合蛋白.在100和200 mmol/L咪唑洗脱时获得纯度较高的蛋白,见图5.

图5 纯化Sap2蛋白电泳图
2.6 Werstern blot鉴定Sap2的免疫原性
AEC显色可见免疫后的血清组在相应的蛋白条带位置出现了明显的棕黄色条带,而阴性对照组却未出现条带.Western blot结果表明,Sap2可刺激兔子产生特异的免疫反应,见图6.

图6 Werstern blot鉴定Sap2免疫原性图
3 讨论
免疫抑制剂、广谱抗生素、抗肿瘤药物的应用及各种器官移植手术导致临床真菌感染的发病趋势发展迅速,而念珠菌是最常见条件致病真菌,其中白色念珠菌致病性最强、感染率最高,已经成为威胁患者生命安全的重要因素.因此对于系统性白色念珠菌感染的检测以及疫苗和抗真菌治疗的研究有很高的应用价值[7].目前真菌疫苗的研究已经取得了一定的进展,其中重组亚单位或者表位疫苗DNA是白色念珠菌疫苗研究的重点.但目前缺乏有效的早期诊断和防治手段,该病仍具有较高的发病率和病死率.
本实验在前期工作的基础上,利用巢式PCR从白色念珠菌DNA中克隆了SAP2序列,在引物中设计了不同的酶切位点可以使目的基因顺利插入到载体中.从而构建了能够表达蛋白的表达质粒PET-28-SAP2,重组质粒可在宿主菌中高效表达目的蛋白.在克隆过程中,将构建好的PET-28-SAP2转入E.coliBL21,经过不同时间的诱导表达后,我们初步确定Sap2蛋白诱导表达的最适条件为:IPTG诱导5 h.目的蛋白可以在非变性的条件下用镍柱纯化,而以包涵体形式表达的蛋白需在尿素溶解后复性才能用镍柱纯化,经纯化可以得到大量的纯度较高的Sap2蛋白,为进一步研究Sap2蛋白的生物学特性、免疫原性及其在白色念珠菌感染诊断和疫苗开发中的应用奠定了基础[8].
经过Western blot验证我们得到的纯度较高的Sap2蛋白具有免疫原性,免疫的兔子血清中产生了抗体,这样就可以纯化血清中的抗体用于免疫治疗以及白色念珠菌感染的早期诊断研究.
[1] 王丽,朱筱娟.白色念珠菌热休克蛋白90[J].科学通报,1999,44(23):2476-2480.
[2] YANG QIONG,WANG LI,LU DA-NING,et al.Prophylactic vaccination with phage-displayed epitope ofC.albicanselicits protective immune responses against systemic candidiasis in C57BL/6 mice[J].Vaccine,2005,23(31):4088-4097.
[3] MONOD M,HUBE B,HESS D,et al.Differential regulation of SAP8 and SAP9,which encode two new members of the secreted aspartic proteinase family inCandida albicans.[J].Microbiology,1998,144:2731-2737.
[4] MORRISON C J,HURST S F,REISS E.Competitive binding inhibition enzyme-linked immunosorbent assay that uses the secreted aspartyl proteinase ofCandida albicansas an antigenic marker for diagnosis of disseminated candidiasis.[J].Clin Diagn Lab Immunol,2003,10(5):835-848.
[5] 杨琼,王丽.系统性白色念珠菌感染小鼠动物模型的研究[J].东北师大学报:自然科学板,2005,37(2)86-89.
[6] 卢圣栋.现代分子生物学实验技术[M].北京:中国协和医科大学出版社,1999:319-327.
[7] 杨琼,苏全平,温得中,等.系统性白色念珠菌感染的免疫应答反应及疫苗研究进展[J].生理科学进展.2006.37(3):259-262.
[8] 杨琼,苏全平,温得中,等.展示白色念珠菌HSP90的杂合噬菌体诱导C57BL/6J小鼠产生的体液免疫应答反应[J].东北师大学报:自然科学版,2006,38(4):106-109.
(责任编辑:方 林)
Expression and pruification of protein Sap2 inE.coiL
WANG Yi-cun,SU Quan-ping,HUAI Yan-yan,WANG Li
(School of Life Sciences,Northeast Normal University,Changchun 130024,China)
Total DNA was isolated fromCandida albicans,their DNA fragment of SAP2 gene were gained by nested PCR.The highly conserved co-chaperone for SAP2 was cloned into a bacterial experssion vetor PET-28.And the Sap2 protein was produced inE.colicells when it was induced by IPTG.The protein would be verified by SDS-PAGE,purified by Ni-NTA,the expressed proteins were easily purified,Sap2 can be used to show antigenicity in animal immunization
Candida albicans;Sap2;prokaryotic expression vector;Western blot
R 392.11[学科代码]180·37
A
1000-1832(2010)04-0111-05
2010-03-21
国家自然科学基金资助项目(30872365);吉林省科技发展计划项目(20080939).
王一存(1985—),女,硕士研究生;王丽(1957—),女,博士,教授,博士研究生导师,主要从事细胞生物工程研究.

