左室功能不全所致的慢性心力衰竭患者心肺运动试验声明实施和解释建议(2)
刘杰,李寿霖编译,胡大一审校
译者单位:1.首都医科大学康复医学院,北京市 100068;2.中国康复研究中心北京博爱医院心血管内科,北京市100068;3.北京大学人民医院心脏中心,北京市100044。
(接2010年第5期)
死腔通气
气道和肺内不能参与气体交换的理论气体容积构成了死腔通气(VD)。可分为“系列死腔”(以前称“解剖死腔”)和“肺泡死腔”。系列死腔大致上由口、咽和大气道的容积组成,其绝对容积基本上不随时间变化。相对于肺泡通气(VA),肺泡灌注不足或匹配不良时,肺泡死腔增加。在正常情况下,肺泡死腔的绝对容积随运动(如果心输出量迅速上升且匹配良好)而减小,但如果心输出量不能充分增加或者匹配不良时,肺泡死腔通气也可增加。
生理死腔与潮气量的比值VD/VT构成了通气-灌注匹配不良的一个指标,可通过Bohr方程进行计算:
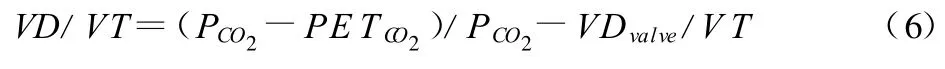
VDvalve表示面罩和气阀死腔容积。通过PETCO2对PCO2的无创评估不可靠,对经动脉采样计算的真实值估计偏低。
静息时VD/VT的范围在0.3~0.5,但运动时可降低到0.2。在肺病患者,由于肺泡的通气和灌注均有异常,比值在静息时升高而在运动时不降低。
CHF患者运动期间可能不能恰当地降低VD/VT,这可导致运动高通气。尽管未直接测定系列和肺泡死腔的成分,但它们似乎都参与了这一现象。较严重的心力衰竭患者具有更快速和更浅的呼吸形式,同时潮气末与动脉之间的PCO2也增加,表明肺泡死腔增大。肺泡死腔的增大必然来自运动期间的通气/灌注匹配不良。VE/VCO2与肺动脉高压严重程度及心输出量之间的相关性表明肺血管收缩和肺血流量减少是潜在的促成因素。肺血管张力的异常调节可导致肺内不均匀的血流分布。另外,假定心输出量的增加是血流均匀分布的主要促进因素,那么心输出量的减少将不利于运动期间血流分布的改善。
VE/VC O2斜率
VE/VCO2斜率是近年来出现的最流行的CHF评估参数,并且是最有力的CHF预后评估指标之一。从运动开始直到RER,VE与VCO2呈线性关系,之后 VE与VCO2的增加不成比例。RER前的VE/VCO2关系斜率表明感知血中PCO2变化触发通气反应的化学感受器的功能增强。研究已经显示,VE/VCO2斜率与肺死腔的增大、肺血流的减少、以及肌肉动力感受器(ergoreceptor)的激活有关。
CHF中这一斜率增高:正常值在 20~30,而在 CHF中,此值可达80左右。经训练或治疗后VE/VCO2得到改善。VE/VCO2斜率似乎比VO2peak能更好地预测预后,尤其是在以下两种情况:①次极量运动;②使用β阻滞剂治疗。通过治疗,预后得到改善,VO2peak一般保持不变或仅轻微增加,而VE/VCO2斜率降低。
VE/VCO2斜率是通过全部数据还是仅在达到RQ时进行计算,尚存在争议:使用所有的点似乎能增加预后价值。
摄氧效率斜率(the oxygen uptake efficiency slope),描述了运动期间VO2与VE对数之间的线性关系,是另一个在次极量运动时可以获得的参数。此斜率在心力衰竭时降低。
心输出量
运动时心输出量(CO)增加以满足组织代谢需求的增加。根据Fick方程(方程(1)),正常个体的 CO是VO2的线性函数。
CO最初的增加是通过SV和 HR的增加来完成的,之后在中高强度的运动中,几乎全部通过HR的增加来完成。运动期间对心率反应的评估能够对心功能做出估计。心输出量的增加主要由迷走张力降低(vagal withdrawal)和循环或神经系统中儿茶酚胺的增加所驱动。已经提议通过CPET试验间接测定运动期间的心功能(HR、HR-VO2关系、O2脉)。
心率(HR)
鉴于SV的轻微变化,根据Fick方程可以得出,HR测定应该是运动期间心功能的简易评估方法。在健康个体,HR增加与VO2的增加近似线性关系。HR的增加最初由迷走张力降低所介导,随后几乎全部通过交感神经活性的增加所介导。运动期间达到年龄预测最大心率,常看作是极量或近似极量运动的反映,提示获得了VO2max。但通常不推荐使用这一指标作为严格的运动终点。当使用最大心率进行估计时,已经注意到同一年龄组内的明显变异(10~15次/min),因此可能使解释复杂化,例如减慢心率的药物所产生的影响。
HR-VO2关系
此关系在低功率直立运动时常常不成线性,随着功率增加至最大的过程中,变为相对线性的关系。此关系可通过斜率和回归曲线的位置进行描述。HR-VO2关系是SV和C(A-V)O2的函数(见下)。在无贫血、分流和缺氧的情况下,SV越高,HR及其变化率越低。在一定的VO2下,肺病患者的HR高于正常人,提示其SV必然低于正常,因心输出量与正常个体相似。这可能反映了去适应的,或者相对非匹配的通气对运动的限制,以及动态的过度充气对血流动力学的影响。氧含量不足(缺氧、贫血、碳氧血红蛋白等)致O2运输降低的患者、O2利用异常(代谢性肌病)的患者,以及去适应患者在获得或接近最大心率时可能也具有增高而陡峭的HR-VO2关系。
O2脉(VO2/HR)
VO2与HR的比率称为“O2脉”,反映每次心跳对氧的萃取。O2脉已用于运动期间对心搏量的估计,但这种方法一直存在争议,特别是对于氧不饱和的患者。根据改良的Fick方程,O2脉在数值上等于SV与C(A-V)O2的乘积。
在正常情况下,因运动中SV与O2萃取均增加,O2脉随运动递增而增加。在接近最大功率时,假定此时C(A-V)O2最大并相对恒定,则O2脉的变化形式将与SV的变化形式相同步。在VO2与HR呈线性增加的这一范围内,O2脉的基本特征似乎是双曲线的,低功率时快速升高,随后缓慢趋向渐近线。随着功率的增加而出现的较低、无变化的平坦O2脉可能源于SV的降低或者骨骼肌对O2利用的进一步下降,或者存在运动诱发的缺血。因此,低O2脉可能反映去适应、心血管疾病以及通气限制、肺病或症状所致的过早的运动受限。
CHF患者运动中CO反应受损决定于上面提到的所有指标的变化。对运动的变时性能力不足预示预后不良:峰值运动时HR<135次/min的CHF患者与HR>144次/min的患者相比生存率下降。同样,在CHF中 HR-VO2关系斜率和 O2脉下降:运动期间HR的进行性增高未能从VO2呈比例的增高中得到充分反映。然而,这些变化对CHF无特异性,许多其他因素可能影响这些变化,例如,房室传导阻滞和治疗(β阻滞剂、钙拮抗剂)。
血压反应
随着运动强度的增加,心输出量分布的反射性控制引起血压和血管阻力的一些特征性变化。工作肌中局部的介导因子导致强烈的血管舒张,以增加血流满足代谢需要。另外,非工作肌因交感神经活性的反射性增加而引起血管收缩。最终结果是全身的血管阻力降低,但收缩压一般随VO2的增加而升高。如果左心功能能够保持心输出量的增加,舒张压一般保持不变或可能轻微降低。血压反应的异常形式包括过度升高、升高不足或降低。
血压的过度升高常见于已知的静息高血压患者,但静息血压正常时运动中血压的异常升高也提示为血压控制异常。如果血压随运动不升高或下降,则强烈提示心脏受限或血压的交感神经控制异常。如果随运动强度的增加而血压下降,应该立即停止运动试验,因为这种反应可能提示严重的异常,如心力衰竭、缺血或血流受阻(如主动脉狭窄、肺血管疾病或中心静脉阻塞)。
像CO的其他指标一样,CHF患者的血压反应受损,在进行性运动期间血压的升高不良。收缩压<120 mmHg提示运动耐量减低(VO2peak<14 ml/min·kg)并反映预后不良。影响CO指标的解释因素也影响对血压反应的解释。
第二部分 如何在慢性心力衰竭中实施心肺运动试验
该部分将强调与心肺运动试验(CPET)的仪器设备、方法学、运动方案、试验执行和质量控制等相关的基本、实用的信息。CPET使用者有责任保证测量的准确性。进行CPET,尤其是在做逐次呼吸气体交换分析时,要求一丝不苟地注意校准过程,确保测量的准确性和可重复性。对试验监督和解释、对患者准备和告知等方面的个人技能和知识是正确实施CPET的关键特征。试验完成后,检查者需要以一定的格式编排试验结果,这种格式应该能够能最大可能地鉴别反应特征,即建立关注变量的“解释集”。下文有CPET的总结性数据报告示例,阐明应该并入最终报告的最重要信息。为何要在慢性心力衰竭患者中进行心肺运动试验
在稍微用力甚或休息时出现伴有呼吸困难和乏力的运动受限是慢性心力衰竭(CHF)的主要症状。基于这些特征,目前把这一临床疾病定义为心脏和外周代偿机制被激活,以部分或完全代偿左室功能受损的综合征。左室射血分数(LVEF)减低的患者,其运动容量的范围很宽,其中一些患者的运动容量峰值接近正常。运动时乏力和呼吸困难不仅与心脏因素有关,也包括其他几种机制,如外周骨骼肌变化(即过早的肌肉酸化)的中心作用,表现为CPET的结果异常(在次极量和峰值工作负荷时VO2max降低、VE不成比例地增加)。
运动中通气的增加继发于CO2的增加。但对于相同的工作负荷和CO2生成量来说,CHF患者因呼吸频率较快而表现为更大的通气。分钟通气量/二氧化碳生成量斜率(VE/VO2斜率)是运动耐量的决定因素之一,是CHF预后的最有力预测因素之一。骨骼肌的代谢状态通过肌动力感受器的激活而受到中枢的监测。这些感受器的纤维行走于脊髓丘脑侧束,增加通气和交感传出,导致远端非运动血管床收缩,最后对血压产生影响并可能使心率轻微增加。它们对肌肉的代谢状态很敏感,但具体的触发机制尚不清楚。它们的特性必然包含骨骼肌异常与CHF中乏力、呼吸困难、过度通气和交感激活特性之间的联系。这种“骨骼肌学说”提出了与神经内分泌激活相似的另一恶化过程(图1)。左室功能的减低启动了一系列的代谢事件,导致骨骼肌的废用和骨骼肌的代谢和功能异常。
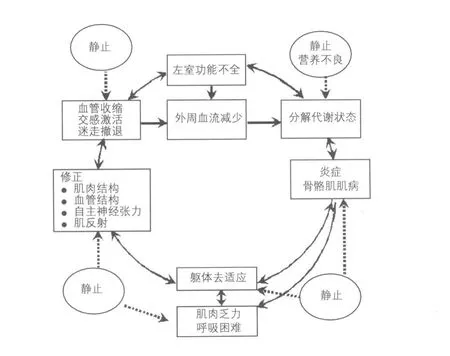
图1 慢性心力衰竭的骨骼肌学说
运动肌群过早代谢窘迫引起的反应是肌动力反射的过度激活,使患者感到肌肉乏力和呼吸困难,反射性地导致非运动血管床过度的交感驱动和运动的通气反应增加。
传统的运动心电图负荷试验对运动耐量不能提供可重复性的指标,因而引入CPET对CHF患者进行功能评估、危险分层和治疗选择。CPET的一般适应证列于表1。风险和禁忌证

表1 CPET总的适应证
一般来说,症状限制性的 CPET是相对安全的。ACC/AHA已对绝对和相对禁忌证作了修改,同时应该参考用药史和体格检查做进一步的排除(表2)。尽管在CHF患者中实施CPET常常受限于乏力或气短,但应该认识到还有其他更需要优先考虑的终点(表3)。环境条件

表2 CPET的禁忌证

急性心肌炎或心包炎急性主动脉夹层严重的矫形限制相对禁忌证(若运动的获益超过风险,可以考虑运动试验)左主干冠状动脉狭窄中度狭窄的瓣膜心脏病电解质异常严重的高血压快速或缓慢心律失常肥厚型心肌病或其他形式的流出道梗阻不能充分完成运动的精神或躯体障碍高度房室传导阻滞

表3 终止运动试验的指征
CPET实验室应该足够大,以摆放所需设备并在紧急情况下易于出入抢救患者。复苏和运动设备必须一并摆放以利于在运动设备旁立即进行心肺复苏。所有运动负荷实验室都必须配备报警装置,以便迅速召集附近人员参加抢救。表4详细列举了CPET实验室所需设备和人员。
实验室应该采光好,并有温湿度控制:需要带有温度计和湿度计的气压站来校准气体交换分析仪并控制环境条件。一般来说,22℃对运动是合适的,尽管在有新鲜空气的充分循环下可以短暂接受达26℃的运动温度。主观努力评价表应该醒目可见,以便精确界定所采取的运动的强度(表5)。类比量表可用于评价乏力、呼吸困难和下肢疼痛等症状的强度。

表4 呼吸功量计实验室:设备和人员

血压计平板或踏车测力计血压测量脉搏血氧饱和度气体交换测定容量/气流装置:容量测定和气流测定气体分析仪或质谱仪一次性材料(接口管、面罩、口水接收器、收集管、清洁材料)校准材料(大容量注射器,软管)复苏设备人员人员数目取决于测量项目和患者安全保护:医生/心内科医生和护士

表5 主观努力量表
呼吸气体交换测定设备要求一丝不苟地维护和校准以保证理想使用,由训练有素的人员实施试验并解释结果。临床实验室必须在心脏科医生的指导下工作,这些心脏科医生必须有高级心血管生命支持的证书,有运动生理学的专业知识和CPET校准、质量控制、操作和解释等方面的训练。监督和解释所需的技能和知识在ACC/AHA临床技能声明中有所陈述。技能保证所需操作次数尚未确立客观标准。对无机会接受正规CPET训练的心脏科学医生来说,可能需要3年的经验(最少150次操作)代替正规训练。为了能持续胜任CPET,要求定期、连续的操作:偶尔为之的操作可能导致解释的错误或偏差。医生为保持监督和解释的胜任而应该完成的运动试验数目尚未确立(基于循证标准)。鉴于对代谢测定进行解释所需要的数据量,试验完成后需要极其认真地进行计算机处理。ACC/AHA临床技能声明认为在临床实践中可由两名医生合作以确保恰当完成心肺运动试验:一人监督试验,一人解释结果。前者负责试验的执行,鉴于CHF患者的特点,其应该在整个试验过程都在场,以连续观察患者,在紧急情况下做出反应。后者是否在场不做严格要求。除了医生外,操作人员还包括训练合格的护士、运动生理学专家、物理治疗师或专门的医疗技师。实验室所需人员的数量取决于测量项目(运动中有创参数的评估,如乳酸血症或血气分析)和患者的临床状况。
患者准备和信息
患者的合作是优化CPET临床诊断价值所必需的。通常,如果患者有充分的告知和指导,他们将会在疾病许可的范围内做最大努力,从而提供足够的信息,获得可靠的解释。鉴于这一原因,应该对患者做仔细的准备(表6):为了从试验中获得一致的信息并尽可能减少患者的焦虑,建议给予患者书面(试验前)和口头(试验中)信息。在试验初期或预备阶段,建立简单有效的交流方式至关重要,因为患者使用了面罩和接口管后不可能进行言语表达:患者的注意力应该集中于症状水平评价表和运动强度评价表上(表5)。另外,患者还需要一定时间熟悉设备(表6)。完整的呼吸测定评估,加上最大自愿通气(MVV)测定、静息血气分析(怀疑低氧血症时)、血细胞计数和了解药物治疗均有助于对CPET做出解释(表6)。了解患者平时的活动水平有助于选择最合适的运动方案。
患者在运动前应该戒烟至少8 h。试验前2 h通常允许清淡的早餐。

表6 试验前信息:恰当实施CPET前必知信息
设备
对CPET数据的恰当解释取决于准确的数据收集和正确的计算。因此,对设备的充分认识和所采用的运动模式是理想运用CPET的基本前提。
呼出气体收集
运动中分钟通气量(VE)的测定要求患者通过鼻夹和接口管密封口鼻,使所有吸进和呼出的气体都通过呼吸阀。
经面罩或接口管进行气体采样。带鼻夹的接口管因不漏气(特别在高水平通气时)而为首选设备,但给紧张的患者带来不适,并产生过多唾液。面罩较易耐受,但在高水平运动时常难以除外漏气。
理想的呼吸阀可防止吸入和呼出气体的污染,无呼吸阻抗,死腔小,体积小重量轻,不产生涡流,易于清洁消毒,价格低廉。单阀设计均不理想。现有呼吸阀有3个口,分别接进气、出气和患者,均有死腔。死腔容积和阀阻抗之间的恰当平衡是我们所希望的:对于健康个体,因必须容纳高水平通气而适合选用低阻抗阀(具有较高的死腔通气),而对于CHF患者则可能首选具有稍高阻抗的低流速阀。
使用覆盖鼻口的面罩与使用鼻夹和接口管相比,通常有稍高的死腔。新的面罩有较低的死腔(40 ml),不易漏气,更舒适。
气流感知装置
气流感知装置产生与气流成正比的信号,再与时间整合而产生气体容量。在自动代谢计算图表中使用4种气体感知测定计:呼吸速度描记器、涡轮机、空速管和风速计(表 7)。理想的传感器必须重量轻、死腔小、运动中气流阻抗低、可防止水蒸气或唾液的影响。呼吸速度描记器、压力分辨装置
这些装置是管道内小的电阻元件。其两端与两个小的弹性塑料管相接以连接高敏压力分辨传感器。电阻元件的一系列毛细管(Fleisch型呼吸计)在有气体通过时可以产生微小的压力下降(1.2~1.3 cmH2O,1 cmH2O=98.0665 Pa),其压力分辨与通过的气流成正比。新的呼吸计相对不受位置和湿度变化的影响,在其功能范围内有不错的线性反应。3号Fleisch呼吸计因在高达5~10 L/s的气流范围内具有线性反应,因而适合健康成人和CHF患者。呼吸计的不足之处是可受气体温度变化和成分变化的影响:在环境温度下呼出气体与呼吸计的接触可产生凝集,阻塞元件小管,改变装置的校准特性,产生显著的测量误差。充分而经常地给呼吸计加温可防止这些问题。

表7 CPET设备:测定容量和流量的方法
涡轮机
在气流管道内一般使用极轻、低阻抗的旋转叶片或叶轮来测定气流。在很高气流下叶片的每一次旋转可被光电池装置检测到,光束中断的次数可被计数并相加,从而得出气体流量。涡轮机对温度、湿度和气体成分的变化相对不敏感,但可因叶片的摩擦和惯性而产生线性问题。
空速管
这是一种在液体中测定流速的装置:测量直接面向液流方向的压力和垂直于液流方向的压力(静压力),得出压力差值。根据Bernoulli定律,液体流动的速度与压力差的平方根成正比,而根据装置的横断面,可计算出液体流量。空速管的优点为非阻抗性:它们对呼吸气体成分变化的线性关系和敏感性需要复杂的矫正,以达到输出的线性化。
风速计(质流传感器)
它们依赖于气体层流产生的冷却作用。气体通过极薄的加热导线,导线的温度与气体的质量和流量成比例地下降,需要通过反馈电路提供更多的电流以维持导线在恒定的预设温度。所供应的电流与气流成正比,整合时间后得出气流量。
气体分析仪
可以精确测定氧耗量,包括氧(用力呼气氧浓度,FEO2)和二氧化碳(用力呼气二氧化碳浓度,FECO2)的分浓度。
质谱仪
这是一种极快、极精确的分析装置,但由于昂贵、体大和维护等原因,在许多实验室不可能使用。所采样的气体通过电子束转变为带正电荷的离子,电子束在电场中加速并受磁场环境的支配:磁场中离子的方向取决于它们的质量/电荷比率。不同的离子代表着不同的气体,可被适当定位的检测器所检测,每一检测器均产生高电压输出,与单位时间内撞击集电极的离子数目成正比。
氧气分析仪
根据不同的原理,现代代谢计算表中常用3种氧气分析仪。
通过设计极谱电极或直流电“燃料电池”,产生与氧气压力成比例的稳定电流:这些电极很小,适用于便携系统,但寿命短(6~12个月),存在某些稳定性问题。
顺磁分析仪是目前最常用的类型,利用氧的顺磁特性,使悬挂于磁场中的充氮玻璃哑铃旋转。旋转的量或者说消除这种旋转所需的电流与采样氧浓度有直接的比例关系。这些分析仪稳定,几乎不需维护保养,在逐次呼吸研究中反应迅速。
氧化锆燃料电池使用电化直流电池,由带多孔铂金的钙稳定氧化电解溶液组成。多孔铂金是一种选择性通过氧离子的半透膜。这些分析仪精确稳定,很少需要保养。
二氧化碳分析仪
最现代的分析仪依赖二氧化碳吸收红外线的事实。红外光通过含有一定量二氧化碳的小室,传递的光量与已知定值比较。差值与采样中二氧化碳的分浓度成比例关系。
代谢测定技术
现有3种评估分钟通气量(VE)、摄氧量(VO2)和二氧化碳生成量(VCO2)的方法:Douglas袋、混合室和逐次呼吸模式(表8)。
袋收集
为金标准。可使用简单设备进行,需要大的气体容量进行测定(采用容量可变袋,通常容量为100~300 L),评估气体浓度不需分析者的快速反应。基本技术包括收集呼出气体进入收集袋,一定时间后,测定氧耗和二氧化碳的浓度,计算 VO2和VCO2。

表8 CPET设备:代谢测定方法
混合室
呼出气体通过带有障板的小室(通常为5~15 L),采用上述的气流设备在混合室远端连续测定O2和CO2的浓度,呼出气的平均(每15~20 s)浓度和相应的容量用于计算VO2和VCO2,经30~60 s做平均值。对于递增运动试验来说,VE和呼出O2和CO2浓度变化缓慢,因此,设计良好、固定容量的混合室的精确性和忠实性可与逐次呼吸系统相当。
逐次呼吸法
这种方法在每次呼吸期间对气流和浓度采样,获得每次呼吸的O2和CO2吸入和呼出容量。计算每次呼吸的CO2生成量和摄O2量,经一定时间累计所有呼吸的测定量,报告出VO2和VCO2。为得到精确的结果,必须尽可能连续地测定VE和气体浓度。流量测定几乎可以瞬时进行,而气体浓度信号因需要气体沿采样管传送到仪器而有些延迟。在进行逐次呼吸整合时,临时重调气体浓度和流量信号是很重要的。逐次呼吸的数据收集和分析最受关注:这一方法的可信性取决于为校正(每一测定变量的)联合测量误差所建立和实施的规则系统。
气体交换测定和计算
袋收集、混合室和逐次呼吸法均采用同一套计算VO2和VCO2的基本方程,即:

VI、VE表示同步收集的气体(吸入和呼出)容量,FIO2和FEO2分别表示吸入和“混合”呼出气体的 O2浓度,t表示气体容量测定的时间。此方程既有吸入又有呼出气体容量,但其中仅一种需要测定,通常为呼出容量:
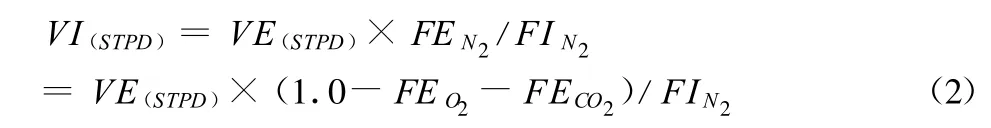
FIN2为吸入N2浓度,FEN2为混合呼出 N2浓度(袋内),STPD表示标准化至标准温度(0℃)、海平面气压(101.3 kPa)和干燥空气。
校准操作和质量控制
气体交换分析是一项不完美的科学。如果不遵循一定的操作则会产生相当大的误差。导致CPET结果错误的两个主要原因是校准错误和漏气。为确保获得的数据有效,技师必须具备气体交换分析的基本技能,必须维护质量控制,并有能力发现错误和错误的潜在原因。应该在试验前的校准中、试验期间和解释结果时识别错误。也应该考虑厂家提供技术服务的能力,即便是有经验的使用者有时也会发现需要与公司服务部联系以获得帮助。在购买代谢系统的谈判中务必包括服务合同。
定期质量控制试验常常先假定代谢测定装置和测力计处于正常工作状态。例如,常常通过给正常人做运动试验,将给定强度下测定的呼出气体和容量与该工作强度下的预计值相比较来判断代谢系统的有效性。如果测力计未恰当校准,则会在代谢测定中发现“错误”。
好的做法是每天都对系统进行校准,并编写校准手册,从而发现远期趋势。校准报告应该包括周围环境论证,以及气流仪、O2和CO2分析仪的精确性(表9)。每天的校准可从测定周围的大气压、温度和相对湿度开始,因此实验室必须有气压计、温度计和湿度计。CPET前对容量、气流设备和气体分析仪的校准操作报告列于表10。尚需进行其他的校准操作,只是不那么频繁。踏车测力计和平板机应每年校准。

表9 校准报告中应包括的信息
对静止期的分析很重要,可提供一些深入的认识。在测定气体交换时需要静止等待3~4 min以保证获得稳定状态。基线VO2应该介于3~5 ml/min·kg之间,但在严重心力衰竭患者中可发现更低的值,如果通气正确通过,则呼吸交换比(RER)应该低于0.90。在这一阶段可以观察到通气振荡,这是周期性呼吸的结果,总是与严重的循环衰竭和/或肺动脉高压有关。机制尚不很清楚,但似乎与极低的氧运输动力学和化学反射的刺激增加有关。在功率增加的过程中,通气振荡趋于减弱或消失。

表10 CPET前的校准操作
(未完,待续)

