氢醌对人骨髓单个核细胞TOPO Ⅱα表达的影响及其可能机制
施益芬,俞康,陈怡,任行洲,毕来喜,钱红兰
(温州医学院附属第一医院 血液科,浙江 温州 325000)
氢醌对人骨髓单个核细胞TOPO Ⅱα表达的影响及其可能机制
施益芬,俞康,陈怡,任行洲,毕来喜,钱红兰
(温州医学院附属第一医院 血液科,浙江 温州 325000)
目的:观察苯代谢物氢醌(hydroquinone,HQ)对人骨髓单个核细胞拓扑异构酶Ⅱα(TOPO Ⅱα)表达的影响,探讨TOPO Ⅱα在HQ所致造血毒性中的作用及其调控机制。方法:50μmol/L HQ培养10 h的正常人骨髓单个核细胞设为实验组,等体积灭菌蒸馏水培养10 h为对照组。Western blot测定TOPOⅡα含量的变化,RT-PCR测定TOPOⅡαmRNA表达水平的改变,ChIP技术观察HQ对骨髓单个核细胞TOPOⅡα启动子组蛋白乙酰化、甲基化水平的影响。结果:①与对照组相比,人骨髓单个核细胞50μmol/L HQ处理10 h后,TOPOⅡα含量、TOPOⅡαmRNA水平明显下降,差异有显著性(P<0.01);②TOPOⅡα含量降低伴随着TOPOⅡα启动子组蛋白H4乙酰化、组蛋白H3K4甲基化水平的明显降低(P<0.01)、组蛋白H3K9甲基化水平升高(P<0.05),不伴有组蛋白H3乙酰化水平的改变(P>0.05)。结论:HQ能抑制造血细胞TOPOⅡα的表达;组蛋白化学修饰可能在苯代谢物所致的造血毒性中发挥一定的作用。
氢醌类;拓扑异构酶Ⅱα;组蛋白乙酰化;组蛋白甲基化;染色质免疫沉淀分析
苯是明确的职业致癌物之一。苯诱发的造血系统疾病发病率高。尽管苯所致造血毒性已得到广泛重视,但其毒性机制仍未阐明。近年来,拓扑异构酶在苯致造血毒性中的作用日益受到关注[1-2]。氢醌(hydroquinone,HQ)是苯在体内的主要代谢产物之一,因此,利用HQ研究苯造血毒性机制,探讨拓扑异构酶IIα(TOPOIIα)在HQ所致造血毒性中的作用及其调控机制具有十分重要的意义。
1 材料和方法
1.1 研究对象正常志愿者捐献的骨髓20份。志愿者年龄20~35岁,平均27岁,其中男11例,女9例。本研究已通过温州医学院附属第一医院伦理委员会的认证。所有骨髓捐献者均签署知情同意书。1.2实验材料TOPOIIα检测试剂盒、兔抗人TOPOIIα抗体(美国TopoGen公司),SuperECL Plus Western Blot超敏发光液、BCA蛋白浓度测定试剂盒(美国Pierce公司),ChIP assay kit、抗乙酰化组蛋白H3抗体、抗乙酰化组蛋白H4抗体 (美国Upstate公司),37%甲醛(美国Sigma公司),1,4-氢醌AR(上海凌峰化学试剂有限公司),HQ先以10 mL灭菌双蒸水溶解,配制成0.1 mol/L的原溶液,灭菌后4 ℃冰箱避光保存。
1.3 实验方法
1.3.1细胞培养:取健康志愿献髓员的骨髓5 mL,肝素抗凝(50 U/mL),淋巴细胞分离液密度梯度离心法分离制备成单个核细胞悬液。台盼兰染色检测活细胞率,要求拒染率达95%以上。骨髓单个核细胞悬浮培养,调整细胞终浓度为1×106/mL。培养液为体积分数为10%胎牛血清的RPMI-1640培养液。37 ℃、5% CO2饱和湿度条件下培养。
1.3.2实验分组:培养板各孔均加入2×1640液2 mL、胎牛血清液0.4 mL、灭菌双蒸水1.48 mL、分离制备的骨髓单个核细胞4×106。实验组加入用灭菌双蒸水稀释60倍后的终浓度为50μmol/L的HQ溶液120 μL,对照组加入等量的灭菌双蒸水(设立平行样,各实验组及对照组的标本为同一来源)。培养10 h 后,等渗PBS液洗2遍,调整细胞浓度为1×106/mL备用。1.3.3核蛋白的提取:收集骨髓单个核细胞(3× 107~5×107)(注:因细胞需要量大,标本为多个同组标本收集后混合),加入1 mL冰冷的buffer A(10 mmol/L Hepes,pH 7.9,10 mmol/L KCl,0.1 mmol/L EDTA,0.1 mmol/L EGTA,0.5 mmol/L PMSF),冰上裂解15 min,加入62.5μL质量分数为20% NP-40,剧烈震荡15 s,10000 r/min离心30 s,核沉淀重悬于50μL冰冷的buffer B(20 mM Hepes,pH 7.9,0.4 M NaCl,1 mmol/L EDTA,1 mmol/L EGTA,1 mmol/L PMSF),剧烈震荡15 min,4 ℃15000 r/min 离心5 min,上清液即核蛋白提取液,-70 ℃保存。
1.3.4Western blot分析:参照文献[3],用SDS聚丙烯酰胺凝胶电泳分离变性核蛋白100μg,转膜(生物素化的蛋白Ladder同时电泳转膜,为评估待测蛋白的分子量提供标准),抗体孵育显色后分析结果,实验重复3次。1.3.5RT-PCR检测:①RNA的提取及cDNA合成:采用Trizol法提取各实验组及对照组细胞总RNA,采用随机引物法合成cDNA。②PCR扩增TOPOIIα:上游:5’-TGC CTGTTT AGT CGC TTT C-3’,下游:5’-GGG TCC CTTTGT TTG TTG T-3’,产物349 bp,引物与GenBank基因序列核对无误,采用β2微球蛋白(上游:5’-ACC CCC ACT GAA AAA GAT GA-3’,下游:5’-ATC TTC AAA CCT CCA TGA TG-3’,产物115 bp)作为内参照,进行PCR扩增。扩增条件:95 ℃ 10 min预变性,TOPOIIα:95 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,35个循环后,72 ℃延伸10 min。经1.5%琼脂糖凝胶电泳后,美国ST公司AlphaImager TM1200型读胶仪读取扩增条带的光密度值进行分析,以目标基因与β2微球蛋白扩增产物的光密度值的比值计算表达水平,实验重复3次。1.3.6染色质免疫沉淀分析法:ChIP检测用ChIP分析试剂盒,按产品说明书进行。经预处理的细胞用终浓度为1%的甲酰胺固定10 min,使转录因子与DNA交联,细胞裂解液破膜后,用超声将DNA打碎成250~1000 bp大小(此处提取的DNA片段命名为input DNA)。用特异性抗体(抗乙酰化组蛋白H3抗体、抗乙酰化组蛋白H4抗体)沉淀DNA-蛋白复合物,用蛋白A琼脂吸附复合物,经洗去非特异性吸附后,解交联,沉淀的DNA片段-20 ℃保存备用(此DNA片段命名为ChIPed DNA)。用IgG抗体作为阴性对照,实验重复3次。
1.4 统计学处理方法采用t检验。
2 结果
2.1 HQ对骨髓单个核细胞TOPOIIα含量的影响HQ处理后,TOPOIIα含量较对照组明显降低,差异有显著性(P<0.01),见图1、表1。
表1两组TOPOIIα蛋白含量、TOPOIIαmRNA含量的比较(±s,n=3)

表1两组TOPOIIα蛋白含量、TOPOIIαmRNA含量的比较(±s,n=3)
与对照组比:**P<0.01
骨髓单个核细胞对照组实验组t TOPOIIα蛋白0.983±0.029 0.017±0.029** 41.012 TOPOIIαmRNA 2.833±0.208 0.610±0.128** 15.770
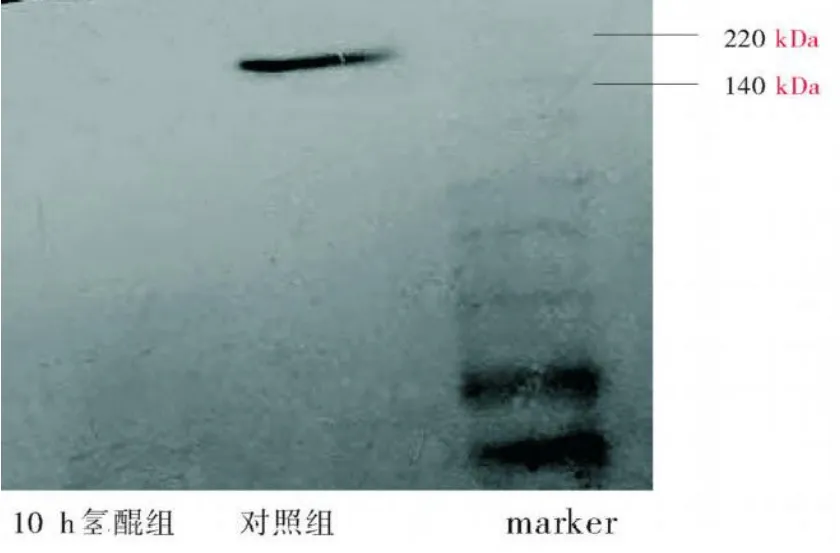
图1HQ对正常人骨髓单个核细胞TOPOIIα含量的影响(TOPOIIα170 kDa)
2.2 HQ对骨髓单个核细胞TOPOIIαmRNA水平的影响氢醌处理后,TOPOIIα mRNA水平较对照组明显下降,差异有显著性(P<0.01),见图2、表1。
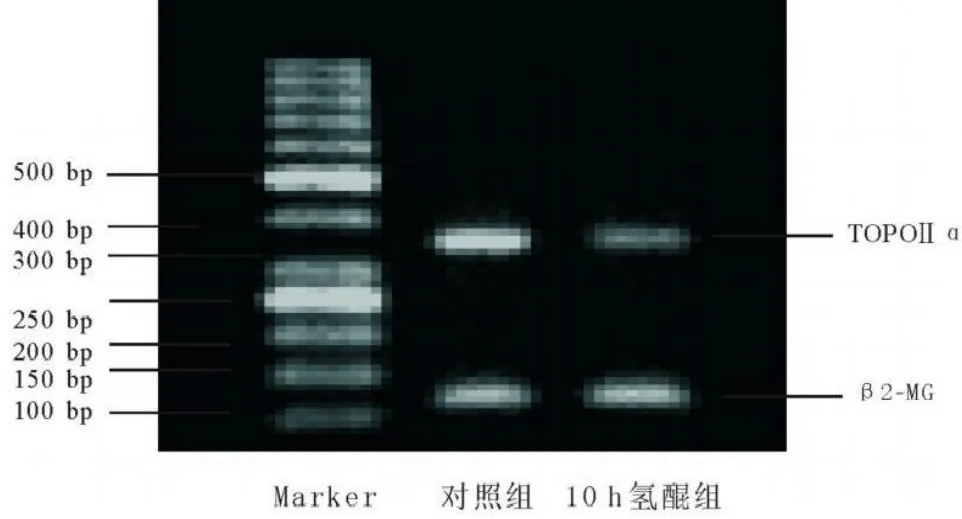
图2HQ对正常人骨髓单个核细胞TOPOIIαmRNA水平的影响(TOPOIIα 349 bp,β2-MG 115 bp)
表2HQ对骨髓单个核细胞TOPOIIα启动子组蛋白乙酰化、甲基化水平的影响(±s)

表2HQ对骨髓单个核细胞TOPOIIα启动子组蛋白乙酰化、甲基化水平的影响(±s)
与对照组比:*P<0.05,**P<0.01
骨髓单个核细胞对照组实验组t TOPOIIα启动子水水平(n=5) AceH4 1.198±0.056 0.324±0.229** 4.712 AceH3 1.253±0.045 1.177±0.025 2.570 MethH3K4 1.013±0.035 0.54±0.062** 11.443 MethH3K9 0.917±0.015 0.960±0.010* -4.111
2.3 HQ对骨髓单个核细胞TOPOIIα启动子组蛋白乙酰化、甲基化水平的影响HQ处理后,与乙酰化组蛋白H4、甲基化组蛋白H3K4结合的TOPOIIα启动子水平明显降低,差异有显著性(P<0.01);与甲基化组蛋白H3K9结合的TOPOIIα启动子水平轻度升高,差异有显著性(P<0.05);而与乙酰化组蛋白H3结合的TOPOIIα启动子水平无明显改变(P>0.05),见表2。
3 讨论
近年来,苯所致造血毒性已得到广泛重视,但其毒性机制仍远未阐明。自1996年Frantz等首次提出,苯的活性代谢产物抑制TOPOII的活性开始,拓扑异构酶在苯致造血毒性中的作用日渐明确。目前认为,苯的代谢产物可导致拓扑异构酶功能失常,继而导致DNA损伤、诱导细胞凋亡或畸变,最终导致白血病的生成[1-2]。
国内外的研究者就苯的代谢产物对拓TOPOIIα功能的抑制进行了相关的研究,但主要停留在分离纯化的人拓扑异构酶系统、白血病细胞株、动物实验[4-6]等阶段。苯的代谢产物能否抑制人骨髓单个核细胞TOPOIIα的功能,目前鲜见报道。我们的前期研究发现体外培养条件下HQ能诱导骨髓单个核细胞凋亡,HQ诱导骨髓单个核细胞凋亡的最佳浓度为50 μmol/L,作用10 h时达高峰[7],我们观察正常人骨髓单个核细胞50μmol/L HQ培养10 h细胞凋亡最明显时TOPOIIα表达的改变。发现正常人骨髓单个核细胞50μmol/L HQ处理10 h后,TOPOII α含量及mRNA表达水平较对照组明显下降,进一步的临床苯中毒病人也证实了这一点(数据另文发表),证明HQ能抑制造血细胞TOPOIIα的表达,与国外文献报道的在分离纯化的人拓扑异构酶系统[4]、老鼠原粒细胞株32D.3(G)HQ处理后[5]及老鼠体外实验触苯后[6]TOPOIIα的表达变化相符,且更真实完整地反映苯损伤后机体的变化。
表观遗传机制的改变导致的基因失活是近年来科学研究的热点,主要包括组蛋白乙酰化、组蛋白甲基化、DNA甲基化和染色质高级结构中其他成分的修饰。这些修饰改变染色质构型,导致基因转录调节发生变化,进而导致细胞增殖失常,最终致癌。有研究发现,人类TOPOIIα启动子的诱导与组蛋白H4乙酰化紧密相关[8]。本实验特选用组蛋白特异性抗体,结合ChIP技术来研究TOPOIIα含量变化与组蛋白乙酰化水平改变的关系,探讨其可能的机制。我们的研究发现:苯代谢物HQ接触后人骨髓单个核细胞TOPOIIα表达降低伴随着TOPOIIα启动子组蛋白H4乙酰化水平的降低。而组蛋白乙酰化与基因转录激活有关,去乙酰化常见基因转录沉默[9]。因此,TOPOIIα启动子组蛋白H4乙酰化水平降低是TOPOIIα表达降低的机制之一。组蛋白除了H4常会发生乙酰化修饰外,H3也是常见的修饰位点,组蛋白H3的翻译后修饰在转录调控及染色质稠密中发挥了重要的作用[10]。本研究发现,TOPOIIα表达降低不伴有TOPOIIα启动子组蛋白H3乙酰化水平的改变,提示TOPOIIα启动子组蛋白H3乙酰化水平降低可能不参与TOPOIIα表达的降低。组蛋白H3K4甲基化与基因转录活化相关[11],而组蛋白H3K9甲基化常见基因转录沉默[12]。本研究结果显示,人骨髓单个核细胞苯及其代谢物接触后TOPOIIα表达降低伴随着TOPOIIα启动子组蛋白H3K4甲基化水平的减低、H3K9甲基化水平的升高。说明TOPOIIα启动子组蛋白H3K4甲基化水平的减低、H3K9甲基化水平的升高亦可能是TOPOIIα表达降低的机制之一。
综上所述,人骨髓单个核细胞HQ处理后存在着TOPOIIα含量、mRNA表达水平的下降,而TOPOIIα启动子组蛋白H4乙酰化、组蛋白H3K4甲基化水平的减低、H3K9甲基化水平升高可能是TOPOIIα表达降低的机制之一。下一步,我们将在已成功建立的苯诱发小鼠再生障碍性贫血模型[13]基础上,进一步研究组蛋白去乙酰化酶抑制剂对TOPOIIα的影响,进一步证实组蛋白化学修饰在苯中毒中的作用,期望研发出苯中毒的特效解毒药物。
[1]Hirabayashi Y,Yoon BI,Li GX,et al.Mechanism of benzeneinduced hematotoxicity and leukemogenicity: current review with implication of microarray analyses[J].Toxicol Pathol,2004,32(Suppl 2):12-16.
[2]Lindsey RH, Bender RP, Osheroff N. Stimulation of topoisomerase II-mediated DNA cleavage by benzene metabolites [J].Chem Biol Interact,2005,30:153-154,197-205.
[3]萨姬布鲁克.分子克隆实验指南[M].北京:科学出版社,1999: 873-897.
[4]Frantz CE, Chen H, Eastmond DA.Inhibition of human topoisomerase II in vitro by bioactive benzene metabolites [J]. Environ Health Perspect,1996,104(Suppl 6):1319-1323.
[5]Fung J,Hoffmann MJ,Kim DD,et al.Inhibition of topoisomerase II in 32D.3(G) cells by hydroquinone is associated with cell death[J]. J Appl Toxicol,2004,24(3):183-188.
[6]Eastmond DA, Schuler M, Frantz C, et al.Characterization and mechanisms of chromosomal alterations induced by benzene in mice and humans[J]. Res Rep Health Eff Inst,2001, 103:1-68.
[7]陈怡,俞康,吴建波,等.体外培养下氢醌诱导骨髓单个核细胞凋亡的研究[J].中华劳动卫生职业病杂志,2004,22(3):161-164.
[8]Kurz EU,Wilson SE.The histone deacetylase inhibitor sodium butyrate induces DNA topoisomerase IIa expression and confers hypersensitivity to etoposide in human leukemic cell lines[J]. Mol Cancer Ther,2001,1(2):121-131.
[9]Urnov FD,Wolffe AP.Chromatin remodeling and transcriptional activation:the cast (in order of appearance)[J].Oncogene,2001,20(24):2991-3006.
[10]He H, Lehming N. Global effects of histone modifications [J]. Brief Funct Genomic Proteomic,2003,2(3):234-243.
[11]Hampsey M, Reinberg D. Tails of intrigue: phosphorylation of RNA polymerase II mediates histone methylation[J].Cell, 2003,113(4):429-432.
[12]Richards EJ, Elgin SC. Epigenetic codes for heterochromatin formation and silencing:rounding up the usual suspects [J].Cell,2002,108(4):489-500.
[13]任行洲,俞康,王明山,等. 苯诱发小鼠再生障碍性贫血模型建立的初步探讨[J].温州医学院学报,2004,34(5):331-333.
(本文编辑:丁敏娇)
Effect of hydroquinone on expression of topoisomerase enzyme Ⅱαin human bone marrow mononuclear cells and the possible mechanism
SHI Yifen,YU Kang,CHEN Yi,REN Xingzhou,BI Laixi, Qian Honglan.Department of Hematology,the First Affiliated Hospital of Wenzhou Medical College,Wenzhou,325000
Objective: To observe the effects of hydroquinone(HQ)on the expression of topoisomerase Ⅱα(TOPOⅡα)in human bone marrow mononuclear cells,and to explore the possible regulatory mechanism of TOPOⅡαinvolving in the toxicity of HQ to hematopoietic cells. Methods: Human bone marrow mononuclear cells was exposed to 50μmol/L HQ for 10 h(used the cells which were exposed to sterile distilled water for 10 h as control). The expression levels of TOPOⅡα mRNA and protein were detected with RT-PCR technique and Western blot method,respectively. The Chromatin Immunoprecipitation(ChIP)assay was carried out to study the possible mechanism of TOPOⅡα expression changes. Results:The protein and mRNA expression of TOPOⅡα after treated with HQ for 10 h were significantly lower than that in the control(P<0.01). The decreased content of TOPOⅡα was associated with descended level of histone H4 acetylation(P<0.01),H3K4 methylation(P<0.01)and heightened level of H3K9 methylation of TOPOⅡα promoter(P<0.05)than that in the control with the significant difference,but without accompanied with descented level of histone H3 acetylation(P>0.05). Conclusion:HQ can repress the expression of TOPOⅡα in human bone marrow mononuclearcells. The changes of histone chemical modification play definite important role in the benezen’s hematopoietic toxicity.
hydroquinone;TopoisomeraseⅡα;histone acetylation;histone methylation;Chromatin immunoprecipitation (ChIP)
book=3,ebook=3
R135.1+2
A
1000-2138 (2010)02-0164-04
2009-05-20
温州医学院重大科研课题B类(2005yxy116)。
施益芬(1981-),女,浙江温州人,硕士。
俞康,主任医师,教授,硕士生导师,Email: yukang62@126.com。

