类球红细菌突变株及其应用
党磊 靳明慧 田菁 王玮 王小雪 庞欣
(中国空间技术研究院空间生物实验室,北京100190)
辅酶Q10(CoQ10)是一种广泛存在于生物体内的脂溶性醌类化合物,俗称泛醌[1,2]。辅酶Q10在动植物、微生物等细胞内与线粒体内膜结合,是呼吸链中重要的递氢体[3],能加速产生三磷酸腺苷(ATP),是细胞呼吸和代谢的激活剂,也是细胞自身产生重要的天然抗氧化剂和非特异性免疫增强剂。
辅酶Q10的制备方法有动植物细胞提取法,化学合成法和微生物发酵法。与动植物细胞提取和化学合成法相比,微生物发酵法具有生物活性好,易被人体吸收和原料不受限制,成本低,易扩大生产规模等优点而被公认为最具有优势和潜力的一种技术工艺[4-6]。
类球红细菌1.1737可用于生产辅酶Q10。但在从该菌的发酵液提取辅酶Q10时,需要用层析方法吸附色素等水溶性物质。由于该菌的发酵液为深红色,要耗费较大量的层析填料用于脱色,层析所用的填料用量多少与生产辅酶Q10的成本相关。如果能够得到色泽较浅的类球红细菌发酵液,则可减少层析填料的用量,直接降低辅酶Q10的生产成本。
此外,类球红细菌1.1737生产辅酶Q10的产量不高,通常摇瓶发酵水平仅达到20-25mg/L。近年来,通过空间环境诱变的方法筛选高产量的突变株成为大家研究的热点。本文采用空间环境诱变的方法对类球红细菌1.1737进行菌种选育。
1.材料与方法
1.1 材料
1.1.1 试剂
辅酶Q10标准品购自sigma公司,其余化学试剂均为分析纯。
1.1.2 菌株
类球红细菌1.1737购自中国微生物菌种保藏中心。类球红细菌突变株为我室筛选获得,现已在中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏编号为CGMCC No. 2359,保藏时间为2008年1月25日。
1.1.3 培养基
固体培养基(%):葡萄糖0.2,牛肉膏0.3,鱼蛋白胨1.0,酵母膏0.5,氯化钠0.5,琼脂粉1.5,pH7.0。
种子培养基(%):葡萄糖2.0,鱼蛋白胨1.0,酵母粉1.0,氯化钠0.5,碳酸钙 0.5,pH7.2。500毫升三角瓶分装,8层纱布封口灭菌。
发酵培养基(%):葡萄糖2.7,白砂糖2.0,玉米浆4.0,硫酸铵0.8,磷酸二氢钾0.05,磷酸氢二钾0.05,硫酸镁0.025。500毫升三角瓶分装,8层纱布封口灭菌
1.2 方法
1.2.1 空间诱变育种
(1)航天育种卫星搭载样品准备
取生长良好的类球红细菌1.1737菌体培养物在无菌条件下转移到搭载专用管中,拧紧管盖,接口处用封口膜封口后装入搭载用大管,送交搭载前于4℃保存。此搭载管放入“实践八号”航天育种卫星的实验装置中,在太空中随飞船飞行15天后回收。
(2)搭载的空间环境
在本次育种卫星飞行过程中,空间环境的相关数据为:卫星姿态控制为三轴稳定姿态,其中卫星的I象限指向地面,卫星回收舱小头为飞行方向。育种卫星轨道为椭圆形倾斜轨道,卫星运行在近地点高度为180km远地点高度为460km的轨道上,轨道倾角为63°,近地点位置在北纬35°附近,卫星飞行15天,共飞行236圈,236圈通过回收区中心。测试结果表明,本次飞行试验期间空间辐射剂量最大为5.893mGy,最小2.484mGy。平均日剂量在0.401~0.169 mGy之间。卫星在轨期间种子测温点的最大温度为20.72℃,最低温度为7.21℃。
1.2.2 地面突变株的筛选
在无菌条件下取培养面积为0.5平方厘米的搭载回收样品,用5毫升无菌水洗脱菌体到无菌离心管中,用移液器吸打均匀菌体洗脱液,取0.5毫升该菌液到4.5毫升无菌水中,吸打均匀,以此类推,做倍比稀释。取10-4和10-5稀释液涂布到固体平板培养基,每块平板上涂150微升稀释菌液,每个稀释梯度涂多块平板。待菌液被培养基吸收后于培养箱中30℃倒置培养2-7天。待平板上长出菌落后,通过摇瓶发酵实验初步筛选辅酶Q10含量比对照菌株高的菌株。
1.2.3 菌株稳定性实验
对初筛选到的高产菌株进行传代培养,传代培养时使用固体培养基。经过50次以上的传代,保证菌株的稳定性。初筛菌株经过多次传代后,进行复筛,复筛菌株进行固体和种子液培养后进行发酵培养。
1.2.4 辅酶Q10的测定
向各发酵液中分别加入6 mol/L的盐酸,调pH值到2-4,之后加入6 mol/L氢氧化钠溶液,使pH值回复到6-8,将发酵液离心,取沉淀60-80℃烘干,研磨后按质量体积比(1:100)加入无水乙醇,超声处理。处理液再次离心取上清上样。辅酶Q10的测定:按照中华人民共和国药典中辅酶Q10的检测方法进行。
1.2.5 用柱层析提取辅酶Q10的方法[7]
向发酵液中分别加入6 mol/L的盐酸,调pH值到2-4,之后加入6 mol/L氢氧化钠溶液,使pH值回复到6-8,将菌液离心取菌体,按照固液比例(1:10)加入石油醚,打散菌体,使之与提取溶剂混合均匀。45℃摇床,180rpm条件下提取2小时。提取液离心取上清液在旋转蒸发仪上进行旋转蒸发。旋转蒸发后所得浸膏用石油醚和乙酸乙酯的混合物溶解上样。
利用不锈钢常压柱作为层析柱,以60-100目的硅胶作固定相,柱子径高比为1:15,样品与硅胶的质量之比为1:10,上样前用洗脱剂饱和柱子。洗脱剂为石油醚和乙酸乙酯的混合物。
样品过柱的同时,进行薄层分析。当收集液的结果与标准品的结果一致时,即可开始正样收集,当收集液的结果与标准品的结果不一致时,停止收集。
此实验的目的在于比较不同硅胶用量(40%,45%,50%)对出发菌株与突变株发酵液中辅酶Q10产率的影响。
1.2.6 辅酶Q10合成相关基因测序
检测高产辅酶Q10菌株中辅酶Q10合成相关基因是否发生变化,选取辅酶Q10合成过程中的关键酶基因ddsA (十异戊二烯焦磷酸合成酶)基因和ubiC基因(丙酮酸合成酶)基因测序。
样品总DNA提取方法按盖宁生物科技公司的细菌基因组DNA快速提取试剂盒的步骤操作。两个基因的扩增引物均由生工生物工程(上海)公司合成ddsA引物为:ddsA-F:5’-ATGGGATTGGACGAGGTTTCGCAA-3’,ddsA-R:5’-TCAGGCGATGCGTTCGACCA-3’。ubiC引物为:ubiC-F:5’-TTGGCTCAGGGACAGCACA-3’, ubiC-R:5’-TTAATGGGCGTCGGTTGCGA-3’。经过PCR扩增后产物交生工生物工程(上海)有限公司进行测序。
2.结果与分析
2.1 突变株的筛选
取搭载样品进行平板培养,在平板培养物中共获得328个单菌落,通过摇瓶发酵试验和多次传代培养后,进一步的HPLC检测筛选到一株颜色变化较大,辅酶Q10产量明显提高的突变株(见图1,2,表1 所示),定义为space QG 1.1737-168,后将此菌种保藏至中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No. 2359。

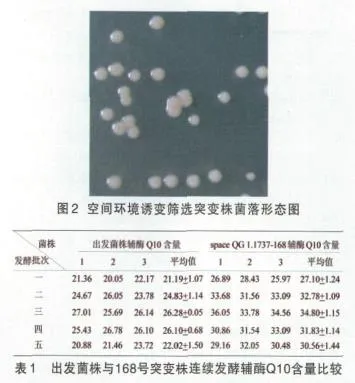
由表中多次重复实验的数据可得,突变株的辅酶Q10的含量较出发菌株平均提高了30.4%。
2.2 柱层析提取辅酶Q10
样品处理后分别上样于装有40g,45g,50g硅胶的层析柱中,通过石油醚和乙酸乙酯混合物的洗脱得到分纯的辅酶Q10,其产率如图3所示。

由图中数据可看出,随着硅胶用量的减少,space QG 1.1737-168菌株的辅酶Q10产率逐渐高于对照菌株,即在辅酶Q10产率相同的情况下,利用space QG 1.1737-168菌株发酵,由于其发酵液颜色较浅,可节省层析填料,降低层析成本。
2.3 基因测序结果
辅酶Q10由一个醌环和一个类异戊二烯侧链组成。辅酶Q10的醌环是由对羟基苯甲酸(PHB)合成的,异戊二烯侧链是由甲羟戊酸经异戊烯焦磷酸(IPP)合成而来。在辅酶Q10生物合成途径中,催化类异戊二烯侧链合成的是聚异戊烯焦磷酸合成酶(PPP合成酶),在类球红细菌中它是由ddsA (十异戊二烯焦磷酸合成酶)基因编码。ubiC基因是分支酸裂解酶,在细菌中催化分枝酸合成对羟基苯甲酸,羟基苯甲酸是合成醌环的前体物质。
ddsA基因和ubiC基因测序结果在NCBI上进行比对,结果显示高产菌株的这两个基因没有发生变化,说明该高产菌株的辅酶Q10含量提高,并不是由这两个基因变化引起的,推测可能与合成辅酶Q10的其他基因有关,或者是相关的调节代谢基因的变化。
3.讨论
随着人类对空间资源的开发利用和世界航天工业的发展,有关空间环境对生物体的效应研究已备受重视[9],而空间诱变育种是其研究的主要应用之一。空间诱变育种突破了传统育种模式,已作为提供新的种质资源的途径得以应用[10]。
本文通过类球红细菌的搭载实验为利用空间环境选育微生物菌种提供了一定的实验和理论依据。实验结果表明,经搭载筛选到的突变株,该菌菌落颜色变浅,且具有良好的的遗传稳定性,辅酶Q10的产量比出发菌株平均提高了30.4%。在后期柱层析的提取纯化过程中发现,硅胶用量40g时即可将辅酶Q10与色素分开,而对照菌株在相同硅胶用量条件下分离不完全。辅酶Q10产率相同的情况下,利用space QG 1.1737-168菌株发酵,可节省层析填料,降低层析成本。
在类球红细菌的代谢过程中,类胡萝卜素与CoQ10合成有共同的前提物质聚异戊二烯,因此,对于颜色较浅的菌株,合成的类胡萝卜素就较少,自然合成CoQ10的量就提高。因此在筛选过程中,利用菌落颜色筛选颜色较浅的菌株,可能会得到发酵生产CoQ10含量高的菌株。另外,已有研究[11]利用色深突变表性作为CoQ10高产菌株重要的筛选标志,但本实验认为色浅菌株更有利于发酵生产CoQ10的后期提取纯化处理,可以减少色素处理步骤。因此,选用颜色浅且CoQ10产量高的突变菌是适合生产的最佳菌株。
经过测序分析,合成辅酶Q10的关键酶基因ddsA基因和ubiC基因没有发生变化,那么是相关的其他基因发生了变化还是相关调控基因发生变化,有关色素合成的相关基因是否发生变化,还需要进一步的研究。
[1]安银铃. 植物化学[M]. 哈尔滨,东北林业大学出版社,1996.
[2]云南省动物研究所,江苏省泰州市生物制药厂.从制备细胞色素丙的猪心残渣中分离出辅酶Q10[J]. 医药工业,1976,2:22~25.
[3]L enaz,G. Coenzyme Q. John Wiley &Sons L td.1985.
[4]李焱生,方建军,钟卫鸿. 微生物法高产辅酶Q10的研究进展[J],生物技术通讯,2009,2:59~62。
[5]潘春梅,堵国成,陈坚. 辅酶Q10高产菌 Rhizobium radiobacter 的选育及发酵条件优化[J],过程工程学报,2004,4(5):451~456。
[6]刘正光,柏丽娟,卓文海,张瑞霞. 辅酶Q10微生物发酵生产的研究进展.齐鲁药事.2006,25(11):675~677.
[7]袁艺. 猪心中提取和纯化辅酶Q10(联产Cytc)[J].安徽农业大学学报,1997,24(2):200~203.
[8]Haslam E. The shikimic Acid: Metabolism and Metabolites[M].New York:John Wiley&Sons Inc,1996.387.
[9]田兴山,张玲华等. 空间诱变在微生物菌种选育上的研究进展[J]. 生物技术通讯,2005,16(1):105~108.
[10]王呈祥,白志良,王良群等. 航天育种—我国农业科技革命的新路[J].山西农业科学,2003,3l(3):92~96.
[11]武 标,张 千,李 辉,等. 氩离子激光照射对类球红细菌的诱变效应及对辅酶10产生量的影响[J]. 激光生物学报,2007,16(3):364-368.

