颅脑创伤后大鼠脑组织脑红蛋白表达变化及其与神经元凋亡的关系研究*
林 欣,李 敏,胡亚卓,韩志涛,张红红,尚爱加,高德伟,周定标
(1.解放军总医院南楼外二科,北京 100853;2.总装备部北京黄寺美容外科医院创伤美容科,北京 100120;3.解放军总医院老年医学研究所,北京 100853;4.解放军总医院神经外科,北京 100853;5.复旦大学医学神经生物学重点实验室,上海 200032)
脑红蛋白(neuroglobin,NGB)是继血红蛋白、肌红蛋白之后发现的第三类携氧球蛋白,其主要在视网膜、脑皮质神经元高表达[1]。目前研究表明,NGB对脑缺血、缺氧性损害具有保护作用[2~4]。由于其特有的红蛋白家族的特性(与氧的可逆结合)、特异的神经元高表达及可能的内源性神经保护因子的功能,使其成为一种备受期待的神经元损伤修复介质。目前的研究表明[5~7],NGB在神经元缺血、缺氧性损伤急性期呈代偿性表达增高,可增强神经元对缺血、缺氧性损害的耐受;过表达NGB可显著延长缺血、缺氧神经元的存活期,相反,抑制NGB表达,则缩短神经元存活期。我们在前期研究中观察到颅脑创伤后脑红蛋白高表达,提示其可能参与神经元创伤后保护[5]。对NGB基因结构进行生物信息学分析发现,在NGB的启动子区域含有两个p53结合位点,提示NGB的表达可能受p53调控。p53是一种重要的凋亡相关基因,在神经元损伤应激中,p53是神经元死亡的关键性调节因子,具有促凋亡作用。颅脑创伤本身及其继发的脑肿胀所造成的缺血、缺氧性损害也可导致神经元凋亡。因此,在颅脑创伤中,NGB和神经元凋亡的关系、其在创伤及其继发之缺血、缺氧性损害所致的细胞凋亡中起何种作用,均值得进一步探讨。本研究拟通过探究大鼠脑颅脑创伤后NGB和凋亡相关基因Bcl-2、Bax的变化规律,初步探讨NGB表达和细胞凋亡的关系。
1 材料与方法
1.1 动物模型及标本制备
雄性SD大鼠50只,体重350~400 g(军事医学科学院实验动物中心提供)。随机分为10组(n=5):空白对照组 、伤后 30min 、1 h、2 h、6 h 、12 h 、24 h、48 h、72 h和5 d组。以Marmarou's法[6]制备闭合性重型颅脑损伤模型(落体重量为450 g,高度170 cm),3%异氟烷(上海ABBOTT制药公司)短时(2 min)吸入麻醉后致伤。分别于致伤后30 min、1 h、2 h 、6 h、12 h、24 h 、48 h、72 h、5 d 将实验组大鼠断头 ,迅速取脑,置入10%福尔马林溶液中固定2周。空白对照组同样暴露,但不致伤,此后亦取脑置入10%福尔马林溶液中固定2周。取脑组织标本,于打击区切取脑组织块行组织脱水、石蜡包埋,脑组织切片厚度5 μ m。
1.2 免疫组化染色
NGB单克隆抗体(军事医学科学院二所十三室馈赠);兔抗Bax多克隆抗体(Santa Cruz公司);兔抗Bcl-2多克隆抗体(Santa Cruz公司);二步法免疫组化试剂盒(Dako公司)。常规脱蜡至水,以3%过氧化氢溶液封闭内源性过氧化物酶,微波修复抗原,各步骤间以PBS冲洗3 min×3次。每张切片加1∶200一抗工作液每张50 μ l,4℃孵育过夜。其余操作步骤参照Dako公司二步法免疫组化试剂盒说明进行,显色时间1 min。之后脱水、透明、封片。阴性对照用PBS代替一抗。
1.3 图像分析
选用荧光显微镜系统(Olympus BX-60型)及显微镜数码相机系统(Olympus DP10型)进行图像采集。各切片选择4个不同的视野照相(显微镜放大倍率为200倍),各切片选择视野的位置保持一致。将照片输入计算机后,使用图像分析软件进行分析。照片经过灰度转换和二值化处理后,由软件标记并计算出每张照片中阳性细胞的数量。
1.4 统计学处理
2 结果
2.1 大鼠颅脑损伤后致伤区皮层神经元NGB免疫组化染色
免疫组化染色显示NGB阳性细胞呈棕色,阳性物质位于神经元的细胞质和突起中(图1、2)。选取双侧皮层致伤区,进行细胞计数并分析。如图3所示,大鼠颅脑创伤后致伤区皮质神经元NGB表达呈“双峰”改变,损伤后30 min即可见损伤区皮层NGB阳性神经元数量增高;至损伤后2 h,皮层NGB阳性神经元数量达到高峰;此后逐渐下降,至损伤后48~72 h,又再次出现NGB表达升高,并于72 h再次达峰值;继之开始下降,至伤后5 d阳性细胞数量仍高于正常水平。统计学分析表明,伤后2 h组NGB阳性神经元计数与其余各组比较具有显著差异(P<0.01),伤后72 h组与对照、30 min组比较具有显著差异(P<0.01,PP<0.05,图3见下页)。

Fig.1 Expression of NGB in cortical neurons(×100)

Fig.2 Expression changes of NGB in cortical neurons 2 h post-TBI(×100)
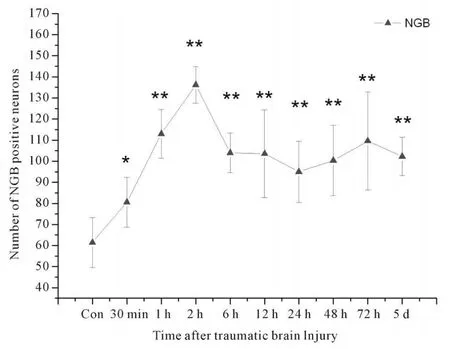
Fig.3 Expression changes of NGB in cortical neurons post-TBI
2.2 SD大鼠颅脑损伤后致伤区皮层神经元Bcl-2、Bax表达检测
2.2.1 Bcl-2 正常对照组脑切片皮层神经元可见散在的Bcl-2阳性表达,数量不多,阳性物质定位于神经细胞的胞浆中(图4)。损伤后30 min,皮层致伤区Bcl-2阳性细胞明显增多(P<0.05);至损伤后2 h,阳性细胞数大量增加并达到高峰(P<0.01,图5);此后,Bcl-2阳性细胞开始减少,但是在伤后24 h再次出现表达高峰;之后,阳性细胞再次逐渐减少,至损伤后5 d,Bcl-2表达仍高于正常水平(图6)。统计学分析表明,伤后2 h组Bcl-2阳性神经元计数与其余各组比较具有显著差异(与30 min、1 h、6 h组比较P<0.05,与其它各组比较P<0.01),伤后24 h组与30 min组比较具有显著差异(P<0.05,图6)。

Fig.4 Expression of Bcl-2 in cortical neurons(×100)
Fig.5 Expression changes of Bcl-2 in cortical neurons 2 h post-TBI(×100)

Fig.6 Expression changes of Bcl-2 in cortical neurons post-TBI
2.2.2 Bax 正常对照组脑切片皮层区可检测到Bax阳性细胞,数量低于Bcl-2阳性细胞,阳性物质定位于神经元胞浆中(图7)。损伤后30 min,致伤区皮层Bax阳性细胞显著增多;于损伤后2h达到高峰(P<0.01,图8)。此后,Bax阳性细胞开始减少,虽然在伤后48 h及72 h出现轻微波动,至损伤后5 d,致伤区皮层Bax阳性细胞数量呈现下降趋势(图9)。统计学分析表明,伤后2 h组Bax阳性神经元计数与其余各组比较具有显著差异(与6 h组比较P<0.05,与12 h~5 d组比较P<0.01,图9)。
Fig.7 Expression of Bax in cortical neurons(×100)

Fig.8 Expression changes of Bax in cortical neurons2 h post-TBI(×100)
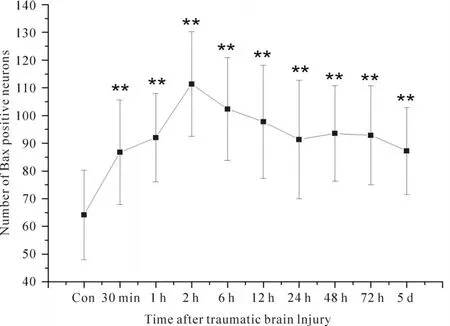
Fig.9 Expression changes of Bax in cortical neurons post-TBI
2.3 损伤后Bax/Bcl-2的动态变化
颅脑创伤后大鼠神经元Bax/Bcl-2比值变化呈现“双峰”状。伤后30 min就出现Bax/Bcl-2比值的急剧升高,并于伤后6 h达峰值;此后逐渐下降,于伤后48 h、72 h又再次出现波动性增高;最终于伤后5 d恢复至接近正常水平(图10)。

Fig.10 Changes of ratio of Bax to Bcl-2 in traumatic brain injury rats
3 讨论
3.1 颅脑创伤后大鼠脑组织NGB表达的动态变化
本研究观测了大鼠颅脑创伤后30 min至5 d致伤区神经元NGB的表达变化情况。发现NGB的表达呈现“双峰”样变化:于伤后2 h,皮层NGB阳性神经元数量大量增多,达到首个高峰(P<0.01);此后逐渐下降,至损伤后48 h、72 h,再次出现NGB表达升高,并于伤后72 h达峰值;继之下降,至伤后5 d阳性细胞数量仍高于正常水平。这种NGB在颅脑创伤后超早期(3 h内)表达迅速上调的表现,很可能是神经元对创伤应激的保护性反应。这与我们前期关于颅脑创伤后神经元NGB核酸水平变化的研究结果相一致[5],对NGB-cDNA的实时定量研究发现颅脑创伤可直接诱导NGB核酸表达,在伤后30 min即出现首次核酸表达高峰。可能由于机械性创伤可直接造成线粒体损害、Na+-K+-ATP酶失活,致使神经元处于氧化应激状态—能量代谢障碍、膜稳定性破坏。进而诱导NGB代偿性表达上调,以增加神经元的氧供、维持细胞膜稳定。然而,神经元对创伤应激的代偿能力有限,NGB并非随着伤情进展而持续高表达,而于伤后6~24 h逐渐下降。而伤后48~72 h NGB表达的再次小幅增高,可能是源于颅脑创伤继发脑肿胀致颅内低灌注,造成神经元缺血、缺氧性损伤。Marmarou等[6]对其致伤模型的研究发现:脑肿胀于伤后6 h开始出现,并于伤后24 h达高峰,持续数天后逐渐消退。正是颅脑创伤的“二次打击”—继发缺血、缺氧性损害诱发了NGB的表达上调。我们前期关于颅脑创伤后NGB-cDNA的实时定量研究亦发现NGB的核酸表达在伤后48 h再次升高达峰值[5]。目前的研究表明氧化应激与抗氧化储备的耗竭是创伤性脑损害中神经元损伤的重要因素。Wakasugi等[7]的研究提示,NGB可能是脑组织的氧化应激感受器,其与G蛋白信号系统调节器和G蛋白受体激酶具有同源性,氧化型NGB(Fe3+),可使鸟嘌呤核苷酸失去抑制活性,进而抑制GDP转化为GTP;而还原型的NGB可释放Gβγ,激活G蛋白信号系统,延长神经元存活期。Khan等[8]的研究发现过表达NGB的转基因小鼠心肌、脑组织对缺氧性损害的耐受显著提高—在缺血、低氧损伤中脑梗死面积减少30%、心肌梗死面积减少25%,NGB的过表达伴随着血管内皮细胞的一氧化氮合酶的表达水平增高,提示NGB可能通过促进内皮一氧化氮合酶(eNOS)的高表达保护心肌、神经元耐受缺血性损害。此外,尚有研究认为,低氧诱导NGB表达可能与低氧诱导因子(hypoxia inducible factor-1,HIF-1)有关[2,9]。HIF-1在低氧应答中居于核心地位,对红细胞生成素、血管内皮生成因子、糖酵解酶类和一氧化氮合酶的基因转录均有调节作用。在NGB基因5'端非编码区发现了多条HIF-1结合位点相同序列[9],HIF-l的诱导子,如钴和去铁胺等,均能使NGB基因表达增强[2],均提示NGB可能是HIF-1的靶基因。NGB在颅脑创伤后超早期的表达上调,提示NGB是一种应激反应的效应器或调节器,参与或是唤醒机体的其它内源性应激保护;而其在伤后急性期的再次高表达,表明NGB具有神经保护作用。基于NGB与氧的特殊亲和力,可提高神经元对缺血、低氧性损害的耐受力,延缓或避免凋亡的启动。
3.2 颅脑损伤后大鼠脑组织凋亡相关基因 Bax、Bcl-2表达的变化
凋亡,又称程序性细胞死亡,其与胚胎分化、伤口愈合、肿瘤发生、先天性疾病、缺血再灌注损伤、器官功能衰竭、衰老过程以及神经退行性变等都有密切关系。在颅脑创伤中,损伤的发生不仅与神经元坏死有关,与神经元凋亡亦关系密切。近年来对Bcl-2家族与凋亡关系的研究较为深入。Martinou等[10]用转基因技术使小鼠神经元内Bcl-2过度表达,梗塞灶减少了50%,证实了Bcl-2具有神经元保护作用。Bax是Bcl-2家族的另一个主要成员,功能上与Bcl-2相反,该蛋白可与Bcl-2形成异源二聚体,从而抑制Bcl-2的功能。当Bax过表达时,促进细胞凋亡。一般认为Bax/Bcl-2比值决定细胞受刺激后存活或死亡,Bax蛋白占优势时细胞凋亡,Bcl-2蛋白占优势时则细胞存活。本研究的结果显示,大鼠颅脑创伤后致伤区神经元Bcl-2的表达与NGB的表达相似,呈现“双峰”样变化,分别于伤后2 h、24 h出现两次峰值表达。这表明Bcl-2对神经元创伤性应激及继发缺血低氧性损害非常敏感,在超早期的创伤应激(伤后30 min~2 h)、继发脑肿胀并缺血低氧性损害时(伤后24~72 h),Bcl-2迅速出现保护性表达上调,尤其在神经元的继发性缺血低氧损害阶段,呈现持续性高表达(伤后24~72 h)。与Bcl-2不同,颅脑创伤后Bax的表达并未呈现明显“双峰”样改变。于损伤后2 h达到表达高峰后,Bax阳性细胞开始减少。值得注意的是,尽管致伤2h后皮层神经元Bcl-2和Bax的表达都有所下降,然而Bax/Bcl-2比值还在升高,神经元仍趋于凋亡。伤后24 h,由于弥漫性脑肿胀的发生并达到高峰,造成Bax表达的再次波动性升高,此时 Bcl-2的表达不足以抑制Bax,形成了Bax/Bcl-2比值的二次增高,神经元再次趋于凋亡。上述结果表明:在颅脑创伤超早期(30 min~2 h),创伤应激导致Bax基因迅速激活、表达增高,启动神经元凋亡。同时,Bcl-2亦被激活并大量表达,试图遏制凋亡。至创伤急性期(24~72 h),随着颅脑创伤所致弥漫性脑肿胀的发生和加剧,使得脑组织的有效灌注下降,进而造成神经元的缺血、低氧性损害的发生,此时再次出现Bax、Bcl-2基因的表达增加,但是Bcl-2的表达不足以抑制细胞凋亡,神经元再次趋于凋亡。
3.3 颅脑损伤过程中NGB表达与神经元凋亡的相关性
综合分析NGB、Bcl-2、Bax和 Bax/Bcl-2比值的动态变化的趋势,结果表明:(1)在颅脑创伤后的超早期,NGB、Bcl-2及Bax均呈现迅速反应性增高,其中NGB的增幅最为显著,尤其在伤后30 min~1 h期间。而同期 Bax/Bcl-2比值增幅明显减小(图10)。(2)Bcl-2对神经元的伤害性应激十分敏感,其在伤后超早期及出现对创伤应激的反应性表达增高,在伤后12~24 h,随着弥漫性脑肿胀的发生、继发缺血低氧性损害的产生,其再次出现保护性表达上调,并始终保持在一个较高的水平拮抗神经元的凋亡。而NGB与其在颅脑创伤后的变化十分相似,提示NGB可能对神经元凋亡具有拮抗作用。(3)NGB对创伤性应激的反应迅速,于伤后超早期表达迅速增高;而其在创伤后急性期对继发性缺血低氧性损害反应滞后于Bcl-2,伤后24 h致伤区神经元Bcl-2表达再次达峰值,而该区神经元NGB表达于24 h后方出现小幅上升,直至伤后72 h方出现表达高峰。提示尽管NGB对缺血低氧性损害之神经元具有保护作用,但有限,可能取决于尚存活神经元的数量及神经元损害的程度。(4)在伤后48~72 h,随着弥漫性脑肿胀的发生与发展,继发缺血、低氧性损害,此时NGB再次出现表达增高,并于72 h达峰值。而同期(48~72 h)Bax/Bcl-2比值上升趋势亦出现明显减缓并随后呈现下降趋势(图10)。以上均提示:NGB的高表达在一定程度上可以拮抗创伤应激及伤后继发缺血、低氧性损伤所导致的神经元凋亡,在颅脑创伤的超早期(<3 h)、急性期(<72 h)可能具有一定的神经保护作用。
[1]Burmester T,Weich B,Reinhardt S,et al.A vertebrate globin expressed in the brain[J].Nature,2000,407(6803):520-523.
[2]Sun Y,Jin K,Mao X O,et al.Neuroglobinis up-regulated by and protects neurons from hypoxic-ischemic injury[J].Proc Natl Acad Sci USA,2001,98(26):15306-15311.
[3]Sun Y,Jin K,Peel A,et al.Neuroglobin protects the brain from experimental strokein vivo[J].Proc Natl Acad Sci USA,2003,100(6):3497-3500.
[4]尚爱加,周定标,高 艳,等.沙鼠前脑缺血后脑红蛋白的表达变化[J].中华医学杂志,2004,84(16):1390-1392.
[5]林 欣,周定标,尚爱加,等.大鼠弥漫性颅脑损伤后脑红蛋白mRNA变化的实验研究[J].中国微侵袭神经外科杂志,2007,12(5):221-224.
[6]Marmarou A,FodaM A A,Van den Brink W,et al.A new model of diffuse brain injury in rats[J].J Neurosurg,1994,80(Part I,2):291-300.
[7]Wakasugi K,Nakano T,Morishima I.Oxidized human neuroglobin acts as a heterotrimeric Galpha protein guanine nucleotide dissociation inhibitor[J].J Biol Chem,2003,278(38):36505-36512.
[8]KhanA,Wang Y,Sun Y,etal.Neuroglobin-overexpressing transgenic mice are resistant to cerebral and myocardial ischemia[J].Proc Natl Acad Sci USA,2006,103(47):17944-17948.
[9]Fordel E,Geuens E,Dewilde S,et al.Cytoglobin expression is upregulated in all tissues upon hypoxia:anin vitroandin vivostudy by quantitative real-time PCR[J].Biochem BiophysResCommun,2004,319(2):342-348.
[10]Martinou J C,Dubois-DauphinsM,Staple J K,et al.Overexpression of BCL-2intransgenic mice protects neurons from naturally occurring cell death and experimental ischemia[J].Neuron,1994,13(4):1017-1030.

