糖皮质激素快速抑制气道平滑肌游离钙升高与磷脂酶C活性的关系*
孙海文,刘 磊,李鸣皋,蒋春雷△
(1.海军总医院航空潜水医学中心,北京 100048;2.第二军医大学航海医学教研室应激研究实验室,上海 200433)
糖皮质激素(glucocorticoids,GCs)在哮喘治疗中,除了调节免疫和炎症细胞的功能,对于气道平滑肌细胞的收缩强度也存在着直接的调节作用,临床上哮喘急性发作时,单纯给予GCs吸入治疗(不含茶碱类药物),在数分钟内就能迅速缓解气道梗阻的症状,气道的直径及通气能力快速恢复[1]。本实验检测了地塞米松(dexemisone,Dex)对大鼠平滑肌细胞内由乙酰胆碱(acetylcholine,Ach)激动的游离钙[Ca2+]i水平变化及抑制型 PLC(ser1105-phospho-PLCβ)含量的快速影响。并设立米非司酮(Roussel-Uclaf 38486 RU486)和放线菌酮(cycloheximide,CHX)对照,拟证明糖皮质激素可快速抑制激动剂引起的气道平滑肌细胞收缩,并探讨其可能机制。
1 材料与方法
1.1 实验动物
实验用豚鼠SD大鼠(180~220)g购于第二军医大学动物中心,皆为雄性,饲养于22~26℃的环境,控制湿度55%,12 h照明与黑暗交替,动物皆自由摄食,实验前动物无干扰饲养一周。
1.2 实验分组
(1)空白对照组:细胞不进行处理直接制备样本;(2)阳性对照组:ACh10-4mol/L终浓度反应 2 min,不给Dex;(3)Dex处理组:提前10 min加10-6、10-7、10-8mol/L GC;(4)RU486阻断组:给 Dex前 50 min加10-5mol/L RU486并温浴;(5)RU486对照组:加RU486处理,不给Dex;(6)CHX阻断组:给Dex前50 min加10-5mol/L CHX并温浴;(7)CHX对照组:加CHX处理,不给Dex。其中选取10-7mol/L GC为阻断组Dex浓度。
1.3 实验方法
1.3.1 大鼠气道平滑肌细胞原代培养 腹腔注射戊巴比妥钠麻醉后处死大鼠,分离组织,获得气管。沿气管腹面剪开管壁,用消毒过的棉签轻抚气管内面,除去内皮层。沿软骨环边缘垂直切下气管平滑肌条,洗涤后切成1 mm的碎片,加入含胶原酶Ⅰ(1 mg/ml)和DNA酶(20 U/ml)及20%FBS的DMEM培养液,37℃消化 7h 1 000 r/min离心5min,沉淀重悬于含20%胎牛血清的DMEM培养液,吸管小心吹打20次,静置自由沉淀3 min,取中上部细胞悬液,进行细胞计数,调整细胞浓度(104cells/ml)后接种于培养皿,培养细胞经α-actin免疫组化鉴定为平滑肌细胞。常规环境培养,24 h后首次换液,培养液血清浓度降低至15%,此后每48 h换液一次,直至实验开始。
1.3.2 Fura-2/AM显微荧光检测技术检测胞浆游离钙离子[Ca2+]i浓度 采用Hallett等[2]的方法。Fura-2/AM负载:超净台内,将原代培养平滑肌细胞的玻片移入自制小培养皿。1 mmol/L Fura-2/AM 4 μ l,0.01 mol/L F-127 20 μ l加入 2 ml培养液摇匀 ,每皿200 μ l,37°C 摇动负载60 min。负载结束后,移除负载液,HEPES缓冲液洗两次后加入180 μ l(或160 μ l)HEPES缓冲液置于显微镜载物台上,按照实验分组,Dex预处理10 min后加入Ach。用filter wheel使激发波长在340 nm和380 nm之间快速切换,发射波长为 510 nm,曝光时间 300 ms。实验中应用MetaFluo软件进行图像分析,记录340 nm和380 nm处荧光强度(F340 nm、F380 nm)及F340 nm/F380 nm比值(简称ratio值)。
1.3.3 Western blot 凝胶由质量浓度5%的浓缩胶和7.5%的分离胶组成,凝胶总长10.5 cm,其中浓缩胶1.5 cm,分离胶9 cm。实验步骤如下:去培养液后用温的PBS冲洗2~3遍。加入适量的冰预冷的裂解液后置于冰上10~20 min;刮下细胞,收集在EP管后超声(100~200 w)3 s,2次;4℃、12 000×g离心2 min。取少量上清进行定量;将所有蛋白样品调至等浓度,按80 μ g蛋白计算出所需样品体积上样,60 V恒压电泳约30 min。待染料前沿进入分离胶后,电压改为150 V,待染料达分离胶底部停止。marker所在凝胶部分行考马斯亮蓝染色,样品所在凝胶部分蛋白质180 mA恒流电转印100min湿式转印。丽春红染液染膜20 min,硝酸纤维素膜置于含5%脱脂奶粉的TBS中,37℃振摇1 h封闭。单抗(1∶500)4℃孵育过夜,次日再摇荡孵育1 h。81‰TBS-T洗15 min×3次。HRP标记的山羊抗兔IgG(1∶2 000)孵育 2 h。101‰TBS-T洗15 min×3次。ECL发光试剂盒显影、拍照。
1.4 图像分析
Western blot结果扫描输入电脑后用上海复日图像分析系统分别测定各组目的蛋白和β-actin的积分灰度值,数据处理时用各组积分灰度值除以相应的β-actin灰度值获得相对积分灰度值。设阴性对照组灰度值是100%,背景色为0%。各组Western blot相对灰度值数据与阴性对照组相比求得灰度比值。
1.5 统计学处理
2 结果
2.1 Dex对细胞内游离钙[Ca2+]i浓度上升有快速抑制作用
实验显示,ACh能够使大鼠气道平滑肌细胞内[Ca2+]i立即升高,并很快达到峰值,到达峰值后很快开始回落,至90 s左右重新回到基态水平。给予不同浓度地赛米松预处理10 min后再给与乙酰胆碱刺激,其峰值与对照组比较显著降低(10-6mol/L,P<0.01;10-7mol/L,P<0.05),10-8mol/L时,虽有下降趋势,但统计未见显著差异(表1)。
Tab.1 Dex(dexemisone)inhibit peak of[Ca2+]i in airway smooth muscle cells(Ratio340/380,±s,n=10)
*P<0.05,**P<0.01 vs control group
Group Peak[Ca2+]i Resting values[Ca2+]i Control 0.89±0.06 0.56±0.03 ACh+Dex(10-8) 0.85±0.05 0.55±0.04 ACh+Dex(10-7) 0.77±0.06* 0.56±0.05 ACh+Dex(10-6) 0.69±0.04** 0.54±0.04
2.2 RU486和CHX对Dex抑制游离钙上升作用没有显著影响
浓度10-6mol/L的选择性糖皮质激素核受体拮抗剂RU486温浴细胞60 min,对于10-7mol/L的Dex抑制[Ca2+]i升高的作用没有明显影响(表2),10-5mol/L蛋白合成的阻断剂CHX处理细胞,温浴60 min,对于Dex抑制细胞内[Ca2+]i升高的作用同样没有明显的影响(表3),两者本身对胞内游离钙浓度亦无显著影响。
Tab.2 RU486(Roussel-Uclaf 38486)with the inhibitory effect of Dex(dexemisone)(Ratio340/380, ±s,n=10)

Tab.2 RU486(Roussel-Uclaf 38486)with the inhibitory effect of Dex(dexemisone)(Ratio340/380, ±s,n=10)
*P<0.05 vs control group
Group Peak[Ca2+]i Resting values[Ca2+]i Control 0.87±0.05 0.55±0.04 ACh+RU486 0.86±0.05 0.55±0.03 ACh+Dex 0.76±0.06* 0.53±0.05 ACh+Dex+RU486 0.77±0.04* 0.56±0.04
Tab.3 CHX(cycloheximide)with the inhibitory effect of Dex(dexemisone)(Ratio340/380,±s,n=10)
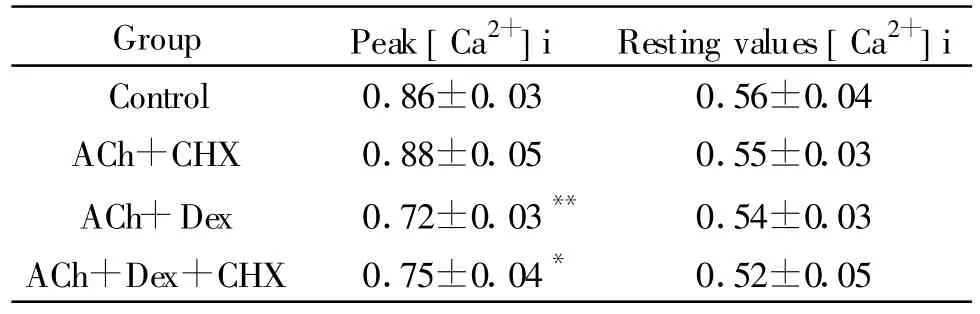
Tab.3 CHX(cycloheximide)with the inhibitory effect of Dex(dexemisone)(Ratio340/380,±s,n=10)
*P<0.05,**P<0.01 vs control group
Group Peak[Ca2+]i Resting values[Ca2+]i Control 0.86±0.03 0.56±0.04 ACh+CHX 0.88±0.05 0.55±0.03 ACh+Dex 0.72±0.03** 0.54±0.03 ACh+Dex+CHX 0.75±0.04* 0.52±0.05
2.3 Dex对细胞内抑制型PLC含量有快速上调作用
Western blot结果显示,细胞内抑制型PLC分子(phospho-PLCβser1105)含量在各浓度Dex处理组相对灰度值均高于阳性对照组,具有统计学差异(10-6mol/L 、10-7mol/L,P<0.01;10-8mol/L,P<0.05),并且随GCs浓度上升灰度有升高趋势(图1)。
2.4 RU486和CHX对Dex上调抑制型PLC含量作用无显著影响
Western blot实验中同时设立了Dex 10-7mol/L条件下RU486和CHX对照组,平滑肌细胞经10-6mol/L RU486及10-5mol/L CHX温浴60 min不能显著影响Dex对于细胞内抑制型PLC分子(phospho-PLCβser1105)含量的上调作用(P>0.05,图1)
3 讨论
气道平滑肌是气道壁的重要组成部分,是气道各组成成分中伸缩性最强的组织类型,对于气道直径的调节起着重要的作用。哮喘急性发作时,气道管径急剧减小甚至某些小气道的闭塞,是造成呼吸困难最主要的原因之一。传统的观念认为,糖皮质激素(GCs)在哮喘治疗中的作用是通过基因转录及蛋白合成最终实现,通常需要数小时甚至数天的时间[3]。而Ketchell早期报道过吸入氟替卡松(fluticasone)能够快速缓解气道的局部过敏反应[4],周建等也在实验中发现,吸入GCs能够在10 min内有效地减轻免疫反应引起的豚鼠气道梗阻,维持呼吸的潮气量和肺顺应性。进一步细胞水平实验显示,豚鼠气道平滑肌细胞的收缩能被布地奈德快速抑制[5]。这些作用可能是通过糖皮质激素的非基因组效应实现的,但其中的机理并不清楚。
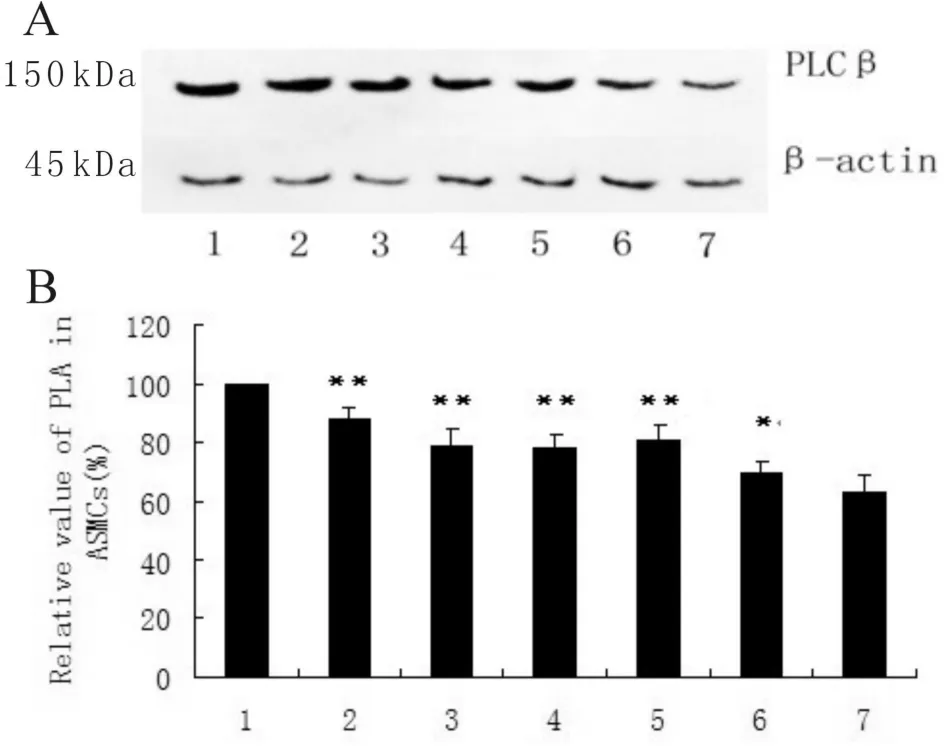
Fig.1 Dex elevated the intracellular levels of phospho-PLCβ(ser1105).Neither the RU486(Roussel-Uclaf 38486)nor CHX(cycloheximide)could alter the effects(n=5)A:Immunoblot for Phosphor-PLCβ(ser1105)of ASMCs in different treatment of Dex;B:Relative values of immunoblot for Phosphor-PLCβ(ser1105)in ASMCs with different treatment of Dex
本研究显示,预先用Dex温浴大鼠平滑肌细胞10 min后,再用ACh激动细胞,细胞内游离钙峰值[Ca2+]i与对照组比较显著降低(10-6mol/L,P<0.01;10-7mol/L,P<0.05),尤其在Dex浓度高时更加明显。同时,对照实验显示竞争性皮质激素受体阻断剂RU486不能阻断这一效应,这表明该反应不通过与糖皮质激素受体结合即可实现;而蛋白合成阻断剂CHX亦不能阻断该效应则证明这一过程中无新蛋白的合成。
气道平滑肌的收缩状态和平滑肌细胞内的游离钙离子浓度关系密切,其收缩主要由两条途径所介导,即肌球蛋白轻链激酶(MLCK)途径和蛋白激酶C(PKC)途径,其中又以前一条途径比较重要[6]。
PLC作为MLCK通路和PKC通路共同的枢纽性蛋白,与G蛋白直接作用的信号分子,其中PLCβ催化活性最为强大且在平滑肌细胞内含量最高的亚型[7]。PLCβ第1105位的丝氨酸(ser)是PLC重要的抑制性磷酸化位点,该位点磷酸化时酶催化区域的构形发生变化,与催化对象的亲和力显著减弱,其酶活性随之下降,PLC处于活性抑制状态,对PIP2分解的催化效应明显降低[8]。在PLC的这一变化中,其蛋白的编码顺序和蛋白成分并没有发生变化,只是在1105位上的丝氨酸发生了磷酸化状态的变化,磷酸化反应的发生只需要很短的时间,这也和本实验发生速度快,不经过基因转录和蛋白重编码的假设是相符和的。
本研究显示,Dex处理大鼠平滑肌细胞10 min能够使细胞内PLCβ-1105ser磷酸化分子含量增加,并且和呈现出剂量效应关系,可见,糖皮质激素能够通过某种机制使PLC发生1105位丝氨酸的磷酸化,明显降低PLCβ催化活性,从而使其下游的一系列反应受到抑制。首先,影响MLCK途径的信号转导,PLC活性降低,其催化产生的下游信号分子IP3减少,肌浆网上IP3受体结合减少,胞内钙释放受抑制,平滑肌细胞内游离钙浓度上升幅度减小,使细胞收缩强度下降。其次,影响 PKC途径,其催化的PIP2能力下降,故分解产物DAG产生减少,对PKC激活率降低,PKC途径对平滑肌细胞收缩的影响由此减弱,此外,PKC的活化同时依赖于细胞内钙的浓度升高[9],故细胞内钙浓度的下降本身对于PKC的活性就是一个下调的因素。当然,影响PKC活性的影响因子很多,PLC的活性只是其中一个方面。有报道指出,PKC本身对PLC的活性也有反馈调节作用,活化的PKC能够使PLC分子1105位的ser发生磷酸化,抑制PLC的活性[10],从而抑制胞内游离钙升高,减轻平滑肌细胞收缩强度。
实验中,我们还设立了Dex 10-7mol/L条件下GCs核受体阻断剂RU486对照组和蛋白合成阻断剂CHX对照组,提前给予10-6mol/L RU486及10-5mol/L CHX温浴60 min,对于Ach激动的胞内游离钙升高及Dex上调平滑肌细胞内PLCβ-ser1105磷酸化分子含量的作用均没有显著影响。这进一步证实了在本实验中Dex引起的PLCβ活性变化为非基因组效应介导,不需与核受体发生特异性的结合,反应中没有蛋白合成。
本实验验证了糖皮质激素可以快速抑制[Ca2+]i浓度升高,并且上调细胞内抑制型PLC的含量,从而抑制乙酰胆碱引起的下游反应,减轻平滑肌细胞收缩强度;该作用可在短时间内发生,不需要通过糖皮质激素的经典途径,可能是通过非基因组机制实现的,但具体机制尚不明。这种快速非基因组抑制作用,为糖皮质激素在哮喘急性发作时的吸入治疗的作用机理提供了新的理论依据,为临床新药开发思路提供了新的研究方向。
[1]Charmandari E,Kino T,Chrousos G P.Glucocorticoids and their actions:an introduction[J].Ann N Y Acad Sci,2004,1024:1-8.
[2]Hallett M B,Davies EV,Pettit E J.Fluorescent methods for measuring and imaging cytosolic free Ca2+in neutrophils[J].Methods,1996,9(3):591-606.
[3]Emala,C W,Clancy J,Hirshman C A.Glucocorticoid treatment decreases muscarinic receptor expression in canine airway smooth muscle[J].AmJ Physiol,1997,272(4 pt 1):L745-751.
[4]Ketchell R I,JensenM W,Lumley P,et al.Rapid effect of inhaled fluticasone propionate on airway responsiveness to adenosine 5′-monophosphate in mild asthma[J].J Allergy Clin Immunol,2002,110(4):603-606.
[5]SunH W,Miao C Y,Liu L,et al.Rapid inhibitory effect of glucocorticoids on airwaysmooth muscle contractions in guinea pigs[J].Steroids,2006,71(2):154-159.
[6]Allen B G,Walsh M P.The biochemical basis of the regulation of smooth muscle contraction[J].Trends Biochem Sci,1994,19(9):362-368.
[7]Yue C,Dodge K L,Weber G,et al.Phosphorylation of serine 1105 by protein kinase A inhibits phospholipase Cβ3stimulation by Galphaq[J].J Biol Chem,1998,273(29):18023-18027.
[8]Yue C,Ku C Y,Liu M,et al.Molecular mechanism of the inhibition of phospholipase C β3 by protein kinase C[J].J Biol Chem,2000,275(39):30220-30225.
[9]Buchner K.Protein kinase C in the transduction of signals toward and within the cell nucleus[J].Eur J Biochem,1995,228(2):211-221.
[10]Richardson R M,Ali H,Tomhave,E D,et al.Cross-desensitization of chemoattractant receptors occurs at multiple levels.Evidence for a role for inhibition of phospholipase C activity[J].J Biol Chem,1995,270(46):27829-27833.

