低糖低氧对神经干细胞增殖和代谢的影响*
赵 彤,黄 欣,朱玲玲,熊 雷,张 宽,吴丽颖,刘 兵,吴奎武△,范 明△
(1.军事医学科学院基础医学研究所脑保护与可塑性研究室,北京 100850;2.军事医学科学院307医院,北京 100850)
神经干细胞(neural stem cell,NSCs)是1992年Reynolds等从成年鼠纹状体分离出能在体外不断分裂增殖,具有多种分化潜能的细胞群,并提出了NSCs的概念,即一类具有自我复制更新能力、高度增殖和多向分化潜能的细胞[1]。目前被广泛应用于细胞移植和基因治疗载体的研究。神经干细胞的移植为脑组织损伤的修复治疗提供了有效的手段。
成年动物脑内神经发生主要存在两个区域:一个位于侧脑室的脑室下区(SVZ),该区域能产生新的内源性干细胞,并沿喙侧迁移流迁移至嗅球;另一区域为海马齿状回(DG)的颗粒下层(SGZ),SGZ的干细胞可发育形成新的颗粒细胞[2-3]。近年来的研究发现间歇性低氧处理可促进这种内源性神经干细胞的增殖;脑缺血也可以显著促进成体SVZ和DG的神经再生[4];另一方面,在体脑组织处于一种相对低氧的环境中,平均氧含量为1%~5%,甚至更低。这种低氧或低糖的微环境是如何影响神经干细胞增殖和代谢的,目前尚不知晓。因此,本研究利用体外培养的神经干细胞观察低糖、低氧对大鼠神经干细胞增殖和代谢的影响。
1 材料与方法
1.1 材料
SD孕大鼠(E13.5 d)由北京大学医学院动物中心提供;细胞培养基DMEM/F12(高糖12100-038、低糖 31600-026、F1221700-026,G ibco 公司)、N2、B27(G ibco公司);表皮生长因子(epidermal growth factor,EGF)、碱性成纤维生长因子(basic fibroblast growth factor,bFGF,Promega公司);细胞葡萄糖、乳酸、丙酮酸浓度测定(301医院生化科)。
1.2 NSCs分离培养和鉴定
戊巴比妥钠(1 mg/100g bw)腹腔注射麻醉SD大鼠,取出胚胎,解剖镜下分离中脑,去除脑膜和血管,0.125%胰酶37℃消化30min,终止消化后,将组织吹打悬浮成单细胞,加入相应的细胞培养液(高糖/低糖 DMEM/F12+20ng/L EGF、bFGF+1%N2、B27、谷氨酰胺和双抗),以1×106cells/ml密度接种于25 cm2的细胞培养瓶中,37℃、5%CO2孵箱培养,3-5 d后传代。传至第三代进行以下实验研究。
1.3 不同葡萄糖浓度和低氧条件及分组
实验采用不同葡萄糖浓度的培养液培养以及不同的氧浓度处理:高糖(4.5 g/L,HG)、低糖(1.4 g/L,LG);常氧 (20%O2)、低氧 (3%O2,Thermo 3111,Billups-Rothenberg,Del Mar,CA)NSCs在不同糖浓度下培养至第三代进行低氧处理,分为四组:低糖常氧(Low glucose+Normoxia,L+N)、低糖低氧(Low glucose+Hypoxia,L+H)、高糖常氧(High glucose+Normoxia,H+N)、高糖低氧(High glucose+Hypoxia,H+H);培养 1 d、3 d、5 d 后进行实验。
1.4 CCK-8检测神经干细胞增殖
细胞以 3×104cells/well接种于 96孔板(Costar),每组接种20孔,置于常氧或低氧条件下培养1 d,3 d,5 d,每孔加入10μl cell counting(细胞计数试剂盒CCK-8,日本dojindo),4h后采用酶联仪检测,波长450nm的吸光度值。
1.5 生化分析仪测定细胞培养上清中葡萄糖、乳酸、丙酮酸浓度
细胞以5×105cells/well接种于35 mm培养皿(Costar),每组接种3皿。处理结束后收集细胞,600r/min离心4 min,利用全自动生化分析仪(HITACHI-7600,日本)测定各组细胞培养上清液中葡萄糖、丙酮酸和乳酸浓度,实验重复3次。
1.6 RT-PCR检测代谢相关酶的表达
细胞以 5×104cells/well接种于培养瓶中(Costar),分别置常氧和低氧条件下培养3 d,提取总RNA进行半定量RT-PCR检测,总RNA提取及RTPCR操作过程按试剂盒说明进行。以18S RNA为内参,PCR条件为94℃30s,60℃1 min,68℃2 min,30个循环,68℃7 min。引物序列为:葡萄糖转运蛋白4(glucose transporter,G LUT4:Sense:5’GGCTGTG AGTG AGTGCTTT3’;Anti-sense:5’ GGTTTCTGCTCCCTATCGT 3’;54℃424 bp)。葡萄糖激酶 (glucokinase,GK:Sense:5’ GTG AGGTCGGCATG ATTG 3’,Antisense:5’CCACTTGTG ACACG AAACG 3’,56℃ 357 bp);丙酮酸激酶(pyruvate kinase,PK:Sense:5’G ATGTGG ATCG AAGGGTC 3’,Anti-sense:5’GGTTG AAAG AAATAGGGTGTA 3’,53℃191 bp);乳酸脱氢酶(lactatedehydrogenase,LDH:Sense:5’ACAAGG AGCAGTGG AAGG 3’,Anti-sense:5’GG ACGCTG AGG AAG ACAT 3’,58℃206 bp)。
1.7 统计学分析
2 结果
2.1 低糖低氧对神经干细胞增殖的影响
低糖和高糖培养基培养的NSCs在常氧(20%O2)和低氧(3%O2)条件下分别培养1 d,3 d,5 d后,用CCK-8检测神经干细胞的增殖。结果表明:低糖或高糖组培养的神经干细胞在低氧后3 d和5 d细胞的增殖都比常氧组有明显增加(低糖低氧vs低糖常氧:3 d 1.31±0.0537vs0.5745±0.0488;5 d 3.1401±0.171vs1.7525±0.102;高糖低氧 vs高糖常氧:3 d 1.17±0.0823vs0.416±0.0226;5 d 3.1086±0.1799vs 1.1907±0.0582;P<0.05);而在常氧条件下,低糖组较高糖组的NSCs的增殖在第5天时更为明显(低糖常氧:1.7525±0.102高糖常氧:1.1907±0.0582;P<0.05)。表明低糖或低氧均能促进NSCs的增殖,低氧低糖或低氧高糖的作用尤为明显(图1见下页)。
2.2 低糖低氧对细胞培养上清液中葡萄糖、乳酸、丙酮酸浓度的影响

Fig.1 E ffect of low oxygen and/or low glucose on the proliferation of neural stem cellsin vitro L+N:Low glucose+normoxia;L+H:Low glucose+hypoxia;H+N:High glucose+normoxia;H+H:High glucose+hypoxia
低氧和低糖均能在一定程度上促进神经干细胞的体外增殖,那么该条件下细胞的代谢又发生怎样的变化呢?我们将低糖和高糖培养基培养的NSCs在常氧(20%O2)和低氧(3%O2)条件下分别培养1 d,3 d,5 d后,进一步利用生化分析仪分别测定各组细胞培养上清液中葡萄糖、丙酮酸、乳酸的浓度。结果如图所示:(1)低糖低氧对神经干细胞培养上清液中葡萄糖浓度的影响:随着培养时间的延长,各组细胞培养上清液中葡萄糖浓度有不同程度的下降,高糖常氧组变化很小,只在低氧5 d后才有所下降(高糖常氧:1 d 18.4967±0.2538,3 d 18.4467±0.6269,5 d 17.64±0.4349;P<0.05);而低糖组在合并低氧后,葡萄糖浓度下降速率最为显著(低糖低氧:1 d 9.1875±0.1682,3 d 4.02±0.1757,5 d 0.01±0.01;P<0.05,图 2)。(2)低糖低氧对神经干细胞培养上清液中丙酮酸浓度的影响:细胞培养1 d时,低糖处理组的丙酮酸含量都明显高于高糖处理组(低糖低氧 vs高糖低氧:7.3425±0.0885vs3.2367±0.125;P<0.05),培养至5 d时,低糖处理组丙酮酸浓度迅速下降(低糖常氧 vs高糖常氧:5 d 1.145±0.1812vs0.21±0.0751;P<0.05),以低糖低氧组最为明显(低糖低氧 vs高糖低氧:3 d 3.56±0.0589vs2.3833±0.125;5 d 0.21±0.21vs0.65 ±0.0872;P<0.05,图 3)。(3)低糖低氧对神经干细胞培养上清液中乳酸含量的影响:低糖低氧处理1 d后,低糖组细胞培养上清液中乳酸的含量均高于高糖组,3 d时,各组乳酸含量均有增加,而低糖低氧组增加的幅度最大;培养至5 d时,高糖低氧组含量也有了明显的升高。但高糖组细胞培养上清液中的乳酸含量明显低于低糖组 (表1见下页)。因此,细胞在低糖低氧环境下培养时,细胞的代谢发生明显的变化,特别是糖酵解明显加强,丙酮酸和乳酸的产生明显增加,并随着培养时间的延长,对葡萄糖和丙酮酸的利用增加而导致细胞培养上清液中葡萄糖和丙酮酸的浓度逐渐减少。

Fig.2 G lucose conctration in the media of neural stem cells under low oxygen and/or low glucose

Fig.3 Pyruvic acid concentration in the media of neural stem cells under low oxygen and/or low glucose
2.3 低糖低氧对神经干细胞中代谢相关酶表达的影响
既往的研究表明在低氧促进神经干细胞增殖过程中,低氧诱导因子HIF1是关键的调控因子,我们进一步检测了与代谢相关的HIF1的靶基因表达的变化。神经干细胞在不同的条件下培养3 d后,用RT-PCR的方法检测代谢相关的酶,如葡萄糖转运蛋白4(G LUT4)、葡萄糖激酶 (GK)、丙酮酸激酶(PK)、乳酸脱氢酶(LDH)的表达(图4见下页)。结果显示:在低糖或低氧时,G lut4和PK的表达明显高于对照组。以上结果表明,低氧能促进NSCs的增殖,而以低氧和低糖共同作用时更为明显;在低氧低糖条件下,细胞的代谢发生变化,葡萄糖的利用明显增加,主要通过糖酵解途径代谢产能。
3 讨论
本研究探讨了低氧和低糖对体外培养神经干细胞增殖和代谢的影响。主要作用如下:(1)低氧或低糖都可促进神经干细胞的增殖;(2)低氧和低糖或高糖共同作用一定的时间,促进神经干细胞的体外增殖更为明显;(3)在低氧和低糖条件下,神经干细胞的代谢发生明显变化,葡萄糖的利用增加,丙酮酸和乳酸的产生增加,主要通过糖酵解代谢途径。
Tab.1 Effect of low oxygen and/or low glucose on the lactic acid content(,n=3)
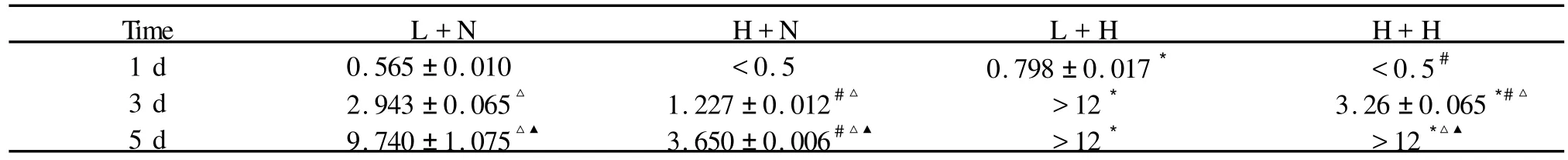
Tab.1 Effect of low oxygen and/or low glucose on the lactic acid content(,n=3)
*P<0.05vsnormoxia;#P<0.05vslow glucose; △P<0.05vs1 d; ▲P<0.05vs3 d
Time L+N H+N L+H H+H 1 d 0.565±0.010 <0.5 0.798±0.017* <0.5#3 d 2.943±0.065△ 1.227±0.012#△ >12* 3.26±0.065*#△5 d 9.740±1.075△▲ 3.650±0.006#△▲ >12* >12*△▲

Fig.4 Representative photography of G lut4,PK,GK and LDH expression in neural stem cells under low oxygen and/or low glucose
目前对于神经干细胞的体外培养都是在常氧(20%O2)和高糖等充分的营养的条件下进行的[5],但这和细胞在体的环境完全不同,如在成年哺乳动物大脑,组织间隙的氧含量约1%~5%,其他区域组织的含氧水平甚至更低[6];特别是脑缺血后引起的组织缺糖缺氧也是利用神经干细胞移植治疗损伤所面临的微环境。因此,在该研究中,神经干细胞在单纯低糖条件下,在培养的第3,5天时细胞的增殖较高糖组明显;加上低氧(3%O2)环境后,在低糖或高糖和低氧的环境中,神经干细胞的增殖更加明显。同样地,细胞在低糖或低氧环境中,代谢都发生了明显的变化,细胞在低氧的环境中主要利用葡萄糖进行糖酵解途径代谢产能,如图3所示,在低糖低氧环境中培养液中的葡萄糖含量明显降低,到培养第5天时几乎降为零;而在高糖环境中,培养液中的葡萄糖含量从培养第5天才开始下降;与此相对应,培养液中丙酮酸含量低氧组较常氧组都明显增加,但随着培养时间的延长而逐渐减少;乳酸的含量则逐渐增加。对体外培养的神经干细胞,虽然低糖和低氧都能在一定的程度上促进其增殖,但由于细胞主要依赖葡萄糖酵解产能,因此,在高糖环境中更能提供足够的葡萄糖而维持细胞持续的增殖。
低氧诱导因子HIF-1是细胞在低氧时关键的调控因子之一,目前发现受其调控的靶基因有60多个,这些基因产物在调节细胞增殖分化、能量代谢、血管重塑等方面发挥了重要作用[7]。我们既往的研究显示,低氧诱导因子HIF1是低氧促神经干细胞增殖的关键调节因子,在低氧促神经干细胞增殖过程中低氧诱导因子(HIF1)的表达增加[8];这里我们用RT-PCR的方法检测了其下游的影响细胞代谢的相关基因的表达,如葡萄糖转运蛋白4(G luT4)、丙酮酸激酶(PK)和乳酸脱氢酶(LDH)。结果表明:在低糖或低氧时G lut4和PK的表达也明显高于对照组。以上结果表明,低氧和低糖通过增加葡萄糖的转运,以及糖酵解途径中丙酮酸激酶的表达,来调节低氧低糖的环境中神经干细胞的代谢发生变化。因而,认识低氧和低糖作为一种有效的刺激信号在调节神经干细胞增殖和代谢中的作用,对于临床某些疾病的治疗提供了新思路。
[1]Reynolds B A,Tetzlaff W,Weiss S.A multipotent EGF-responsive striatal embryonic progenitor cell produces neurons and astrocytes[J].J Neurosci,1992,12(11):4565-4574.
[2]McKay R.Stem cells in the central nervous system[J].Sci,1997,276(5309):66-71.
[3]Gage F H.Mammalian neural stem cells[J].Sci,2000,287(5457):1433-1438.
[4]Zhu L L,Wu L Y,David T Y,et al.Effects of hypoxia on the proliferation and differentiation of NSCs[J].Molecular Neurobiol,2005,31(1-3):231-242.
[5]Studer L,Csete M,Lee S H,et al.Enhanced proliferation,survival and dopaminergic differentiation of CNS precursors in lowered oxygen[J].J Neurosci,2000,20(19):7377-7383.
[6]Silver I,Erecinska M.Oxygen and ion concentrations in normoxic and hypoxic brain cells[J].Adv Exp Med Biol,1998,454:7-16.
[7]Sememza G.Signal transduction to hypoxia-inducible factor 1[J].Biochem Pharmacol,2002,64(5-6):993-998.
[8]Zhao T,Zhang C P,Huang X,et al.Hypoxia-driven proliferation of embryonic neural stem/progenitor cells-role of hypoxia-inducible transcription factor-1alpha[J]. FEBS J,2008,275(8):1824-1834.

