非水相脂肪酶催化合成L-抗坏血酸硬脂酸酯
晏日安, 姜新慧, 张广文, 黄才欢, 段翰英
(暨南大学食品科学与工程系,广东广州 510632)
非水相脂肪酶催化合成L-抗坏血酸硬脂酸酯
晏日安, 姜新慧, 张广文, 黄才欢, 段翰英
(暨南大学食品科学与工程系,广东广州 510632)
研究了非水介质中Novozym 435脂肪酶催化合成L-抗坏血酸硬脂酸酯(L-AS)。脂肪酶用量固定为L-抗坏血酸质量的20%,底物L-抗坏血酸与硬脂酸的摩尔比限定为1∶2,对影响脂肪酶催化的因素如溶剂、温度、溶剂量、反应时间、分子筛用量和摇床转速进行了研究。优化后的反应条件:在30 mL叔丁醇中加入6.82 mmolL-抗坏血酸,13.64mmol硬脂酸,0.24 g脂肪酶和3.0 g 4A分子筛,摇床转速150 r/min,反应在55℃水浴中进行48 h。通过分离提纯,产品采用红外及质谱检测后确定为L-抗坏血酸硬脂酸酯,产率最高时达64.7%。脂肪酶重复使用5次,最低产率为61%。
非水介质;脂肪酶催化;L-抗坏血酸硬脂酸酯;合成
L-抗坏血酸硬脂酸酯(INS 305;CAS(26395-66-8))是微有光泽的白色或黄白色结晶粉末,溶于酒精、乙醚和油脂,对热及重金属较抗坏血酸稳定,美国和日本均有批量生产,目前国内该产品生产企业极少。L-AS一般与L-抗坏血酸棕榈酸酯合用,是一种安全、高效、易被人体消化吸收的脂溶性抗氧化剂,同时也是一种营养强化剂,适合添加在油脂类食品中。目前报道的化学法合成L-AS主要采用直接酯化法[1]、酰氯法[1]和酯交换法[2-3],其产率在50%至77%不等,化学法易产生副反应、腐蚀性强、对设备要求高、对环境污染大。脂肪酶催化法具有反应温和、选择性高、副反应少、对设备要求低和产物易于纯化[4-5]等优点。酶法合成抗坏血酸棕榈酸[6-9]和抗坏血酸月桂酸[10-11]均有大量文献,目前酶法合成L-AS仅有一篇外文文献[12]采用Amano PS脂肪酶催化乙烯基硬脂酸与L-抗坏血酸进行酯交换,国内还没有酶法合成L-AS文献报道。
鉴于酶法催化反应的优点和L-AS应用前景,本文拟采用脂肪酶在非水介质中催化L-抗坏血酸与硬脂酸合成L-AS,对反应条件进行优化,对产物进行提纯并进行鉴定。
1 材料和方法
1.1 主要材料与仪器
Novozym 435脂肪酶:诺维信(中国)广州分公司产品,L-抗坏血酸,硬脂酸,4A分子筛(以下简称分子筛),叔丁醇、叔戊醇、丙酮(经分子筛干燥),甲苯,正己烷:试剂均为分析纯。
SHA-B型水浴恒温振荡器:金坛市宏华仪器厂生产;RE-52 AAB型旋转蒸发器:上海嘉鹏科技有限公司生产;X-5显微熔点测定仪:北京泰克仪器有限公司生产;傅里叶变换红外吸收光谱仪:EQUINOX55;EI低分辨率质谱仪:DSQ,Thermo产品;高分辨率质谱仪:MA T 95XP,Thermo产品。
1.2 L-AS的合成
150 mL具塞锥形瓶中加入0.24 g酶、1.20 g (6.82mmol)L-抗坏血酸、3.88 g(13.64 mmol)硬脂酸、30 mL叔丁醇及3.0 g分子筛,放在55℃水浴恒温振荡器中,以150 r/min的转速振荡反应48 h。
1.3 L-AS的分离纯化过程

1.4 L-AS波谱数据
红外光谱特征峰(未经KBr压片,直接检测): 3 467cm-1,υ-OH;2 916 cm-1、2 849 cm-1,(-CH2, -CH3);1 731 cm-1,υC=O(酯);1 635/1 682 cm-1, υC=C;1 466 cm-1,δas(CH3);1 385 cm-1, δs(CH3);1 161cm-1,δC-O;721 cm-1,-(CH2)n-指纹区特征吸收峰。
EI-MS检测数据(电子轰击能量70 eV;离子源温度250℃;检测器电压1 400 V):442:弱的分子离子峰;424:[M-H2O]信号峰;267为酯键α裂解后[R=CH3(CH2)16CO+]质谱信号;239为[R= CH3(CH2)16CO+]脱去羰基后的质谱信号(强峰)。
FAB-MS检测数据(倍增器电压:1.8KV;基质:3-硝基苄醇):465:[M+Na]+信号峰;443:[M +H]+峰强度加强;267:酯键α裂解后[R=CH3(CH2)16CO+]质谱信号峰;239:[R=CH3(CH2)16CO+]脱去羰基后的质谱信号(强度降低)。
综合红外和质谱数据可判断产物为抗坏血酸硬脂酸酯。
2 结果与讨论
2.1 溶剂对反应的影响
Laane[13]用有机溶剂的极性参数lgP(lgP是该有机溶剂在正辛醇/水体系中的分配系数的对数)来描述有机溶剂对酶催化反应的影响,随着溶剂lgP值降低,酶的水化层会逐渐受到破坏,研究认为lgP<2的有机溶剂不适合作为反应介质,因有机溶剂将强烈破坏酶的必须水化层而使酶失活。150 mL具塞锥形瓶中加入0.24 g脂肪酶、1.20 g (6.82 mmol)L-抗坏血酸、3.88 g(13.64 mmol)硬脂酸、40 mL溶剂、2.0 g分子筛,55℃水浴中以200 r/min振荡反应24 h。表1所示为溶剂对酶催化酯化的影响。正己烷的lgP>2,脂肪酶能较好的保持原有构象,但在正己烷中不能催化L-AS的合成。表1显示脂肪酶在lgP<2的3种溶剂中都具有较强的催化能力。丙酮的lg P相对较低,其作为溶剂对酶的活性有一定破坏作用。以叔丁醇为反应溶剂时所得产率最高(见表1)。故下一轮选择叔丁醇为反应介质。
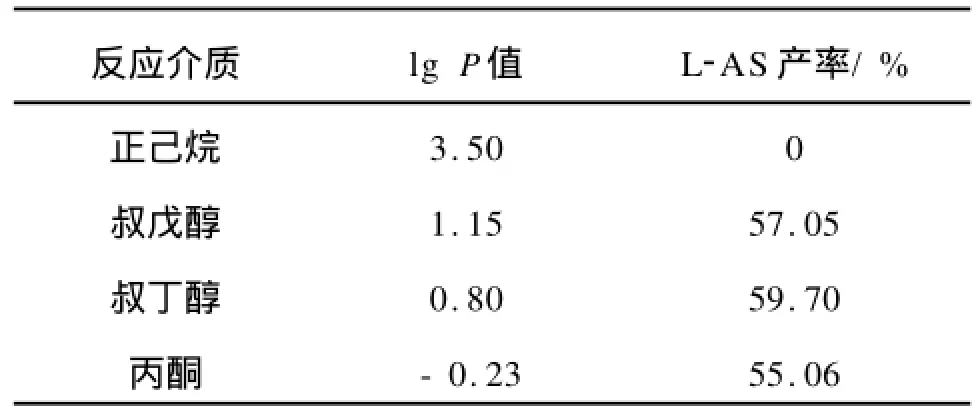
表1 溶剂对反应的影响Tab.1 Effect of solvents on the reaction
2.2 温度对反应的影响
固定化的Novozym 435脂肪酶催化酯化反应的适宜温度在40~70℃之间[14]。温度对Novozym435脂肪酶催化抗坏血酸与硬脂酸酯化反应的影响如图1所示。

图1 温度对反应的影响Fig.1 Effect of temperature on the reaction
由图1可见,反应温度为55℃时,反应所得产率最高,表明此时酶催化能力最强,在此温度下脂肪酶有较好的温度稳定性;温度低于55℃时,产率随温度升高而增加,这是因为温度的提高加快了底物分子的热运动速度、激发了酶的活性中心催化能力,从而使酶与底物的结合以及酶与产物的分离速度大大提高。当温度高于55℃,产率会随温度升高而下降,这与温度过高酶的活性中心受到破坏以及抗坏血酸因高温部分分解有关。故选择55℃作为下一轮反应的温度。
2.3 溶剂用量对反应的间接影响
0.24 g脂肪酶催化1.20 g L-抗坏血酸与3.88 g硬脂酸进行48 h的酯化反应。硬脂酸在叔丁醇中易溶,而L-抗坏血酸却难溶于叔丁醇(55℃水浴、摇床转速150 r/min下每10 mL叔丁醇约溶解0.04 g L-抗坏血酸)。随着溶剂量从10 mL增加到50 mL,硬脂酸浓度从1.364 mol/L减少到0.273mol/L,抗坏血酸处于饱和状态。固定物料投入量后,溶剂量的变化可改变底物浓度和酶浓度,还会影响反应体系的传质,所以底物浓度、酶浓度以及传质对酯化反应影响可通过溶剂量与产率的间接关系反映出来见图2。
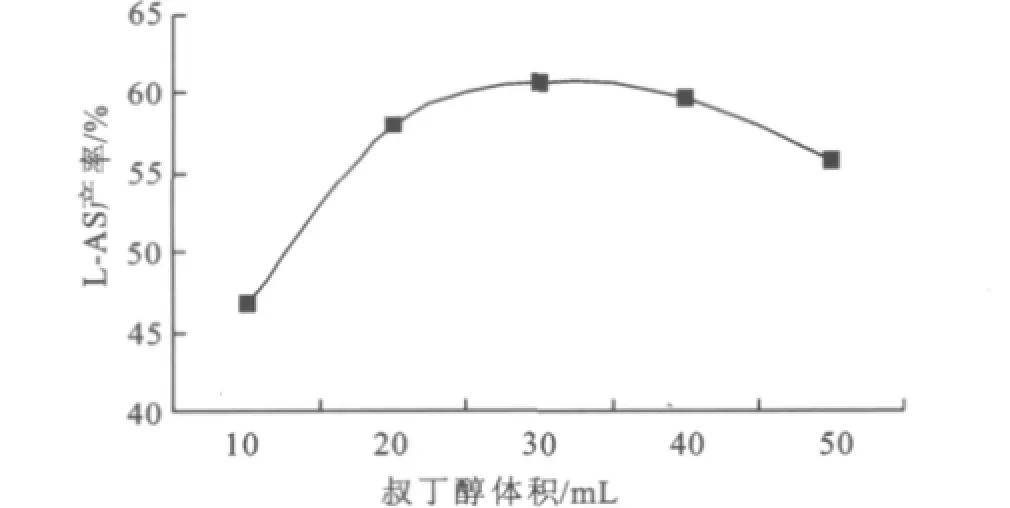
图2 叔丁醇用量对反应的间接影响Fig.2 Indirectly effect of t-butanol alcohol consumption on the reaction
图2所示,叔丁醇用量30 mL时,产率最高。溶剂少于30 mL时,产率随溶剂用量增加而上升,这与溶剂中抗坏血酸的溶解量增加、产物得到较好的分散、分子筛对传质的影响降低有关。溶剂用量大于30 mL时,产率降低,原因是溶剂的增加降低硬脂酸浓度和酶浓度,反应体系搅拌不均使酶在反应液中分布不均,上述原因降低了底物和酶的有效碰撞率。所以下一轮反应中溶剂用量以30 mL为宜,即硬脂酸浓度为0.455 mol/L。
2.4 时间对酯化反应的影响
酶促L-AS合成是一个可逆的平衡反应,反应时间短产率低,时间过长又不能明显提高产率,副反应还会随之增多(见图3)。
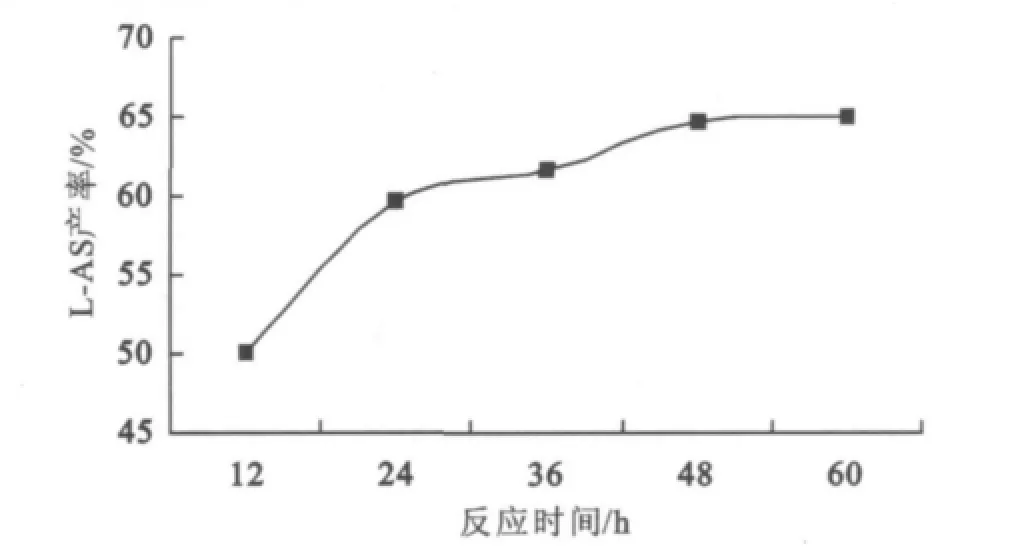
图3 时间对酯化反应的影响Fig.3 Effect of reaction time on the esterification reaction
图3显在48 h前,产率随时间延长而上升,这与反应逐步接近平衡有关;反应48 h后,产率无明显增加,表明反应已达到平衡,延长反应时间不会提高反应产率反而增加了合成成本。因此下一轮反应时间限定在48 h。
2.5 分子筛用量对反应的影响
4A型分子筛可吸收水、氧气、甲醇、乙醇等物质,是一种大容量的高效吸水剂。直接酯化法合成L-AS,水是反应副产物,向反应体系中投入分子筛吸水可使反应平衡右移有利于提高酯化产率。30 mL反应液中分子筛用量与产率关系如图4所示。
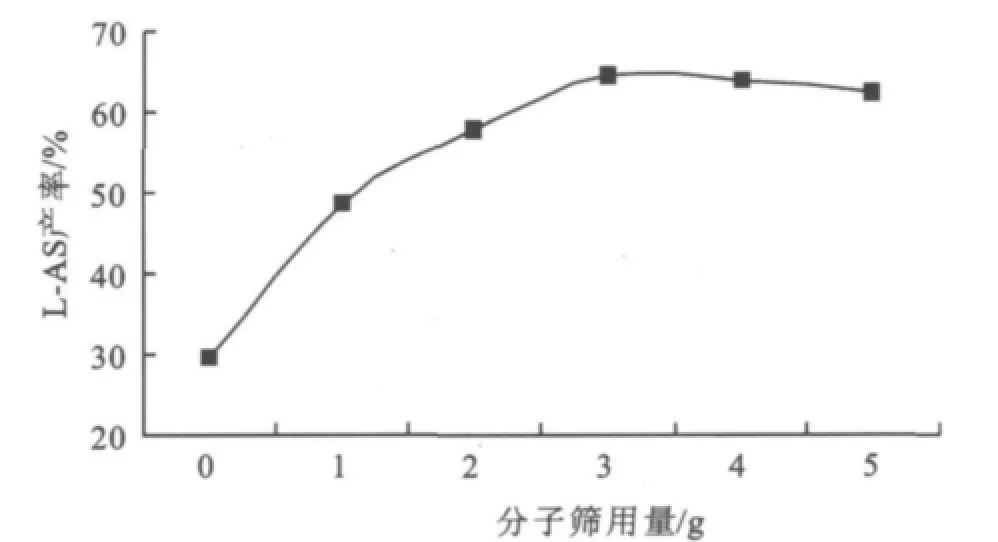
图4 分子筛用量对反应的影响Fig.4 Effect of molecular sieves amount on the reaction
图4显示当体系中不加分子筛时,产率非常低,这是副产物水使平衡向左移的缘故;增加分子筛投入量,产率随之上升,原因是分子筛吸收水后,打破原有反应的平衡,使酯化反应平衡右移。当分子筛用量为3.0 g时,产率达到最高。分子筛用量超过3.0 g时,产率开始下降,分子筛加入过多的吸水效应导致酶自身的微环境破坏,也会阻碍体系中传质以及造成固定化酶的脱落。因此选择在下一轮反应中每30 mL的反应液加入3.0 g分子筛。
2.6摇床转速对反应的影响
酶催化效率受到反应体系扩散速度的影响,摇床转速的不同可以带来反应体系外扩散速度的变化。转速对反应影响如图5所示。
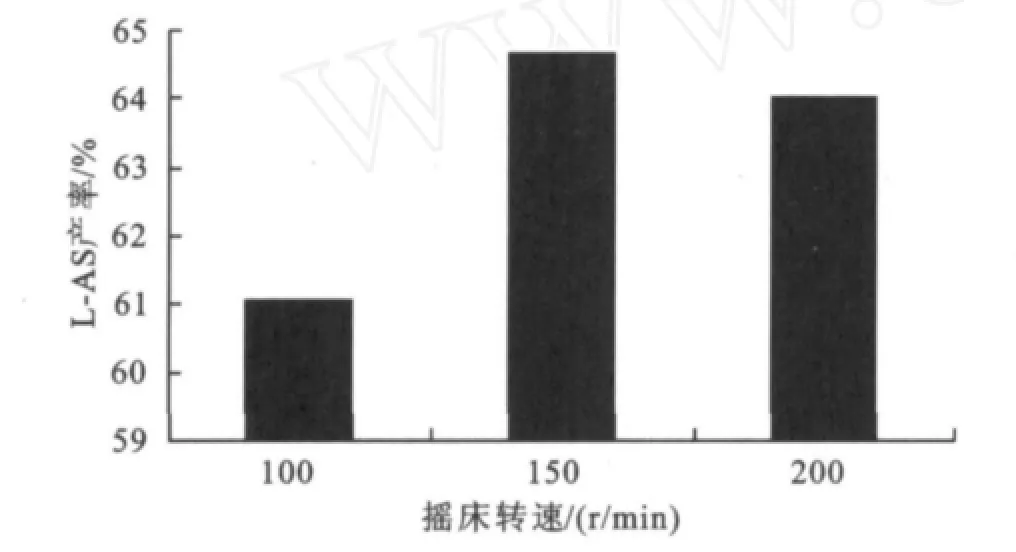
图5 摇床转速对反应的影响Fig.5 Effect of shaker speed on the reaction
图5可见当转速为100 r/min时产率最低,原因是底物及产物的扩散速度较低,降低了酶催化的效率。转速为150 r/min时,产率最高为64.7%。当转速为200 r/min时,产率有所降低,由于转速加快,加剧了反应体系中脂肪酶与分子筛、瓶壁之间的碰撞,使固定化的脂肪酶磨损而脱落,改变了部分酶的结构,从而掩盖了外扩散速度加快带来的有利影响。故下一轮反应选择转速150 r/min。
2.7 酶使用次数的影响
脂肪酶的价格昂贵,所以我们对酶重复使用进行了考察(除酶外,其余反应条件与上一致)。多次使用的结果如图6所示。
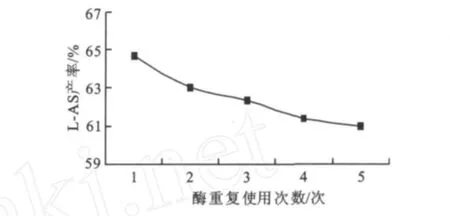
图6 酶重复使用次数对反应产率的影响Fig.6 Effect of enzyme reused times on the yield of reaction
图6显示当酶连续使用5次的催化产率都在61%以上,然而产率随使用次数增加呈缓慢下降,这与固定化酶的多次使用所造成的部分酶脱落及活性中心失活有关。因此在生产中酶可连续使用5次,保持每次的催化效果与新酶基本相当,这可以明显降低成本。
3 结 语
成功的用脂肪酶催化L-抗坏血酸与硬脂酸合成了L-抗坏血酸硬脂酸酯,并优化了酶法合成条件,最佳条件下的产率为64.7%,提纯工艺简单有效,酶可多次使用,有很好的发展前景。相对于传统的化学法合成,选择用酶法合成L-AS更符合绿色化学的发展要求。目前酶催化法合成L-AS离实现工业化生产有一定距离,为提高酶法合成的产率并降低成本,未来研究的重点将是寻找更高效的催化酶和更优的反应条件以及反应规模的扩大。
[1]黄绍华,胡国华,肖建军.L-抗坏血酸硬脂酸酯的合成及其抗氧化作用[J].食品工业,1999,(3):28-29.
HUANG Shao-hua,HU Guo-hua,XIAO Jian-jun.Synthesis L-ascorbyl stearate and its antioxidant effect[J].Food Industry,1999,(3):28-29.(in Chinese)
[2]谢文磊,李魁,王宏雁.酯交换法合成L-抗坏血酸硬脂酸酯及其抗氧化性能[J].高校化学工程学报,2002,16(4):441-445.
XIE Wen-lei,LI Kui,WANG Hong-yan.Synthesis of L-ascorbyl stearate by transesterification and its antioxidant effect [J].Journal of Chemical Engineering of Chinese Universities,2002,16(4):441-445.(in Chinese)
[3]雷琳.L-抗坏血酸硬脂酸酯的合成条件探索[J].广东化工,2009,(6):72-73.
L EI Lin.Study on synthesis condition of L-ascorbyl stearate[J].Guangdong Chemical Industry,2009,(6):72-73.(in Chinese)
[4]李炎.食品添加剂制备工艺[M].广州:广东科技出版社,2001.163-164.
[5]张晓鸣,周健,刘巧瑜,等.有机相脂肪酶催化合成技术在食品及相关领域的应用[J].食品与生物技术学报,2006,25 (1):120-126.
ZHANG Xiao-ming,ZHOU Jian,LIU Qiao-yu,et al.Application of lipase-catalyzed synthesis in organic solvent for food and related industry[J].Journal of Food Science and Biotechnology,2006,25(1):120-126.(in Chinese)
[6]Humeau C,Girardin M,Coulon D,et al.Synthesis of 6-O-palmitoyl L-ascorbic acid catalyzed by candida antartica lipase [J].Biotechnol Lett,1995,17(10):1091-1094.
[7]Humeau C,Girardin M,Rovel B,et al.Enzymatic synthesis of fatty acid ascorbyl esters[J].J Mol Catal B:Enzym, 1998,(5):19-23.
[8]Hsien H J,Nair G R,Wu W T.Production of ascorbyl palmitate by surfactant-coated lipase in organic media[J].J Agric Food Chem,2006,(54):5777-5781.
[9]徐凤杰,谭天伟.生物法合成维生素C棕榈酸酯[J].生物工程学报,2005,21(6):988-992.
XU Feng-Jie,TAN Tian-Wei.Biologicals Synthesis of L-ascorbyl palmitate[J].Chinese Journal of Biotechnology,2005, 21(6):988-992.(in Chinese)
[10]Chang S W,Yang C J,Chen F Y,et al.Optimized synthesis of lipase-catalyzed L-ascorbyl laurate by novozym 435[J]. J Mol Catal B:Enzym,2009,(56):7-12.
[11]蔡水根,陶冠军,熊幼翎,等.L-抗坏血酸月桂酸酯的酶法合成、分离及其性质[J].食品工业科技,2008,10(29):211-215.
CAI Shui-gen,TAO Guan-jun,XIONG You-ling,et al.Enzymatic synthesis,separation and properties of L-ascorbyl laurate[J].Science and Technology of Food Industry,2008,10(29):211-215.(in Chinese)
[12]Sakashita K,Miyamoto S,Sakimae A.process for producing ascorbic or erythorbic acid esters:European Patent,0 514 694[P].1992.
[13]Lanne C,Boeren S,Veeger K,et al.Rules for optimization of biocatalysis in organic solvents[J].Biotechnol Bioeng, 1987,(30):81-87.
[14]潘宇.抗坏血酸苯甲酸酯的生物合成与性能研究[D].杭州:浙江大学,2006.
(责任编辑:杨萌)
Lipase-catalyzed Synthesis of L-ascorbyl Stearate in Non-aqueous Phase
YAN Ri-an, J IANG Xin-hui, ZHANG Guang-wen, HUANG Cai-huan, DUAN Han-ying
(Department of Food Science and Engineering,Jinan University,Guangzhou 510632,China)
In this manuscript,the technical conditions of Novozym 435 lipase-catalyzed synthesis of L-ascorbyl stearate(L-AS)in non-aqueous medium were determined with 20%lipase and 1:2 L-ascorbic acid to stearic acid(molar ratio).The optimum reaction conditions listed as follows: 30ml t-butanol with 6.82mmol L-ascorbic acid,13.64mmol stearic acid,0.24g lipase and 3.0g 4A molecular sieves,shaker speed 150r/min,the reaction carried out at 55℃water bath with 48h.Through the separation and purification,the isolated product was finally identified as L-ascorbyl stearate by infrared(IR)and mass spectrometry(MS)detection,the highest yield reached 64.7%.Lipase reused five times,the lowest yield was 61%.
non-aqueous medium,lipase-catalyzed,L-ascorbyl stearate,synthesis
TS 201.2
:A
1673-1689(2010)03-0385-05
2009-05-12
广东省高校科技成果转化重大资助项目(cgzhzd0805)。
晏日安(1962-),男,湖南益阳人,工学博士,教授,主要从事食品添加剂制备与应用研究。Email:jxh830923@163.com

