人脐血细胞静脉移植对自发性高血压大鼠缺血再灌注脑损伤疗效及其机制探讨
胡 柯, 余国龙, 欧雅莉, 涂秋云, 杨天伦
近年国内外实验研究表明干细胞移植治疗缺血性脑卒中能有效改善或恢复脑卒中等中枢神经系统疾病所损害的神经功能,其中多数研究是应用骨髓间质干细胞为移植细胞[1]。近期国内外有研究者尝试采用经颅脑内直接或静脉移植人脐血细胞(HUCBCs)移植治疗脑缺血,也证实有与骨髓间质干细胞相似的疗效[2,3],但上述研究均采用血压正常、缺乏脑血管基础病变的 SD或 Wister大鼠制备脑缺血实验模型。本研究采用有脑血管病变基础的自发性高血压大鼠(SHR)制备脑缺血实验模型,观察经静脉移植 HUCBCs对局灶性脑缺血大鼠神经损伤、脑组织梗死面积的影响;探讨 HUCBCs静脉移植治疗局灶性脑缺血的疗效及其机制,为脐血细胞在人类缺血性心脑血管疾病治疗中的应用提供实验依据。
1 材料和方法
1.1 材料
1.1.1 实验动物 84只 2~3m龄雄性自发性高血压大鼠(体重 250±30g),由上海斯莱克实验动物有限公司提供。每只大鼠至少测量 10次尾动脉压,收缩压平均值均在 160mmHg以上。
1.1.2 主要实验材料 人脐血标本取自湖南省妇幼保健院产科健康妊娠产妇,IMDM细胞培养基、淋巴细胞分离液、氯化三苯基四氮咪(TTC)、DAPi、琼脂糖 、台盼蓝 、鼠抗 BDNF单克隆抗体、TRIzol、逆转录试剂盒、RNA酶抑制剂、DNA聚合酶、dNTPMix脱氧核苷酸、DNA分子量 marker等。
1.2 方法
1.2.1 HUCBCs的分离、培养以及 DAPi染色
(1)HUCBCs的体外分离、纯化和培养参照 6%HES法[4]。(2)DAPi标记:移植前 1d取 P3代细胞,10μg/ml DAPi的 IMDM培养基过夜;(3)移植细胞收集:移植前1h离心HUCBCs,PBS清洗掉未结合的 DAPi,调整悬液细胞密度为 1×106/ml。(4)HUCBCs活性检测:移植前取 1滴细胞悬液,2%台盼蓝染色,显微镜观察。
1.2.2 大鼠局灶性脑缺血再灌注模型建立与实验分组 SHR参照 Zea Longa线栓法[5]建立MCAO模型。术后 24h参照 Bederson法[6]对存活大鼠行神经行为学评分,评分 1分以上者定为造模成功。100只 SHR造模成功 68只(68.0%),术中术后死亡 24只,造模失败 8只。术后 48h造模成功的SHR随机分配入治疗组与对照组各 34只。
1.2.3 HUCBCs移植 移植过程在无菌条件下进行,MCAO术后 48h对大鼠进行 HUCBCs移植。10%水合氯醛(0.3ml/100g)腹腔注射麻醉,20%甘露醇 0.5ml,1ml 1×106个 HUCBCs先后经尾静脉注入治疗组大鼠,对照组注射甘露醇后,继之同体积HUCBCs细胞培养基注射。
1.2.4 脑梗死面积检测 移植后 3、14、28d分别随机取治疗对照组 SHR各 5只,Bederson评分后按照以下步骤处理:10%水合氯醛深度麻醉,37℃生理盐水心内灌注,迅速取脑,冰冻 30min,冠状位间隔 2mm连续做 5等份切片,置入 2%TTC避光染色20min,10%甲醛溶液固定过夜。脑组织标本平铺照相后,德国 KONTRON-IBAS2.5自动图像分析系统计算梗死范围占全脑面积的百分比。
1.2.5 脑组织标本 DAPi标记细胞示踪 移植后 3、14、28d分别随机取治疗和对照组各 2只 SHR取大脑后浸于多聚甲醛液固定,冠状位冰冻切片,片厚 50um。选择含梗死灶部位脑组织连续冠状切片 5张,荧光显微镜下计数梗死侧与正常侧脑组织 DAPi标记阳性蓝色荧光细胞数平均值。
1.2.6 脑组织标本 BDNF免疫组化以及 mRNA表达的测定 移植后 3、14、28d分别随机取治疗和对照组 SHR各 3只,取脑组织,石蜡包埋,连续冠状位切片,按照试剂盒说明书行 BDNF抗体两步法免疫组化染色,光镜下计数每切片梗死侧与正常侧脑组织 BDNF阳性细胞数平均值。14,28d时再随机选取治疗和对照组中大鼠各 2只,取缺血坏死核心区部位大脑组织,常规提取 RNA并行逆转录反应,合成 cDNA。用 Primer软件设计引物序列,用 β-actin为内参基因,行 PCR扩增反应。产物和 DNA Marker于琼脂糖凝胶中电泳,凝胶扫描系统分析电泳结果。计算 BDNF与 β-actin产物 OD比值,做为BDNFmRNA表达的半定量结果,重复测量 5次并取平均值。
1.2.7 统计学分析方法 SPSS13.0统计软件行统计学分析。多样本均数比较采用方差分析,两组比较采用 t检验,所有测定值用±s表示,P<0.05为统计学差别显著。
2 结 果
2.1 HUCBCs移植对局灶性脑缺血大鼠神经功能和脑梗死面积的影响
两组大鼠神经功能评分和两组脑梗死面积百分比比较见表1、图1、图2。移植后 3d两组神经行为学评分和脑梗死面积百分比无显著差别,但移植后14、28d,治疗组神经行为学评分和脑梗死面积均明显低于对照组和移植后 3d的治疗组 (p<0.05)。
2.2 大鼠脑组织 DAPi HUCBCs阳性细胞计数
治疗组移植后 3d梗死侧见少量蓝色荧光 DAPi阳性染色细胞(见图3),与 3d比较,移植后 14、28d时梗死侧阳染细胞计数增加(见表2、图4)(P<0.05)。
2.3 BDNF免疫组化及 mRNA表达水平检测
光镜下 BDNF阳染细胞呈棕黄色,主要位于治疗组和对照组缺血侧大脑皮质下及海马等处。移植后各时间点 BDNF染色阳性细胞比较见表3,对照组缺血侧各时间点 BDNF染色阳性细胞数均显著高于其正常侧,治疗组缺血侧各时间点 BDNF染色阳性细胞数均显著高于其正常侧和对照组缺血侧(见图5、图6)。图7为治疗组与对照组大鼠缺血侧脑组织 BDNF mRNA凝胶电泳图,BDNFmRNA扩增产物长度约为 259bp,位于凝胶近端,β-actin产物长度约为 90bp,位于远端。凝胶扫描系统分析各组 BDNF mRNA表达的半定量值,14d时治疗组为 0.62±0.13,对照组为 0.42±0.09;28d时治疗组为 0.72±0.08,对照组为 0.50±0.10。相应时间点治疗组BDNF mRNA表达水平高于对照组(P<0.05)。
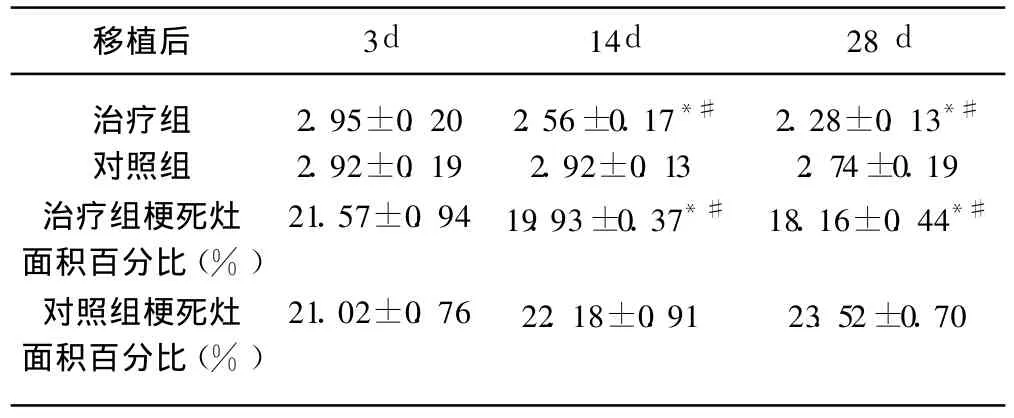
表1 各时间点大鼠神经功能评分和梗死灶面积百分比比较
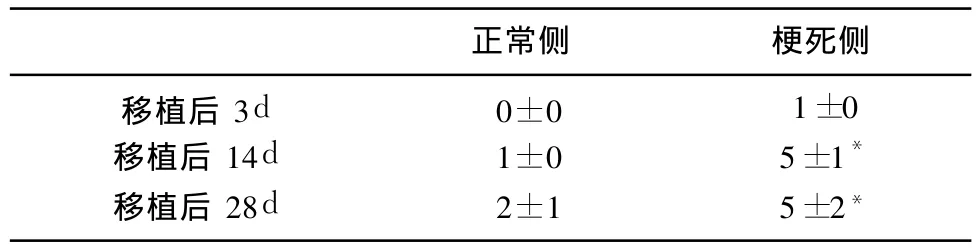
表2 各时间点移植组大鼠脑组织DAPi示踪细胞计数

表3 各时间点治疗组、对照脑组织免疫组化BDNF阳性染色细胞计数比较
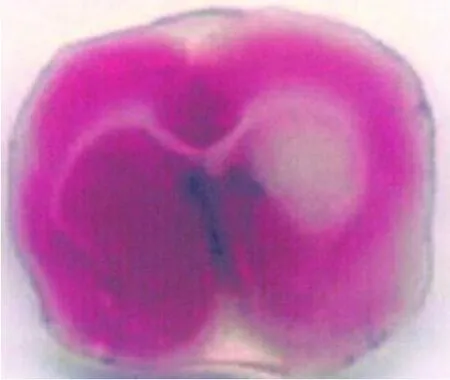
图1 28d治疗组鼠脑组织 TTC染色

图2 28d对照组鼠脑组织 TTC染色

图3 3d荧光显微镜下 DAPi阳性细胞(10×10倍)

图4 28d荧光显微镜下 DAPi阳性细胞(10×10倍)

图5 14d治疗组缺血损伤周围脑组织 BDNF免疫组化染色(10×10倍光镜下)

图6 14d时对照组缺血损伤周围脑 BDNF免疫组化染色(10×10倍光镜下)

图7 治疗组与对照组大鼠缺血侧脑组织 BDNF mRNA凝胶电泳图
3 讨 论
本研究采用有脑血管病变基础的 SHR制备脑缺血实验模型,以探讨经静脉移植 HUCBCs对局灶性脑缺血大鼠的治疗疗效及其机制,目前国内外均未见类似报道。本研究结果证实对 SHR采用线栓法制备局灶性脑缺血/再灌注模型成功率较高,梗死部位主要集中于 MCA供血区纹状体、皮质下白质和部分皮质,并且神经功能损伤肯定。已有研究[7]显示 SHR脑血管解剖结构与人类相近,而且具有与人类高血压病相似的脑血管病理变化基础。故用其制备局灶性脑缺血模型,可能更接近接近人类脑血栓形成发病或脑缺血及缺血再灌注过程,其实验结果对临床更有指导意义。
Ha等研究证实超过 60%的 HUCBCs在表达CD133的同时亦有 Nestin的表达[8],说明 HUCBCs可向神经细胞方向分化;Borlongan等研究[9]显示脐血干细胞移植后鼠卒中模型神经功能缺失得以改善。与目前大多数研究采用的骨髓干细胞比较,HUCBC有以下优势[10]:(1)采集简单、来源广泛,对孕妇和婴儿无风险;(2)对 HLA不合抗原易耐受,组织配型要求低,宿主抗移植物反应和移植物抗宿主反应的发生率低和程度轻;(3)脐血干细胞有较强的自我繁殖能力,临床应用治疗血液病等已 20年,安全可靠,利于今后临床推广应用。
虽然经颅脑内细胞移植是细胞移植治疗脑梗死等中枢神经系统疾病经典途经,但近期 Willing等[11]对 MCAO脑梗死实验大鼠分别经静脉或经颅脑内移植 HUCBC,发现治疗 2m后只有经静脉移植的实验大鼠阶梯运动试验指标明显改善。本研究是经静脉移植 HUCBCs,结果表明能显著改善 SHR局灶性脑缺血神经功能,减低脑组织梗死面积;且疗效以移植后 14~28d更为显著。综合上述至少可以说明经体循环移植是对脑梗死进行细胞移植治疗另一有效途径,其方法简单、无创、能大剂量、重复移植,易被患者接受,适于今后临床推广应用。
本研究还对 HUCBCs经静脉移植治疗 SHR局灶性脑缺血疗效机制进行初步探讨。结果显示 DAPi阳性染色细胞主要分布在梗死侧脑组织,移植后14~28d阳性染色细胞数增多;证实了经静脉移植HUCBCs能通过血脑屏障迁入脑组织内,还能在内增殖。本研究结果还显示治疗组 BDNF阳染细胞主要位于缺血侧大脑皮质下以及海马等处,BDNF阳染细胞数均高于其正常侧和对照组缺血侧,且移植后 14,28d治疗组缺血侧脑组织 BDNF mRNA表达水平均显著高于对照组。综合上述结果表明HUCBCs经静脉移植能迁入受损脑组织并在其内增殖,促进自分泌或旁分泌神经营养因子产生增加,这可能与 SHR脑缺血再灌注损伤神经功能的改善以及脑梗死面积的缩小有关。目前 HUCBCs静脉移植对脑缺血再灌注损伤的疗效机制还未完全明了,可能的机制是:(1)神经营养因子对缺血损伤神经元的保护作用,HUCBCs经静脉移植迁入至脑组织,能通过自分泌或旁分泌产生神经营养因子如 BDNF、神经生长因子、成纤维细胞生长因子等[9];(2)部分移植细胞增殖、分化为神经细胞[12];(3)促进局部新生血管形成[13]。
[1] Savitz SI,Dinsmore JH,Wechsler LR,et al.Cell therapy for stroke[J].NeuroRx,2004,1(4):406-414.
[2] Chen J,Sanberg PR,Li Y,et al.Intravenousadministration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J].Stroke,2001,32(11):2682-2688.
[3] 陈晓岚,黄仁彬,汤银娟,等.人脐血间充质干细胞静脉移植治疗大鼠局灶性脑缺血的实验研究[J].中国实用神经疾病杂志,2007,10(1):4-7.
[4] Madkaikar M,Gupta M,Ghosh K,et al.Optimising methods of red cell sedimentation fromcord blood to maximise nucleated cell recovery prior to cryopreservation[J].Br J Biomed Sci,2007,64(4):157-159.
[5] Zea Longa E,Weistein PR,Calson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-88.
[6] Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion evaluation of model and development of a neurologic examination[J].Stroke,1986,17(3):472-476.
[7] 郭国庆,沈伟哉.自发性脑卒中高血压大鼠大脑中动脉超微结构的病理改变[J].解剖学杂志,2000,23(3):242-244.
[8] Ha Y,Lee JE,Kim KN,et al.Intermediate filament nestin expressions in human cord blood monocytes[J].Acta Neurochir(Wien),2003,145(3):425-429.
[9] Borlongan CV,Hadman M,Sanberg CD,et al.Central nervous system entry of peripherally injected umbilical cord blood cellsis not required for neuroprotection 2in stroke[J].Stroke,2004,35(10):2385-2389.
[10] Yu G,Borlongan CV,Stahl CE,et al.Systemic delivery of umbilical cord blood cells for stroke therapy:A review[J].Res Neurol Neurosci,2009,27(1):41-54.
[11] Willing AE,Lixian J,Milliken M,et al.Intravenousversusintrastriatal cord blood administration in arodent model of stroke[J].JNeurosci Res,2003,73(3):296-307.
[12] Xiao J,Nan Z,Motooka Y,et al.Transplantation of a novel cell line population of umbilical cord blood stem cells ameliorates neurological deficits associatedwith ischemic brain injury[J].Stem Cells Dev,2005,14,722-733.
[13] Taguchi A,Soma T,Tanaka H,et al.Administration of CD34+cells after stroke enhances neurogenesis via angiogenesis in amouse model[J].J Clin Invest,2004,114:30-338.

