阿尔茨海默病患者尿中 AD7c-NTP含量的研究
白春艳, 孙宏侠, 刘 敏, 周 艳, 齐英斌, 李宗树, 张明明, 江新梅
阿尔茨海默病(Alzheimer's Disease,AD)是一种发生在老年期的神经系统慢性退行性疾病,其病因迄今不明。临床表现主要为认知(计算、判断、综合等)功能障碍、记忆力减退、人格异常等。病理特征为弥散性大脑皮质萎缩、神经元外老年斑(senile plaques,SP)沉积、神经元内神经原纤维缠结(neurofibrillary tangles,NFTs)形成、神经元缺失等。目前诊断 AD主要根据患者病史、症状、神经心理学测试、排除其他类型痴呆等,只有待患者死后尸解才能确诊。而 AD主要发生于老年人,如果能早期诊断,采取一定的防治措施,可改善其预后。为此,国内外学者做了大量的研究,以期找到 AD特异性的早期诊断指标。对于老年人,无创性诊断显得尤为重要,相比脑脊液检查,尿液检查显得更为容易。国外研究表明,阿尔茨海默病相关神经丝蛋白(AD7c-NTP)在 AD患者的神经元纤维缠结(NFT)中大量存在,并在患者脑中呈分泌性上调表达,因此,推测它可能与 AD的病理过程有关[1~3]。增高的 AD7c-NTP可从早期或相对严重的 AD患者脑脊液及尿样本中检测到,而且脑脊液及尿液中 AD7c-NTP水平与痴呆的严重程度相关[4~6]。另有研究[7]发现,AD患者尿样中 AD7c-NTP的检测能达到与脑脊液检测相同的效果。本研究对 AD患者尿样中 AD7c-NTP含量进行测定,并和血管性痴呆患者以及智能正常老年人尿样中的 AD7c-NTP含量进行比较统计,试图找出尿中 AD7c-NTP含量与 AD的关系,从而为AD的早期诊断提供一种比较容易接受的、简便的无创检测方法。
1 资料与方法
1.1 资料
1.1.1 临床资料 2006年 ~2009年就诊于吉林大学第一医院及吉林省人民医院神经内科的痴呆患者 96例,分为 AD组和 VD组,AD组患者 46例,其中男 24例 、女 22例,年龄 60~83岁,平均 72.5±6.2岁。 VD组 50例,男 26例,女 24例,年龄 61 ~82岁,平均 72.5±6.6岁。全部病例均进行系统的病史采集、专科查体及痴呆系列量表测试,包括简易智能状态检查量表(MMSE)、临床痴呆评定量表(CDR)以及 Hachinski缺血指数量表(HIS),所有病例均行头部 CT和(或)MRI检查。AD组的纳入标准:按照美国精神医学会的《精神障碍诊断和统计手册》第 IV版标准诊断痴呆,很可能 AD采用美国国立神经病、语言障碍和卒中研究院(NINCDS)-阿尔茨海默病和相关疾病学会(ADRDA)的诊断标准[8];Hachinski缺血量表评分≦ 4分;头部 CT和(或)MRI检查以及有关的实验室检查以排除其他原因引起的痴呆;MMSE检查(中学以上≦ 24分,小学≦ 20分,文盲≦ 17分);CDR 1~2分。 VD组患者均符合DSM-IV关于VD的诊断标准;曾有卒中发作史,有急性或亚急性发病的神经系统症状和体征,病情呈阶梯样进展,CT或 MRI证实脑内有多发梗死灶。智能正常中老年对照组 122例,男 59例,女63例,年龄 41~95岁,平均 72.8±7.6岁。智能检查均正常。年龄匹配的健康查体中老年人,无心脑血管疾病,且血压、心电图正常,血常规、血糖及血脂均在正常范围。无神经系统体征及明显的肝、肾或内分泌疾病。根据头部 CT及 MRI,排除头部占位性病变及感染。
1.1.2 仪器与试剂 兔抗人 AD7c-NTP多克隆抗体由首都医科大学宣武医院中心实验室提供;Spectra Max M5酶标仪系美国 Molecular Devices公司生产。
1.2 方法
1.2.1 标本采集 留取晨尿的中段尿,混匀,肉眼观察,如尿液浑浊或颜色很深,应弃去,选取清亮的标本进行尿常规测定。凡有如下的一种异常,即为不合格标本:(1)24h尿蛋白量小于 40mg或大于 2000mg;(2)尿中的 WBC、RBC异常或有细菌生长;(3)尿中有结晶;(4)尿比重异常;(5)pH异常;(6)糖、酮体、硝酸盐、胆红素或尿胆原阳性。留取合格尿标本,400r/min,离心 5min,以专用塑料试管立即存于 -20℃待测(保存不超过 1w)。
1.2.2 蛋白的提取 取尿液标本加入 5倍体积提取缓冲液,混匀后加入 3倍体积纯水,10000r/min,4℃离心 3min。弃去上层水相,加入 500μl无水乙醇,10000r/min,4℃离心 2min,收集沉淀。
1.2.3 蛋白含量的测定 以包被缓冲液溶解上述沉淀,4℃湿盒包被过夜。1%BSA封闭后,依次加入兔抗人 AD7c-NTP抗体和 HRP标记的山羊抗兔 IgG,TMB显色。终止反应后,检测 A450。以购买的 AD7c-NTP制备标准曲线,测定样品中蛋白含量。
2 结 果
2.1 各组尿中 AD7c-NTP含量比较 AD组、VD组及智能正常老年对照组尿液中 AD7c-NTP含量分别为(33.35±1.61)、(18.19±1.41)、(18.30±1.45)μg/ml,见表1及图1。AD组明显高于其他两组,差异有统计学意义(P<0.001),而 VD组与智能正常老年对照组差异无统计学意义(P>0.05)。
2.2 各组尿中 AD7c-NTP含量与年龄及性别的关系 图2显示所有 3组中 AD7c-NTP含量与年龄的关系,拟合优度判定系数(R2)仅为 0.019,证明 AD7c-NTP含量与年龄无关。图3显示 AD7c-NTP含量与性别的关系,变异度检验 P=0.73,证明AD7c-NTP含量与性别无关。
2.3 尿液中 AD7c-NTP含量对 AD诊断的敏感度及特异性对比 将 VD组和智能正常老年组合并为一个对照组,为 non-AD(非阿尔茨海默病)组。以尿液中不同的 AD7c-NTP含量为诊断界值,其诊断 AD的特异性随敏感性的增强而呈现出下降趋势。其中,以 22μg/ml作为诊断标准时,其诊断的敏感性为 89%,同时特异性可以达到 90%,均达到了比较高的水平,见图4。

表1 各组尿中AD7c-NTP含量及年龄对比
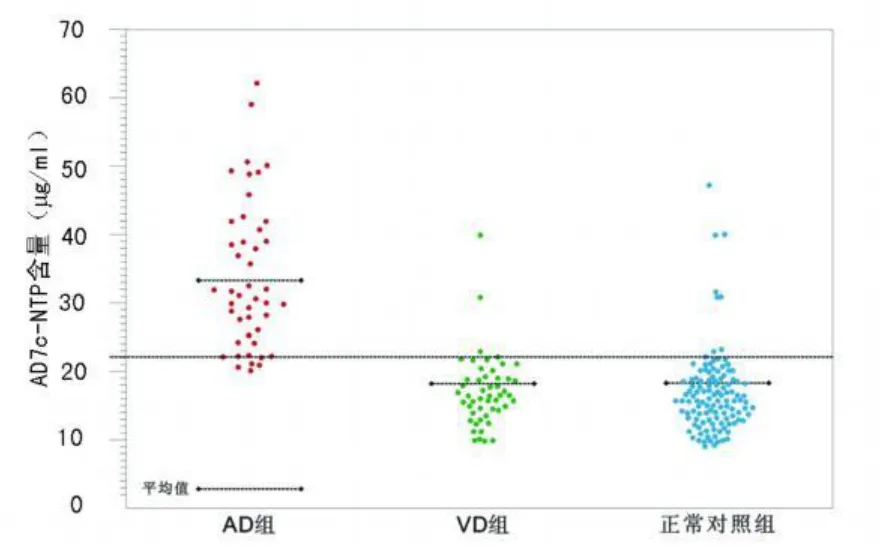
图1 各组尿中 AD7c-NTP含量散点图
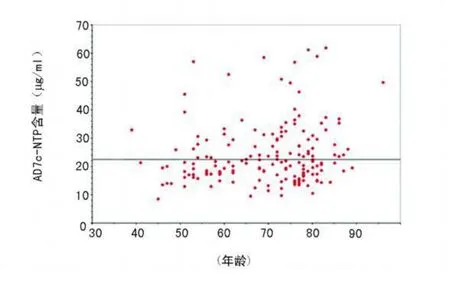
图2 3组尿液标本中 AD7c-NTP含量与年龄的关系(R2=0.019)

图3 3组尿液标本中 AD7c-NTP含量与性别的关系(P=0.73)
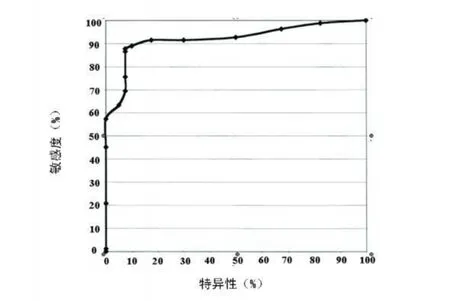
图4 尿中 AD7c-NTP含量诊断AD的敏感度及特异性的对比
3 讨 论
目前,AD诊断的准确率只有 70%左右,载脂蛋白 Eε4等位基因作为 AD的危险因子只在 50%的AD中出现[9]。而且检测脑脊液和血清中的 β淀粉样蛋白在 AD与非 AD病例有明显重叠,其应用受到限制[1]。此外,其他潜在的生物学标记也已开展研究,例如 8-羟基-2-脱氧鸟苷[10]和血红素加氧酶-1[11],但这些检查尚未得到临床验证。
为了精确并能够早期诊断 AD,同时作为疗效判断的可靠指标,需要一种可靠的周围生物标记[12]。而且,早期诊断 AD并采取一定的防治措施,可明显改善其预后。近年国外研究发现,在 AD患者的脑组织,脑脊液及尿液中 AD7c-NTP的表达水平选择性增加,对于 AD的早期诊断其敏感性及特异性在 90%以上[13],AD7c-NTP表达水平的这种变化使它成为 AD早期诊断的生物标记,越来越引起科学家的关注。
AD7c-NTP是一种分子量为 41kD的跨膜磷蛋白,在神经元胞体中表达,AD患者脑内选择性升高,其功能与神经炎的萌发及细胞死亡有关[14]。研究表明,增高的 AD7c-NTP可从早期或相对严重的AD患者脑脊液及尿样本中检测到,而且脑脊液及尿液中 AD7c-NTP水平与痴呆的严重程度相关[3]。AD7c-NTP的过度表达可能介导了与 AD神经退行性变化有关的细胞凋亡级联反应,并通过这些反应进一步与磷酸化 Tau蛋白累积过程建立联系。
本研究以中国中老年人为研究对象,对尿样中AD7c-NTP含量进行了测定。结果表明 AD患者尿中 AD7c-NTP含量较智能正常人明显升高,此结果与国外报道在一定程度上相符,提示在中国中老年人群中尿液 AD7c-NTP含量对 AD的诊断有重要意义,同时对 AD患者的病情评估有着较为乐观的临床参考价值,明确其相关性的原因有待于进一步深入研究。另外,本研究发现,在以 22μg/ml为诊断界点的前提下,尿中 AD7c-NTP含量诊断 AD的敏感度为 89%,特异性为 90%,说明尿液 AD7c-NTP含量对 AD的诊断能够同时保持较高的敏感度和特异性,这更加肯定了其在 AD诊断中的临床参考价值。可见 AD7c-NTP对于 AD诊断是一项精确的生物标记,而且对老年人进行 AD风险的常规临床评价同样有帮助。本研究在对比各组尿中 AD7c-NTP含量与年龄及性别的关系中发现,AD7c-NTP含量与性别和年龄无关。
血管性痴呆也是临床比较常见的痴呆类型,近年来关于血管性痴呆与阿尔茨海默病是否为同一种疾病的研究越来越受到重视。本研究表明,血管性痴呆组尿液 AD7c-NTP含量明显低于 AD组,差异有统计学意义,而与智能正常老年组相比较差异并无统计学意义,提示尿液 AD7c-NTP含量的增高与血管性痴呆的发病无明显相关性.本研究在一定程度上证明二者不是同一种疾病,故可用于鉴别 AD和VD。
本研究所采用的标本为尿液,具有无创性易于被患者接受,同时采用直接酶联免疫吸附测定方法具有准确性较高,可操作性强,方便,等优点,使尿液AD7c-NTP含量检测在 AD的诊断、鉴别诊断以及病情评估特别是早期诊断中有着重要的意义。
[1] Munzar M,Levy S,Rush R,et al.Clinical study of aurinarycompetitive ELISA for neural thread protein in Alzheimer disease[J].Neurol Clin Neurophysiol,2002,2002:2-8.
[2] Levy S,McConville M,Lazaro GA,et al.Competitive ELISA studies of neural thread protein in urine in Alzheimer's disease[J].J Clin Lab Anal,2007,21:24-33.
[3] De La Monte SM,Wands JR.Alzheimer-associated neuronal thread protein-induced apoptosis and impaired mitochondrial function in human central nervoussystem-derived neuronal cells[J].JNeuropathol Exp Neurol,2001,60(2):195-207.
[4] Munzar M,Levy S,Rush R,et al.Competitive ELISA format urinary assay of neural thread protein in Alzheimer's disease[J].Alzheimer Rep,2001,4(2):61-65.
[5] Munzar M,McConville M,Yung J,et al.A retrospective clinical study of urinary neural thread protein in Alzheimer's disease[J].Alzheimer Rep,2002,5(1):1-6.
[6] Kahle PJ,Jakowec M,Teipel SJ,et al.Combined assessment of Tau and neuronal thread protein in Alzheimer's disease CSF[J].Neurology,2000,54:1498-1504.
[7] Goodman I,Golden G,Flitman S,et al.A multi-center blinded prospective study of urineneural thread protein measurements in patients with suspected Alzheimer's disease[J].J Am Med Dir Assoc,2007,8(1):21-30.
[8] Dubois B,Feldman HH,Jacova C,et al.Research criteria for the diagnosis of Alzheimer's disease:revising the NINCDS-ADRDA criteria[J].Lancet Neurology,2007,6(8):734-746.
[9] Myers RH,Schaefer EJ,Wilson PWF,et al.Apolipoprotein E epsilon4 association with dementia in a population-based study:The Framingham study[J].Neurology,1996,46:673-677.
[10] Lovell MA,Markesbery WR.Ratio of 8-hydroxyguanine in intact DNA to free 8-hydroxyguanine is increased in Alzheimer disease ventricular cerebrospinal fluid[J].Arch Neurol,2001,58:392-396.
[11] Schipper HM,Chertkow H,Mehindate K,et al.Evaluation of hemeoxygenase-1 as a systemic biological marker of sporadic AD[J].Neurology,2000,54:1297-1304.
[12] Diaz R.New biochemical markers in Alzheimer disease[J].Arch Neurol,2001,58:354-356.
[13] De La Monte SM,Wands JR.The AD7c-NTP neuronal thread protein biomarker for detecting Alzheimer's disease[J].J Alzheimers Dis,2001,3:345-353.
[14] De La Monte SM,Wands JR.Alzheimer-associated neuronal thread protein mediated cell death is linked to impaired insulin signaling[J].J Alzheimers Dis,2004,6:231-242.

