生脉散对2型糖尿病性心肌病大鼠心肌的保护作用*
倪 青,王 阶△,赵安斌,于 斌,王 敏,黄春荣,李恩庆
(1.中国中医科学院广安门医院,北京 100053;2.暨南大学医学院,广东 广州 510632)
生脉散对2型糖尿病性心肌病大鼠心肌的保护作用*
倪 青1,王 阶1△,赵安斌2,于 斌2,王 敏2,黄春荣2,李恩庆2
(1.中国中医科学院广安门医院,北京 100053;2.暨南大学医学院,广东 广州 510632)
目的:探讨生脉散对糖尿病性心肌病(DCM)大鼠的保护作用。方法:SD大鼠42只,采用高脂高热量饮食诱导出胰岛素抵抗,加单次中等剂量(50mg/kg)腹腔注射链脲佐菌素建立DCM动物模型,12周后采用心电图评价心肌受损情况,取血检测血糖、胆固醇、甘油三酯,Masson染色检测左室心肌胶原含量,Tunel凋亡试剂盒检测心肌细胞凋亡程度,电镜观察心肌亚细胞结构破坏程度,同时采用免疫组织化学染色检测 TSP-1、TGF-β1、Chymase和TRB-3蛋白的表达水平,采用Western blotting技术检测 TSP-1、A-TGFβ1和 L-TGF-β1蛋白的表达水平变化。实时荧光定量PCR检测TSP-1和TRB-3 mRNA表达水平的变化。结果:与模型组相比,生脉散组大鼠血糖、胆固醇、甘油三酯明显降低,心肌组织破坏程度较轻,胶原纤维含量显著减少,电镜观察心肌细胞亚细胞结构破坏程度较轻,免疫组化心肌 TSP-1、TGF-β1以及 TRB-3的表达水平、Western心肌 tsp-1、A-TGFβ1和 L-TGF-β1蛋白表达水平、PCR、TSP-1 mRNA和TRB-3 mRNA表达水平降低。结论:生脉散可通过多条途径抑制糖尿病心肌病大鼠的心肌纤维化,显著延缓糖尿病心肌病的发生进程。
生脉散;糖尿病心肌病;凋亡;胶原纤维;TSP-1;TGF-β1;TRB-3;Chymase
糖尿病心肌病(Diabetic Cardiomyopathy,DCM)是指糖尿病患者心肌细胞原发性损伤引起广泛的结构异常,最终引起左心室肥厚、舒张期和(或)收缩期功能障碍的一种疾病状态[1]。临床研究表明,DCM通常以舒张性心力衰竭为早期表现[2],即心肌松弛性减低和僵硬度增大,心肌间质纤维化是舒张性心力衰竭的重要病机[3]。在组织形态学上主要表现为心肌细胞局灶性肥大、坏死,细胞外基质(Extracellular matrix,ECM)沉积和心肌纤维化[4]。临床多中心1278例糖尿病合并冠心病住院病人治疗情况发现,生脉散使用频率很高。因此,研究生脉散抗心肌纤维化作用,可更好地指导临床。
1 材料与方法
1.1 主要试剂与仪器
Trizol购自invitrogen生物技术科技公司,RNA逆转录试剂盒购自上海贝博生物技术公司,实时荧光定量PCR试剂盒购自genecopoeia生物技术公司,TSP-1、TGF-β1、TRB-3 和 Chymase 单克隆抗体购自美国santa cruze生物技术公司,A-TGFβ1和 L-TGF-β1多克隆抗体购自武汉博士德生物技术公司,ABC检测试剂盒购自美国vectro生物技术公司,BCA蛋白定量试剂盒购自上海贝博生物试剂公司。链尿佐菌素购自Sigma生物技术公司。生脉散购自暨南大学附属第一医院。人参9g,麦冬9g,五味子6g,以上药物麦冬和五味子以10倍量水煎煮1.5h后,人参10倍水另煎1.5h后滤出药液和其余药物药液混合、过滤,浓缩至0.32g/ml。
1.2 动物与分组
雄性 SD大鼠42只,体重200g±20g,购自北京维通利华实验动物技术有限公司。随机分为3组:正常组(n=12)只,对照组(n=15)和生脉散组(n=15)。正常组喂以标准大鼠饲料,对照组及生脉散组喂以高脂高热量饲料。4周后给予模型组及生脉散组大鼠1次性腹腔注射链脲佐菌素50mg/kg,正常组大鼠给予同等剂量柠檬酸钠缓冲液腹腔注射;各组以原饲料继续喂养1周后,测定血糖,模型组及生脉散组连续2次血糖≥16.7 mmol/L且有多饮、多食、多尿的大鼠的纳入实验,共有38只大鼠纳入实验(正常组12只,模型组和丹参饮组各13只)。各组大鼠继续以原饲料继续喂养9周,14周禁食12h后杀死各组大鼠,心房取血,离心保留血清 -20℃保存以备检测血脂、血糖、甘油三酯。采血完毕迅速处死大鼠,取出心脏冰盐水冲洗,剪除包膜、血管称重并计算心脏重量指数,垂直于心脏左室长轴对称中点上下切取部分心肌,分别放入10%中性甲醛及2.5%戊二醛中固定,其余部分放入-80℃冰箱中保存。共有35只大鼠完成实验(模型组死亡1只,死亡原因可能为糖尿病并发症或感染)。
1.3 心电图观察心肌损伤程度
大鼠给予1%戊巴比妥纳2ml/kg腹腔注射后做心电图。
1.4 检测血糖甘油三酯总胆固醇的变化
心房取血5ml,4℃,2500r离心保留血清 -20℃保存以备检测血脂、血糖、甘油三酯。
1.5 HE染色
10%中性甲醛固定心肌组织标本,石蜡切片,行常规HE染色,光镜下观察心肌病理损害并拍照,并结合超微结构的改变来评价心肌的病变。
1.6 透射电镜观察
在左心室中部留取小块组织,以2.5%戊二醛固定10min后细切(1.0×1.0mm),再固定12h,1%锇酸固定1h,乙醇、丙酮梯度脱水,环氧树脂包埋,超薄切片机制备超薄切片,电子染色,德国PHILIPSTECNAI-10型透射电子显微镜观察心肌超微结构并摄片。
1.7 Masson染色
常规石蜡切片脱蜡后行Masson染色,光镜下观察心肌细胞呈红色或黄色,胶原纤维呈蓝绿色,HMIAS彩色医学图文分析系统定量分析切片每个视野中CVF(CVF=同一图像中胶原面积/所测视野面积),排除富含胶原的血管和疤痕区域。每个切片选取5个视野,最后取其均数。
1.8 Tunel细胞凋亡试剂盒检测细胞凋亡
常规石蜡切片脱蜡后,按试剂盒说明依次滴加试剂,荧光显微镜下观察,激发波长 450nm~500nm,发射波长515nm~565nm。每张玻片选取荧光表达最强的3~5个视野观察并由计算机自带扫描分析软件测定荧光强度与面积。指标的荧光值=平均荧光强度×平均荧光面积。
1.9 实时荧光定量PCR
RNA提取与 cDNA的合成:采用 Trizol按试剂盒说明提取RNA,经紫外分光光度计检测RNA纯度和浓度,经电泳法检测其完整性。按逆转录试剂盒说明进行逆转录。取2μl逆转录产物进行Reamtime PCR检测。
引物序列:引物由上海生工生物工程技术服务有限公司合成。反应体系:2×AllinoneTM Q-PCR MIX 10μl,ddH2O 1μl,Forward Primer(4μM)2μl,Reverse Primer(4μM)2μl,Template cDNA 5μl。Total:20μl。反应条件:预变性:95℃,1min;变性:95℃,15s;退火:60℃,30s;延伸:72℃,30s。共 40个循环。

目的基因 引物序列 (5′-3′)产物长度TRB-3 F:TGTCTTCAGCAACTGTGAGAGGACGAAG R:GTAGGATGGCCGGGAGCTGAGTATC 147bp Tsp-1 F:GGAAGAGCATCACGCTGTTTG R:GCGCTCTCCATCTTGTCACA 73bp β-actin F:GACATCCGTAAAGACCTCTATGCC R:ATAGAGCCACCAATCCACACAGAG 173bp
1.10 免疫组化染色
载玻片采用多聚赖氨酸行防脱片剂处理,常规石蜡切片脱蜡,0.3% H2O2封闭。置 0.01 mol/L pH 6.0柠檬酸盐缓冲液中行微波修复抗原(中档火8min~10min,自然冷却到室温,反复3次)。山羊血清封闭,依次加入Ⅰ抗、生物素标记的山羊抗小鼠IgG和辣根过氧化物酶标记的卵蛋白-生物素,37℃孵育30 min。以DAB显色、脱水、透明、封片。阴性对照用PBS代替Ⅰ抗。
1.11 Western blotting检测蛋白表达
于超净工作台上,剪取约100mg组织,加入细胞裂解液 400μl,于冰上研磨,转入 1.5ml离心管中,于冰上裂解 30min后,4℃,12000r离心 10min,取上清液到1.5ml离心管中,此即为蛋白样品,-80℃冰箱中保存。取上述蛋白样品40μl,BCA试剂盒蛋白定量,绘制标准曲线。以上蛋白样品(取20μg)经10%聚丙烯凝胶电泳分离后进行转膜(湿转),恒流(GAPDH:240MA,50min;tsp-1:240MA,140min;)将蛋白转移到 PVDF膜(孔径 0.45μm)上。然后封闭缓冲液(5%脱脂牛奶或BSA)中封闭1h,将膜放入封闭缓冲液稀释的Ⅰ抗(稀释比例:GAPDH:1∶100 稀释,TSP-1:1∶200 稀释;A-TGF-β1:1∶100;L-TGF-β1:1∶100)中进行免疫反应,室温下持续摇动孵育2h,然后4℃过夜。1×PBST洗涤4次,每次5min。将膜用PBST缓冲液稀释的辣根过氧化物酶(HRP)标记的Ⅱ抗(1∶6000稀释),室温孵育50min,1×PBST洗涤4次,每次5min。于暗室中滴加新鲜配制的ECL显色液0.6 mL(A、B液等体积混匀),膜孵育1 min,封入保鲜膜中,压片并显影于感光胶片上。以上步骤独立重复3次。用Bandleader 3.0软件对条带进行灰度扫描,按下述公式分别计算3次实验中样品蛋白的相对含量:蛋白相对含量(该蛋白条带的灰度值-背景的灰度值)/(内参条带的灰度值-背景的灰度值),以此比值计算均数与标准差。
1.12 统计学处理
所有数据用SPSS 13.0统计软件包进行分析。计量资料以±s表示,组间参数的比较采用完全随机设计的单因素方差分析的统计学方法进行统计。
1.13 结果
(1)大鼠一般生存状况及生化指标变化:糖尿病模型组大鼠在注射STZ后1周内出现多饮、多尿、多食症状,随病程的延长,上述症状逐渐加重并出现腹部胀大,严重消瘦,腹泻,毛发干燥,色泽黯淡,反应迟钝,活动减少,部分大鼠出现呼吸声粗。随着时间的延长,模型组和生脉散组大鼠血清甘油三酯和总胆固醇水平逐渐升高,各组不同时点纵向比较差异显著(模型组和生脉散组的甘油三酯的F值分别为F=25.429和F=7.750,P<0.05;模型组和生脉散组的总胆固醇的 F值分别为 F=9.065和 F=3.54,P<0.05);模型组和生脉散组血糖在不同时间点逐渐降低,但没有统计学意义(P>0.05);正常组不同时点纵向比较,大鼠血清甘油三酯和总胆固醇水平无显著差异(P>0.05)。与相同时间点的正常组比较,模型组和生脉散组大鼠血清甘油三酯和总胆固醇水平明显升高;与相同时间点模型组相比,生脉散组大鼠血清甘油三酯和总胆固醇较模型对照组明显减低,各组之间两两比较,差异显著(P<0.01);与相同时间点的正常组比较,模型组和生脉散组大鼠血糖明显升高;与相同时间点的模型组相比,生脉散组大鼠空腹水平明显降低,各组之间两两比较,差异显著(P<0.05)。
(2)心电图观察心肌损伤情况:大鼠心电图显示ST段抬高明显,提示心肌已损伤。
(3)病理观察:HE染色可见正常大鼠心肌细胞排列整齐、致密,结构清晰,细胞外间质较少,可见少量成纤维细胞(图1A)。模型组大鼠心肌细胞排列紊乱,心肌细胞肥大、扭曲,细胞间隙增大,间质和血管周围细胞外基质增多,成纤维细胞增多,并有炎症细胞浸润(图1B)。生脉散组介于两者之间,与模型对照组相比,细胞间隙减小,间质和血管周围细胞外基质减少(图1C)。
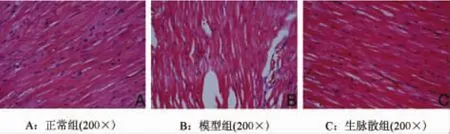
图1 各组大鼠心肌组织HE染色观察(200×)
(4)电镜观察心肌亚细胞结构:正常大鼠心肌细胞排列整齐,结构清晰,细胞间质胶原含量很少,毛细血管内皮细胞及基底膜结构正常(图2A)。模型大鼠心肌细胞肌丝纤维稀疏、扭曲、断裂,线粒体肿胀,数量减少,排列紊乱,空泡变性,部分嵴断裂,糖原减少,间质胶原增生,毛细血管内皮细胞肿胀,毛细血管基底膜增厚(图2B)。生脉散组较模型组明显减轻,间质胶原沉积较少,毛细血管基底膜增厚减轻,介于正常组和对照组之间(图2C)。

图2 各组大鼠心肌组织电镜观察(15000×)
(5)Masson染色观察胶原表达情况:显微镜下观察,正常组胶原组织分布均匀,相邻细胞的胶原纤维网完好,胶原纤维含量少(图3A);对照组心肌内胶原组织明显增多,围绕心肌细胞的胶原纤维网断裂、排列紊乱(图3B);生脉散组心肌胶原组织排列比对照组稍显规整,纤维网结构尚好(图3C)。

图3 各组大鼠心肌组织masson染色(100×)
表1 各组大鼠左室组织Masson染色胶原纤维定量分析结果(±s)

表1 各组大鼠左室组织Masson染色胶原纤维定量分析结果(±s)
注:△P<0.01
组 别 n 间质胶原纤维体积正 常 组12 10.38±2.76模 型 组 11 18.42±3.55△生 脉 散 组 12 15.90±3.00△
采用Image Pro Plus图像分析系统进行心肌组织胶原相对含量测定,实验结果表明,与正常组相比,糖尿病心肌病变大鼠心肌组织胶原相对含量明显增加(P<0.01),提示该模型大鼠存在胶原纤维增生的病变;与模型组相比,生脉散组胶原含量显著减少(P<0.05),提示其可以明显抑制胶原纤维增生。
(6)Tunel细胞凋亡试剂盒检测细胞凋亡:正常组大鼠的心肌组织仅可见少数细胞凋亡(图4A),与正常组相比,模型组凋亡细胞数目明显增多(图4B),与模型组相比,生脉散组凋亡细胞显著减少(图 4C)。

图4 各组大鼠心肌组织细胞凋亡水平(200×)
(7)实时荧光定量PCR检测结果:与正常组相比,模型组TSP-1和TRB-3的 mRNA表达水平均明显升高(P<0.01)。与模型组相比,生脉散组TSP-1和TRB-3的 mRNA表达水平显著降低(P<0.01)。
表2 各组大鼠心肌TSP-1和TRB-3 mRNA表达水平(±s)

表2 各组大鼠心肌TSP-1和TRB-3 mRNA表达水平(±s)
注:△P<0.01,*P<0.05
组别n TSP-1 TRB-3正 常 组12 0.0091±0.0019 0.0081±0.0030模 型 组 11 0.0144±0.0034* 0.0136±0.0039*生脉散组 12 0.0122±0.0034* 0.0102±0.0023*
(8)免疫组织化学染色:TSP-1染色阳性信号为棕色颗粒,定位于心肌细胞胞浆内。正常组心肌细胞胞浆内可见分布均匀、稀疏的浅棕色颗粒(图5A),模型组心肌细胞内可见浓密的深棕色颗粒(图5B),生脉散丹参饮合剂组心肌细胞内棕褐色颗粒可见明显减少(图5C)。与正常组相比,模型组心肌TSP-1蛋白表达量明显升高;与模型组相比,生脉散组TSP-1表达量明显降低,3个组两两相比差异显著,差异有统计学意义(P<0.01)。

图5 各组大鼠心肌组织tsp-1免疫组织化学染色(200×)
TGF-β1染色阳性信号为棕色颗粒,定位于心肌细胞胞浆内。正常组心肌细胞胞浆内可见散在、稀疏的浅棕色颗粒(图6A),模型组心肌细胞内可见浓密的深棕色颗粒(图6B)。生脉散组心肌细胞内棕色颗粒可见明显减少(图6C)。与正常组相比,模型组心肌 TGF-β1蛋白表达量明显升高;与模型组相比,生脉散组 TGF-β1表达量明显降低,3个组两两相比差异显著,差异有统计学意义(P<0.01)。
TRB-3染色阳性信号为棕色颗粒,定位于心肌细胞胞浆内,正常组心肌细胞胞浆内可见散在稀疏的浅棕色颗粒(图7A),DCM组心肌细胞内可见浓密的深棕色颗粒(图7B)。生脉散组心肌细胞内棕色颗粒可见明显减少(图7C)。与正常组相比,模型组心肌TRB-3蛋白表达量明显升高;与模型组相比,生脉散组TRB-3表达量明显降低,3个组两两相比差异显著,差异有统计学意义(P<0.01)。

图6 各组大鼠心肌组织TGF-β1免疫组织化学染色(200×)

图7 各组大鼠心肌组织TRB-3免疫组织化学染色(200×)
Chymase染色阳性信号为棕色颗粒,正常组心肌细胞间隙和肥大细胞内可见散在稀疏的浅棕色颗粒(图8A),DCM组心肌细胞间隙和肥大细胞内可见较多的深棕色颗粒(图8B)。生脉散组心肌细胞间隙和肥大细胞内棕色颗粒可见减少(图8C)。模型组心肌Chymase蛋白表达量明显升高;与模型组相比,生脉散组Chymase表达量明显降低,3个组两两相比差异显著,差异有统计学意义(P<0.01)。

图8 各组大鼠心肌组织Chymase免疫组织化学染色(200×)
(9)Western blot检测蛋白表达情况:心肌组织中TGF-β1是以活性的 A-TGF-β1和非活性的 LTGF-β1形式存在的,与正常组相比,心肌组织中TSP-1、A-TGF-β1、L-TGF-β1 3 种蛋白的表达水平均显著升高(P<0.01)。与模型组相比,生脉散组的 TSP-1、A-TGF-β1、L-TGF-β1 3 种蛋白的表达水平均显著降低(P<0.05-0.01)。
表3 各组大鼠心肌 TSP-1、A-TGF-β1和L-TGF-β1蛋白的表达水平(±s)

表3 各组大鼠心肌 TSP-1、A-TGF-β1和L-TGF-β1蛋白的表达水平(±s)
注:△P<0.01,*P<0.05
组 别 n TSP-1 A-TGF-β1 L-TGF-β1正 常 组12 93.225±5.371 106.429±6.32 102.461±6.124模 型 组 11 129.772±6.548△ 139.812±7.26△ 144.633±7.377△生脉散组 12 123.307±6.717△ 129.743±6.36△ 129.820±7.555*
2 讨论
本研究以高糖高脂高热量饮食诱导出胰岛素抵抗,加小剂量STZ注射建立的动物模型,基本符合糖尿病的临床特点。HE染色病理切片显示,心肌细胞肥大、扭曲,细胞间隙增大,间质和血管周围细胞外基质增多。电镜观察显示,心肌细胞排列稀疏、断裂并有大量胶原纤维分布,结合心电图示心肌受损,提示本研究成功建立了糖尿病心肌病的动物模型。生脉散出自《医学启源》,方由人参、麦冬、五味子组成,是治疗气阴两虚证的常用方。近年来常用于急性心肌梗死、冠心病等属于气阴两虚者。研究表明,生脉散还有较好提高脂肪代谢的能力。
糖尿病性心肌病主要以心肌肥大、心肌细胞大量减少、心肌间质及血管周围纤维化、大量糖原、脂滴沉积及细胞水平的钙转运缺陷和心肌收缩蛋白的胶原形成等为特征。本实验发现,正常组大鼠心肌细胞排列整齐、致密,细胞间隙较少。masson染色显示,心肌细胞间仅有少量胶原纤维,电镜观察心肌细胞排列整齐,线粒体完整,低倍镜下(1250×)成纤维细胞数目较少(≤2个),而且成纤维细胞周围胶原纤维少。与正常组相比,模型组大鼠心肌成纤维细胞排列紊乱,细胞间隙较多,masson染色显示心肌细胞间充满大量胶原纤维,电镜观察心肌细胞肌丝断裂崩解,线粒体肿胀、破裂,低倍镜下(1250×)成纤维细胞数目较多(≥5个),而且成纤维细胞周围聚集大量胶原纤维。生脉散组介于两者之间,与模型组相比,生脉散组大鼠心肌细胞排列较为整齐,细胞间隙胶原纤维较少,电镜低倍镜下(1250×)成纤维细胞数目约为2~4个,成纤维细胞周围有中等量的胶原纤维,提示生脉散可以有效延缓糖尿病大鼠心肌病发生。
本研究就纤维化过程中的几个关键细胞因子研究,观察生脉散对糖尿病心肌病的保护,为临床的广泛应用提供证据。TSP-1对多种间质细胞的分化、增生具有很强的调控作用,其异常表达在多种类型纤维化疾病进程中起关键作用[6]。已有研究表明,糖/TSP-1/TGF-β1信号传导途径在糖尿病心肌病心肌间质纤维化发生发展过程中起着重要的作用[7]。最近1项有关TRB3信号转导通路的研究结果表明,TRB3对MAPK信号转导通路的连锁反应具有广泛和特异的调控作用,TRB3与MAPKK结合而调控MAPK通路信号蛋白的活性[8]。大量研究证实,MAPK不仅是糖尿病慢性并发症如糖尿病肾病、糖尿病动脉粥样硬化等的发生发展过程的关键细胞因子[9],也是心肌纤维化过程中重要的信号转导通路[10]。糖尿病状态下,心肌局部升高的 Ang II,通过多条途径引起心肌氧化应激、细胞凋亡、心肌间质胶原沉积以及心肌纤维化,在糖尿病心肌病变变的发生中扮演着重要角色[11]。Chymase除通过生成Ang II引起心肌病变,还可能直接激活TGF-β1从而诱导细胞增殖、促使心肌纤维化[12]。本研究表明,与正常组相比,模型对照组masson染色胶原纤维表达增多,电镜观察成纤维细胞周围胶原纤维表达增高,免疫组化结果表明,与正常组相比,模型组大鼠心肌细胞 TSP-1、TGF-β1、chymase、TRB-3 表达量均明显增高,差异具有统计学意义(P<0.01)。与模型组相比,生脉散组大鼠心肌细胞 TSP-1、TGF-β1、chymase、TRB-3有不同程度的降低,差异有统计学意义。结合masson染色及电镜结果,提示生脉散可以有效地缓解糖尿病心肌病的心肌纤维化进程,减轻糖尿病心肌病的纤维化程度。Western半定量结果显示,与正常组相比,模型对照组的 TSP-1、ATGF-β1、L-TGF-β1 表达量均明显升高。荧光定量PCR结果显示,与正常组相比,模型对照组的TSP-1、TRB-3 mRNA的表达量增高,说明糖尿病过程中的大鼠心肌组织中纤维化过程中的关键因子在基因和蛋白水平均表达明显增高。与模型组相比,生脉散组的 TSP-1、A-TGF-β1、L-TGF-β1 表达量均明显降低,提示生脉散可以通过降低纤维化过程中的细胞因子,从而延缓心肌纤维的发生。
[1]Rullber S, Dulgush J, YuceoglYZ, etal. New typeof cardiomyopathy associated with diabetic glomerulosclerosis[J].Am J Cardiol,1972,30:595-602.
[2]Schannwell CM,Left ventricular diastolic dysfunction as an early manifestation of diabetic cardiomypathy[J].Cardiology,2002,98(1-2):33-30.
[3]Asbun J,Villarreal FJ.The pathogenesis of myocardial fibrosis in the setting of diabetic cardiomyopathy[J].J Am Coll Cardiol,2006,47(4):693-700.
[4]Cai L,Wang Y,Zhou G,et al.Attenuation by metallothionein of early cardiac cell death via suppression of mitochondrial oxidative stress results in a prevention of diabetic[J].Cardiol,2006,48(8):1688-1697.
[5]廖泽云,姜锦林,刘红.生脉散对实验性高脂血症大鼠血液流变学及抗氧化作用的实验研究[J].辽宁中医杂志,2007,34(10):1478-1479.
[6]Morishima Y,Nomura A,Uchida Y,et al.Triggering the induction of myofibroblast and fibrogenesis by airway epithelial shedding[J].Am J Respir Cell Mol Biol,2001,24:1-11.
[7]钟鸣,张薇,苗雅,等.糖/血小板反应素-1/转化生长因子 β1信号传导途径在糖尿病心肌病发病中的作用[J].中华心血管病杂志,2006,34(3):217-220.
[8]Regulation of expression and signaling modulator function of mammalian tribbles is cell-type specific[J].Immunllogy Letters,2006,10:171-177.
[9 ]Ling Li,SAWAMURA Tatsuya,RENIER Geneviève.Glucose enhances human macrophage LOX-1 expression:Role for LOX-1 in glucose-induced macrophage foam cell formation CireRes,2004,94(7):892-90.
[10]Park JK,Fischer R,Dechend R,et al.P38 mitogen-activated protein kinase inhibition ameliorates angiotensin II-induced target organ damage[J].Hypertension,2007,49(3):481-489.
[11]丛丽,俞茂华,李益明.chymase与糖尿病心肌病变[J].国外医学内分泌学分册,2004,24(增刊):33-35.
[12]赵晓燕,赵连友,郑强荪,等.糜酶对大鼠心脏成纤维细胞增殖和胶原合成的影响[J].心脏杂志,2008,20(3):268-272.
△通讯作者:王阶,博士后合作导师。E-mail:wangjie@163.com。
Effect of Shengmai San on the on the Rats of Diabetic Cardiomyopathy
NI Qing1,WANG Jie1△,ZHAO An-bin2,YU Bin2,WANG Min2,HUANG Chun-rong2,LI En-qing2
(1.Guang'anmen Hospital China Academy of Chinese Medical Sciences,Beijing100053,China;2.Medical school of Jinan University,Guangzhou510632,China)
Objective:Observe the effect of Shengmai San on the diabetic cardiomyopathy(DCM).Methods:The rat model of DCM was established by eating a high-fat diet together with injection of high dose streptozotocin(50mg/kg)intraperitoneally.After 12 weeks,electrocardiogram was used to evaluate the damage of the myocardial,blood serum GLU,cholesterin and TG were tested by Clinical Chemistry Test Systems.The content of collagen was quantified by Masson staining.Level of cardiomyocyte apoptosis tested by Tunel apoptosis kit.The mRNA level of TSP-1 and TRB-3 was determined by quantification real time RT-PCR,while the protein level of TSP-1、A-TGF-β1 and L-TGF-β1 was analyzed by Western blotting and the protein level of TSP-1、TGF-β1、TRB-3 and Chymase was analyzed by immunohistochemistry.Results:Compared with control group,the rats blood glucose,cholesterol,triglycerides of Shengmai San group were significantly decreased.The Myocardial tissue was less damaged and the collagen content was less than control group.The expression of tsp-1,A-TGF-1 and L-TGF-β1 of the mixed liquor of Shengmai San and Danshen Decoction group in the diabetic cardiac muscle were much less than that in control group.The mRNA level of tsp-1 and TRB-3 were lower than control group by PCR detection.Conclusion:Shengmai San can inhibit the process of fibrosis in diabetic cardiomyopathy myocardial rats muscle and delay the formation of diabetic cardiomyopathy through of hyperglycemia rats through many signal pathways.
Shengmai San;Diabetic cardiomyopathy;Collagen;apoptosis;TSP-1;TGF-β1;TSP-1;TRB-3;Chymase
R285.5
B
1006-3250(2010)07-0572-05
中国博士后科学基金一等资助金(20070410129);中国博士后科学基金第一批特别资助金(200801166)资助;北京市科委重大项目课题(H020920010330)和科技计划课题资助(D08050703020802)
2009-0-0

