江苏省1例布鲁氏菌病的实验室检测及分子分型
谈忠鸣,汤奋扬,陈 萍,钱慧敏
江苏省1例布鲁氏菌病的实验室检测及分子分型
谈忠鸣1,汤奋扬1,陈 萍2,钱慧敏1
目的利用免疫学抗体检测及分子分型,确诊1例临床疑似布鲁氏菌病病例。方法 虎红平板凝集试验、试管凝集试验检测血清中抗体,PCR方法及测序技术检测布鲁氏菌特异基因。结果 病人血清中抗体阳性,疑似菌株经PCR鉴定为羊种布鲁氏菌。结论 此次感染者之病原体为羊种布鲁氏菌。
布鲁氏菌病;羊种布鲁氏菌;血清学;PCR;分子分型
2009年7月江苏某医院收治1例疑似布病患者,为尽快查明病因对症治疗,该院进行了分离培养,并将疑似致病菌株及病人血液送本中心鉴定,本中心运用PCR快速方法6h检测出结果并将结果反馈医院,现将实验结果报告如下。
1 材料与方法
1.1 标本来源 血清取自病人,菌株由医院检验科从病人血液中分离,送本中心后转种血平板,置37℃温箱中培养(双份培养其中1份置于5%CO2环境中)。
1.2 试剂 TaKaRa LA Taq酶、dNTPs购自宝生物工程(大连)有限公司,PCR扩增引物由上海生工生物技术有限公司合成,布鲁氏菌虎红平板凝集试剂和试管凝集试剂购自中国疾病预防控制中心流行病研究所布病室。
1.3 鉴定步骤 所有活菌操作均在P2+实验室中进行。
1.3.1 血清抗体检测 取10μ L虎红平板凝集试剂和10μ L病人血清在玻片上混匀,2min内观察结果。试管凝集试验步骤按照试剂说明书操作。
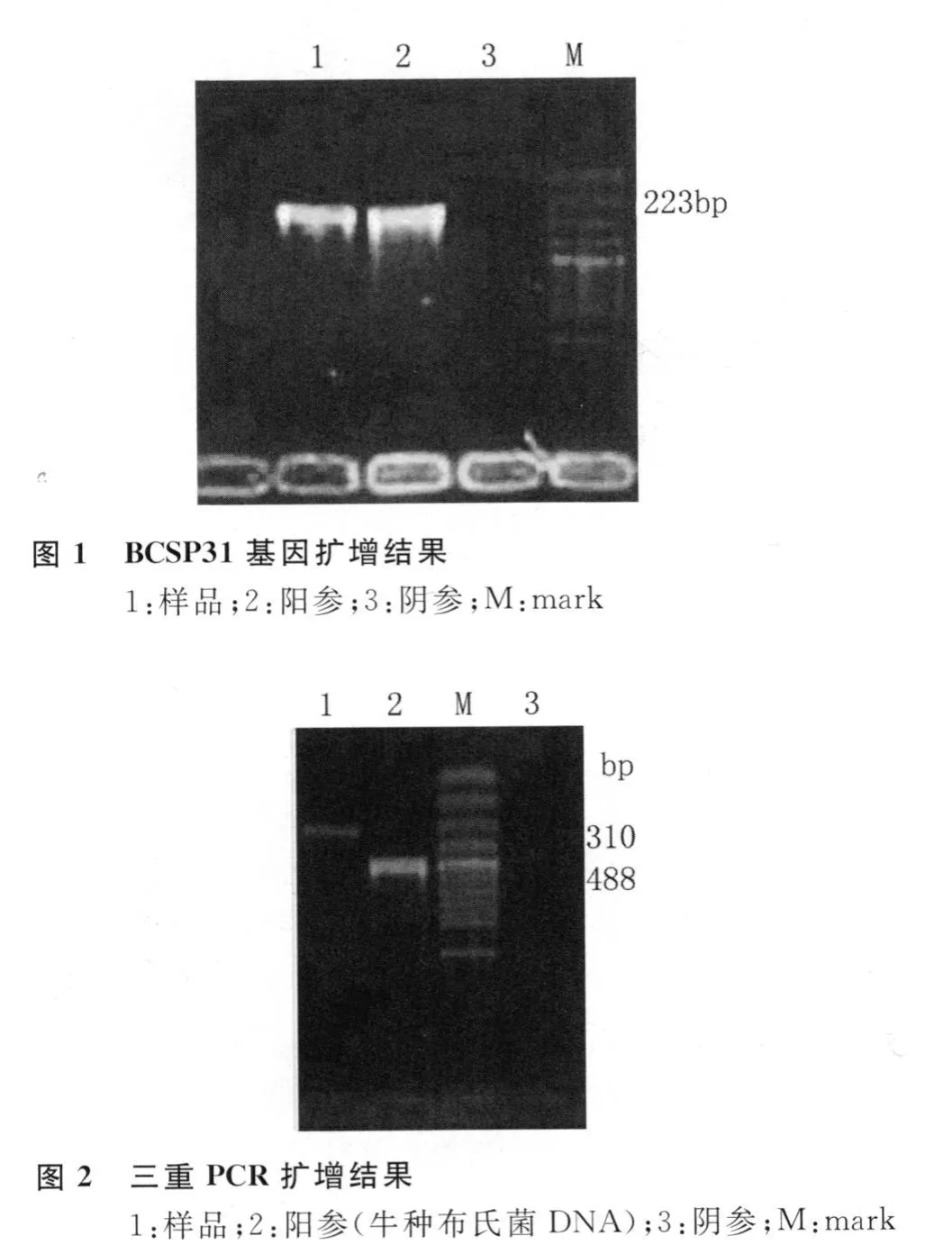
1.3.2 PCR检测 从平板上挑取疑似菌落,煮沸法制备DNA模板。普通PCR检测布氏杆菌BCSP31基因(中国疾病预防控制中心布病室提供),此基因是一种免疫原性膜蛋白基因,具有高度的特异性和同源性。扩增片段为223bp,25μ L 反应体系:10×buffer 2.5μ L,dNTP 1.5μ L,引物各1μ L,Taq酶 0.5μ L,DNA 模板1μ L,双蒸水补足。循环条件:93℃预变性 5min,90℃ 1min、60℃ 1min、72℃ 1min(30个循环),72℃延伸10min,4℃保存。分型采用三重PCR检测布鲁杆菌IS711基因〔1-2〕,根据该基因插入序列在不同种布氏菌基因组中插入位置的差异,可在分子水平上鉴定牛种、羊种和猪种布氏菌。合成3条上游引物BMAS-M-F、BMAS-A-F、BM AS-S-F和一条下游引物 BMAS-R〔3〕。扩增片段大小为:羊种 310bp、牛种 488bp、猪种 737bp。PCR 50μ L 反应体系:10×buffer 5μ L,dNTP 8μ L,引物各 1μ L,Taq酶0.5μ L,DNA模板 1μ L,双蒸水补足。循环条件:94℃预变性5min,94℃ 30sec、55℃40sec、72℃30sec(30 个循环),72℃延伸7min,4℃保存。分别取两种 PCR产物各7.5μ L,1.5%琼脂糖凝胶电泳分析,回收产物,送生物公司测序。
2 结 果
2.1 菌落形态 24h后平板上长出微小、无色、透明的光滑型菌落,无溶血现象。
2.2 血清抗体结果 虎红平板凝集试验出现白色抗原抗体结合物。试管凝集试验结果为1∶100(+++)。
2.3 PCR结果 PCR检测布氏菌的BCSP31基因为阳性;三重PCR检测IS711序列,在310bp左右出现阳性条带,表明此次感染人的致病微生物为羊种布氏菌。PCR产物经测序后在GenBank中比对,确认为布氏菌BCSP31基因和羊种布氏菌IS711基因序列。电泳结果见图1、2。
3 讨 论
布氏菌病(brucellosis)是由布氏菌引起的人畜共患的乙类传染病,临床表现复杂多样,波状热型曾被认为是最典型的热型,近几年来,波状热已属罕见,而多见的是长期慢性不规则的低热,慢性期患者更是如此〔3〕。其他症状有多汗、关节痛、睾丸痛、肝脾肿大为特点,病情轻重差异很大,易误诊。临床医生较多考虑为结核、伤寒、血液病或结缔组织病。
本病例于2009年4月份出现38.5℃发热、咳嗽等症状,经医院门诊输液治疗后好转。5月份患者再次出现39.8℃发热,咳嗽等症状,经同一医院输液治疗好转。2009年6月份患者38.6℃发热,发热前有畏寒,发热以午后为重,伴干咳,有夜间盗汗、消瘦等症状,CT显示脾脏轻度肿大。
患者为当地首例病例,经流行病学调查,患者居住城市小区,卫生条件良好,附近无大型牛、猪、羊等家畜养殖所。2009年3月患者曾与被遗弃的病猫有过接触,喂过1次,后病猫死亡,被该患者丢弃至垃圾桶。怀疑病猫是此次病例的可能传染源,国外也有过病猫传人且从病猫的组织中分离布鲁氏菌的报道〔4〕和实验室条件下致猫感染的报道〔5〕。但本次病例由于患者发病时间较长,无法取得病猫样进行验证。本次病例不能排除输入的可能性。
本次实验室检测用的虎红平板凝集试验(RBPT)和试管凝集试验(SAT),为我国布病诊断的金标准,因其方法简便快速,对实验室要求不高可应用于初筛及早期诊断,但单独使用敏感性和特异性一般,且不能区分人工免疫与自然感染,一般结合临床症状做辅助诊断。
本次实验扩增的布氏菌表面蛋白31基因(BSCP31)是具有免疫原性的可溶性细胞表面蛋白质,能够稳定地存在于毒力不同的布氏菌的基因组中,但其基因功能尚不清楚。目前对人致病的布氏菌主要是羊、牛、猪3种。现有的实验室分型方法如硫化氢产生量测定、染料抑菌试验、单相特异性血清A、M 凝集试验、布氏菌噬菌体裂解试验等,对实验操作人员的经验要求较高,实验周期长,敏感性和特异性一般。根据插入序列IS711分别在牛、羊、猪3个种型的基因组中插入位置的差异设计的多重PCR,可同时鉴别感染人的3种布氏菌,并在敏感性和特异性上均高于传统方法。本次实验运用两种PCR方法,分离出致病菌株后从提取核酸到检测出阳性结果共耗时6h。为确保实验结果准确可靠,后将PCR产物送生物公司测序验证结果。可见运用PCR技术对布氏菌进行鉴定,特别是在分子水平上对布鲁菌进行分型的方法,能够为临床的诊断治疗、疫情的处理控制提供快速准确的依据。
〔1〕 Baddour MM,Alkhalifa DH.Evaluation of three polymerase chain reaction techniques for detection ofBrucellaDNA in peripheral human blood〔 J〕.Can J Microbiol,2008,54(5):352-357.
〔2〕杜昕颖,汪舟佳,王玉飞,等.三重 PCR鉴别牛、羊和猪3个布氏杆菌种的方法研究〔J〕.解放军医学杂志,2009,34(1):110-112.
〔3〕卫生部疾病预防控制局.布鲁菌病防治手册〔M〕.北京:人民卫生出版社,2008:100-103.
〔4〕Repina LP,Nikulina AI,Kosilov IA.A case of human infection with brucellosis from a cat〔J〕.Zh Mikrobiol Epidemiol Immunobiol,1993,(4):66-68.
〔5〕T olari F,Farina R,Arispici M,et al.Brucellosis in the cat.Experimental infection with Brucella canis〔J〕.Ann Sclavo,1982,24(6):577-585.
Laboratory examination and molecular typing for one case of brucellosis in Jiangsu Province
TAN Zhong-ming,TANG Fen-yang,CHEN Ping,QIAN Hui-min
(J iangsu Provincial Center for Disease Prevention and Control,NanJ ing210009,China)
To use antibody detection and molecular typing to diagnose a brucellosis suspected patient clinically,antibody was detected by rose bengal plate agglutination test and serum agglutination test,and specific gene ofBrucellawere detected by PCR and DNA sequencing.Detection result showed that serum antibody in the patient was positives and the isolate was identified asBrucellamelitensisby PCR.It's indicated that the pathogenic microorganism that infected human isBrucella melitensis.
brucellosis;Brucella melitensis;serology;PCR;molecular-typing
R378.5
B
1002-2694(2010)08-0787-02
汤奋扬,Email:tfyepi@jscdc.cn
1.江苏省疾病预防控制中心,南京 210009;2.江苏大学附属医院
2010-01-15;
2010-04-30

