稳定表达Bcl-2的骨髓间充质干细胞载体的建立及对缺血性损伤保护作用的实验研究
何凡,何志义,李蕾,秦雪,邓淑敏,刘芳,阮杏林,冯程程
(1.中国医科大学 第一附属医院神经内科,沈阳 110001;2.沈阳军区总医院 神经内科,沈阳 110016)
近年来,干细胞移植作为一种不同于传统治疗的全新方法,能重塑受损的神经元通路和改善神经功能缺失而成为缺血性脑血管病治疗方面的研究热点[1]。用于治疗缺血性脑血管病的干细胞包括神经干细胞(neural stem cell,NSC)和骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,MSC)。神经干细胞来源于人的脑组织或人胚胎干细胞,受医学伦理限制,不适合自体移植。MSC更适合用于缺血性脑血管病的干细胞移植治疗[2~4]。而MSC移植入体内后的低成活率限制了其应用。Chen等[5]研究发现,MSC的神经细胞转化率在体外可高达80%,而在体内仅约为3%~10%,其原因虽然复杂,但主要是MSC移植至体内后,其自身发生凋亡所致。因此,如何减少其移植后凋亡的发生,提高MSC在体内的存活率及向神经细胞定向分化的能力是目前干细胞移植治疗脑缺血亟待解决的问题。
B cell lymphoma/leukemia gene 2(Bcl-2)是目前研究较为明确的抗凋亡基因。本研究拟采用慢病毒法将Bcl-2转导入MSC中,旨在增加MSC对Bcl-2的表达,提高MSC的存活率,为进一步解决MSC在体内凋亡率高的问题打下坚实基础。
1 材料与方法
1.1 材料
Gateway®BP ClonaseTMII Enzyme Mix、Gateway®LR ClonaseTMIIPlusEnzymeMix、LipofectamineTM2000、Opti-MEM I Reduced Serum Medium 均 购 自invitrogen公司。普TRI REAGENT购自美国MRC。RQ1 RNase-Free DNase购自美国Promega。RevertAidTMFirst Strand cDNA Synthesis Kit、Taq DNA Polymerase、dNTP Mix、GeneRulerTM100 bp DNA Ladder、RevertAidTMFirst Strand cDNA Synthesis Kit购自美国 Fermentas公司。Puromycin、Polybrene、B-ME(2-巯基乙醇)购自Sigma公司。通琼脂糖凝胶DNA回收试剂盒、质粒小提中量试剂盒购自TIANGEN公司。Neomycin、D/F12购自Gibco公司。F344大鼠间质干完全培养基、PBS、消化胰酶购自Cyagen公司。Annexin V-FITC细胞凋亡检测试剂盒购自碧云天生物技术研究所。F344大鼠骨髓基质干细胞购自赛业(广州)生物科技有限公司。
1.2 方法
1.2.1 Bcl-2慢病毒载体构建及鉴定:根据小鼠Bcl-2序列设计引物,在5′端分别加上attB1和attB2位点,上下游引物分别为:5′GGGGACAAGTTTGTACAAAAAAGCAGGCTGCCACCATGGCGCAAGCCGG GAGAAC 3′与 5′GGGGACCACTTTGTACAAGAAA GCTGGGTTCACTTGTGGCCCAGGTATG 3′以 小 鼠cDNA为模板,以上述设计引物进行PCR扩增。PCR产物通过电泳检测后进行回收,纯化。BP结合反应-构建pDOWN-mBcl-2载体。将BP反应物转化到感受态One Shot OmniMAXTM2 T1 Phage-Resistant CellsE.coli株中。LR结合反应-构建pLV/EXPN2-Puro-EF1A-mBcl2表达载体,将LR反应物转化到感受态One Shot®Mach1TMT1R Chemically CompetentE.coli株中。筛选出重组子后提取质粒进行测序检测。
1.2.2 Bcl-2慢病毒转导大鼠间质干细胞及鉴定:转导前1 d(第1天),按照合适的细胞数量把细胞接种到6孔板中,使转导当天的细胞融合度达到30%~50%;转导当天(第2天),融解携带mBcl-2慢病毒浓缩液;去除培养液,加入1 ml F344大鼠间质干完全培养基和100 μl的mBcl-2慢病毒浓缩液;每孔细胞可加入Polybrene促进病毒感染细胞(终浓度6 μg/mL),放置37℃、5%CO2饱和湿度培养箱过夜培养;转导8 h后,去除含有病毒的培养液,并加入新鲜的完全培养液。放置37℃、5%CO2饱和湿度培养箱过夜培养;转导24 h后,去除含有病毒的培养液,并加入含有Puromycin(4 μg/mL)的完全培养液来筛选被稳定转导的细胞。放置37℃、5%CO2饱和湿度培养箱过夜培养。RT-PCR法检测转染后Bcl-2的表达。
1.2.3 Bcl-2 Rat F344 MSC抗凋亡检测:分别准备T75瓶F344MSC及Bcl-2/F344 MSC,待细胞约80%~90%汇合时分别传至6孔板中,37℃5%CO2培养约24 h,至孔内细胞约90%以上汇合。参照Zhu等的方法[6]通过血清和氧剥夺(serum and oxygen eprivation,SOD)方式建立MSC体外模拟缺血损伤的细胞模型。流式鉴定细胞凋亡率按试剂盒说明书进行上机前操作,其中1孔做空白对照,1孔做Annexin-FITC单标对照,1孔做PI单标对照,剩1孔做实验组,每组重复3次。
1.2.4 Bcl-2 Rat F344 MSC神经诱导及检测:复苏的Bcl-2 F344 MSC传代,按照1∶2传代1次,用于做神经诱导;细胞传到6孔板中,所有的细胞按照基本相同的密度接种;细胞在50%~60%汇合时,加入1 mmol/L β-ME(DMEM-20%FBS)处理 24 h,进行预诱导;换液前用PBS洗涤3次,洗去FBS,加入5mmol/L β-ME(DMEM-0%FBS)诱导5~6 h。本实验选取NSE和Vimentin作标记。以Gapdh基因作为内参。神经元特异型烯醇化酶(neuron-specific enolase,NSE),作为神经元的标记。波形蛋白(Vimentin)作为神经胶质细胞的标记,RT-PCR法检测NSE和Vimentin的表达。
2 结果
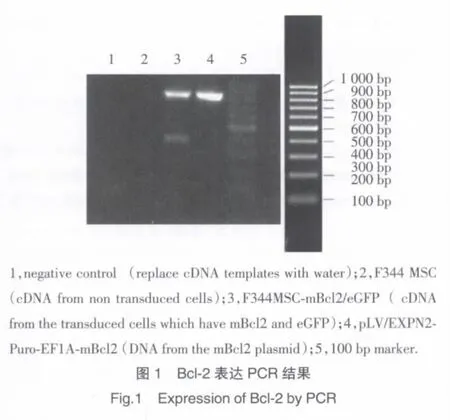
2.1 稳定转导Bcl-2基因的MSC的筛选及Bcl-2基因的检测
转导Bcl-2的MSC用Puro筛选,作用3 d后呈现细胞死亡现象,与阴性对照相比,转导过的F344大鼠间充质干细胞的存活细胞明显多于野生型F344大鼠。Puro作用8 d后,细胞出现增殖现象。与阴性对照相比,转导过的F344大鼠间充质干细胞的存活细胞明显多于野生型F344大鼠。Puro作用8 d后撤药,换成正常完全培养基培养,各个药物浓度筛选过的细胞继续生长,完成抗药性细胞筛选。RT-PCR法检测转导后细胞内Bcl-2基因的表达情况见图1。
2.2 SOD诱导细胞凋亡的流式细胞术检测(图2)
Bcl-2/F344MSC早期细胞凋亡率为(18.95±2.57)%,F344 MSC 早期细胞凋亡率为(30.87±5.69)%,两组比较差异有统计学意义(P<0.01)。

2.3 神经诱导细胞RT-PCR结果
细胞预诱导后有较多成球形细胞,但是大部分细胞为短梭形贴壁增殖;诱导后细胞成球形和拉丝回缩明显,细胞贴壁性下降明显有悬浮的趋势。结果显示无论经过诱导或者没经过诱导的细胞都表达NSE和Vimentin。经过对电泳条带的光密度测量,经过诱导的细胞表达NSE的量比没经过诱导的细胞表达NSE的量要大近1倍。而Vimentin的表达量在这两种细胞中基本没差别(图3)。

3 讨论
MSC具有贴壁生长的特性,且体外培养能够不断的分裂和增殖,遗传性能稳定,易于进行外源基因的转染及蛋白的表达[7]。Bcl-2是Tsujimoto等从滤泡性淋巴瘤中分离出来的一种原癌基因,能对抗多种原因引起的细胞凋亡,被认为是能够抑制细胞凋亡发生的“抗凋亡基因”。尽管Bcl-2最初是作为一种原癌基因被认识的,但它对正常细胞的增殖和分化没有影响,不会导致细胞的恶性转化而发生癌变。因此Bcl-2可作为外源性基因转染MSC,起到基因及干细胞治疗的双重作用。最近Li等[8]将Bcl-2基因修饰的MSC移植入心肌梗死大鼠模型,发现Bcl-2能够增加移植后的MSC的存活率,并且不影响MSC的多向分化潜能,心肌梗死灶周围的毛细血管密度增加15%,心肌梗死病灶缩小17%,心肌功能得到明显改善。目前常用的细胞转染方法包括脂质体转染法和病毒载体法,常用的病毒包括腺病毒、单纯疱疹病毒、逆转录病毒和慢病毒。慢病毒与逆转录病毒载体法均为高效转基因方法,可使目的基因转导入载体细胞的基因组中,并持续表达目的基因。逆转录病毒载体法依赖细胞分裂周期,而慢病毒载体法并不依赖细胞分裂周期。因此本研究采用慢病毒转染的方法,获得稳定、高效表达Bcl-2的细胞株。
在MSC移植治疗神经系统疾病的研究中对脑缺血的治疗研究最多。导致神经细胞凋亡和坏死的脑缺血恶劣的病理生理环境必然对MSC存活及发挥其治疗功效构成极大的威胁。本研究参照Zhu等的方法[6]以SOD处理来模拟脑缺血,结果显示SOD可诱导MSC的凋亡。经Bcl-2基因转染的MSC的凋亡明显减少,存活细胞明显增加,这说明Bcl-2基因转染对MSC体外模拟缺血性损伤有保护作用,携带有Bcl-2基因的细胞抗凋亡能力比正常细胞强。使Bcl-2基因修饰的MSC移植治疗脑缺血而发挥其更大治疗效应成为可能。
MSC是来源于骨髓的一种具有自我复制和多向分化潜能的非造血干细胞,不仅可以分化为骨、软骨、脂肪等间质细胞,在适宜的条件下,还能分化为神经细胞[9]。本研究提示,转导了Bcl-2基因的MSC仍具有向神经细胞分化的潜能。说明转导了Bcl-2基因的MSC在基因治疗过程中,仍能发挥其干细胞的作用。本实验只作为F344MSC-mBcl2/eGFP向神经细胞分化能力的检测,经过诱导的细胞表达NSE较多,可能与其自身抗凋亡能力强,细胞存活时间长有关。转导Bcl-2基因后,提高了MSC在体内的存活率及向神经细胞定向分化的能力,从而为下一步Bcl-2基因修饰的MSC移植治疗脑缺血的实验研究奠定基础。
[1]Dharmasaroia P.Bone marrow-derived mesenchymal stem cells for the treatment of ischemic stroke[J].J Clin Neurosci,2009,16(1):12-20.
[2]Himes BT,Neuhuber B,Coleman C,et al.Recovery of function following grafting of human bone marrow-derived stromal cells into the injuredspinalcord[J].NeurorehabilNeuralRepair,2006,20(2):278-296.
[3]Lee RH,Hsu SC,Munoz J,et al.A subset of human rapidly self-re-newing marrows tromal cells preferentially engraft in mice[J].Blood,2006,107(5):2153-2161.
[4]Gregory CA,Prockop DJ,Spees JL.Non-hematopoietic bone marrows tem cells:Molecular control of expans ion and differentiation[J].Experimental Cell Research,2005,306(2):330-335.
[5]Chen J,Li Y,Katakowski M,et al.Intravenous bone marrow stromal cell therapy reduces apoptosis and promotes endogenous cell proliferationafterstrokeinfemalerat[J].JNeurosciRes,2003,73(6):778-786.
[6]Zhu W,Chen J,Cong X,et al.Hypoxia and serum deprivation induced apoptosis in mesenchymal stem cells[J].Stem Cells,2006,24(2):416-425.
[7]Kazuhiko K,Kimianori N,Takashi T,et al.BDNF gene-modified mesenchymal stem cells promote functinal recovery and reduced infarct sizeintheratmiddlecerebralarteryocclusionmodel[J].Mol Ther,2004,9(2):189-197.
[8]Li W,Ma N,Ong LL,et al.Bcl-2 engineered MSCs inhibited apoptosis and improved heart function[J].Stem Cells,2007,25(8):2118-2127.
[9]Kurozumi K,Nakamura K,Tamiya T,et al.Mesenchymal stem cells that produce neurotrophic factors reduce ischemic damage in the rat middlecerebralarteryocclusionmodel[J].MolTher,2005,11(1):96-104.

