中国北方汉族男性雄激素受体基因(CAG)n多态分布及其与低氧训练效果的关联性研究
王海燕 胡扬 郝鑫 许春艳 李燕春 衣龙彦 聂晶
1北京体育大学科研中心(北京100084) 2北京体育大学研究生院3北京体育大学运动人体科学学院生化教研室 4江西师范大学
睾酮具有同化作用,可增强蛋白质合成,增加肌肉重量,刺激红细胞生成,加速血红蛋白合成,促进体内抗体形成,增加免疫功能和抗感染能力。雄激素的作用由其靶细胞内雄激素受体(androgen receptor,AR)介导,AR结合容量的高低决定着体内有效雄激素水平的高低,是雄激素发挥同化作用的限制性因素[1]。人AR基因位于Xq11~12,含8个外显子。AR蛋白内的长度多态性多聚谷氨酰胺(Gln)n,由AR基因外显子N端配体非依赖性转录激活功能区内的(CAG)n编码,此区域是决定转录调节的主要区域[2]。(CAG)n在正常人中重复范围是8~31次,平均22次左右。大量研究显示,CAG重复次数与转录共激活作用呈负相关,即CAG重复次数增加,雄激素受体功能下降[3-7]。这一点在临床上对CAG重复次数与雄性功能增加疾病的研究中也得到证实。AR基因(CAG)n多态影响体内雄激素水平,而雄激素水平与运动效果密切相关,因此该多态可能也会影响各种形式的运动效果。但目前该多态对运动能力影响的研究还很少,对低氧训练效果影响的研究更为少见。
因此,本研究探讨AR外显子1(CAG)n多态性与低氧训练效果的关联性,寻找预测低氧训练敏感性的分子遗传学标记。
1 对象和方法
1.1 受试者
北京体育大学体育系和运动系在校男性大学生71名,其中国家级健将1名,一级运动员5名,二级运动员42名。全部来自东北三省、河北、天津、山东等中国北方平原地区。身体健康、无家族疾病史,无亲缘关系,并且均知情同意。实验前6个月无高原训练或居住史,实验前1个月及实验期间未服用包括铁剂在内的营养补剂。其中,65名受试者完成本研究所有测试。受试者基本情况(mean±SE):平均年龄 19.78±0.21岁,身高 177.67±0.64cm,训练时间 4.23±0.27年。
1.2 低氧训练方案
受试者进行为期30天的低氧训练。低氧环境为人工模拟的常压低氧环境(北京体育大学科研中心低氧训练实验室),训练方案为高住高练低训(HiHiLo)。高住:每晚低氧睡眠至少 10h(晚 21∶00~次日晨 7∶00),O2浓度为14.3%~14.8%(模拟海拔高度约2800~3000米);高练:低氧训练 3次/周,O2浓度为14.8%~15.4%(模拟海拔高度约2500~2800米),以个体常氧下75%VO2max为基础强度蹬功率自行车30min/次(60r/min),运动过程中微调功率自行车负荷使受试者SpO2维持在90%左右(87%~93%);低训:常氧环境下进行平均5次/周、90分钟/次的专项训练,其他时间自行安排活动。北京平原地区的海拔高度为20~60米。
1.3 体重和最大摄氧量测试
分别于低氧训练前后测试受试者的体重和常氧环境下的VO2max。使用功率自行车递增负荷法测试VO2max。递增方法:运动频率60转/分,起始负荷90W,每2min递增30W,在RPE达到17后,每2min递增15W,直至力竭。VO2max判定标准:心率超过180次/分,呼吸商大于1.1,氧耗量不再增加,受试者经鼓励不能维持运动。VO2max测试数据为绝对值(VO2max)和相对值(rVO2max)。仪器:功率自行车(Monark818,瑞典),气体代谢分析仪(Cortex-Metalyzer II型心肺功能测试系统和气体自动检测仪,德国),体重计(健民电子体重计,中国)。
1.4 (CAG)n多态的基因型分析
从受试者血液白细胞中提取DNA,-80℃保存。PCR扩增:(1)使用primier5.0软件自行设计引物,并用HEX标记上游引物 5’端。forward:5’-HEX CCA GAA TCT GTT CCA CAG CGT GC-3’;reverse:5’-CCT CAT CCA GGA CCA GGT AGC CT-3’。(CAG)22次重复 PCR 产物片段长 269bp。(2)PCR 反应体系 (20μl):DNA 模板100ng,0.2μl Taq 酶(5U/μl),0.4μl dNTP(10mM),2μl Mg2+(25mM),上下游引物各 1μl(0.05μg/μl),2μl 10×buffer,13μl灭菌双蒸水补齐。(3)PCR 扩增条件:95℃预变性 5min;循环参数:变性 94℃ 30s,退火 60℃ 30s,延伸 72℃ 30s,共 30个循环;72℃延伸 10min。经 1%琼脂糖凝胶电泳,EB染色检测PCR产物。(4)荧光标记复合STR(Short Tandem Repeat)-genescan方法检测 CAG 多态重复次数:Genescan-500〔Rox〕作为内标(美国 ABI公司),使用ABI-377DNA分析仪(美国ABI公司)确定片段长度;genescan3.1软件分析扩增产物。随机选取10个PCR扩增片段进行测序以校验以上分析的准确性。(CAG)22次重复等位基因的片段长度为266bp。
1.5 统计学分析
根据AR基因CAG重复次数对受试者分组,分别以21和22次重复等位基因作为分割点。受试者分别被分为短链组(≤21次)和长链组(>21次),以及短链组(≤22次)和长链组(>22次)。体重和VO2max对低氧训练的应答采用以下公式计算[Δ=(训练后-训练前)/训练前×100%]。
若方差齐性则采用独立样本t检验分析不同基因型组间各指标差异,方差不齐则进行非参数检验;各组受试者低氧训练前后的比较使用配对t检验;低氧训练后不同基因型组间VO2max增加和降低的人数分布频率差异采用卡方检验;将 AR(CAG)n重复次数作为连续变量,采用直线相关分析其与VO2max的相关性。采用SPSS11.5统计软件处理所有数据,结果以Mean±SE表示。双尾检测,显著性水平为P<0.05,极显著水平为P<0.01。
2 结果
2.1 (CAG)n多态分布特点
本研究受试者均为男性,AR基因位于X性染色体上,因此在男性中不需做Hardy-Weinberg平衡检验。在男性中只有一个(CAG)n等位基因,因此等位基因也是基因型。
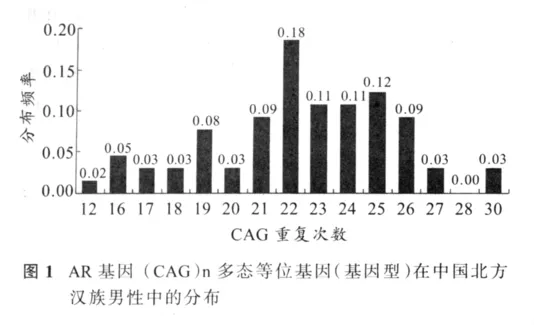
在受试者中观察到(CAG)12,(CAG)16-28,(CAG)30共15种重复次数的等位基因和基因型。其中22次重复分布频率最高,达到18%(图1)。
2.2 (CAG)n多态与体重的关联性
低氧训练后,所有65名受试者体重平均值从68.23±0.88kg降到67.70±0.87kg,具有统计学意义(P=0.005)。当分别以(CAG)21次和22次重复分组时,发现短链组低氧训练前体重基础值显著性低于长链组(表1)。
2.3 (CAG)n多态与VO2max关联性
低氧训练后,所有65名受试者VO2max绝对值平均值从 3.09±0.06 增加到 3.24±0.05(P=0.00),相对值平均值 rVO2max 从 45.13±0.72 增加到 47.98±0.80(P=0.00),均有统计学意义。分别以21次和22次重复等位基因作为分割点时,发现长链和短链基因型携带者组间低氧训练前最大摄氧量绝对值和相对值指标均无显著性差异,但低氧训练后短链组ΔVO2max和ΔrVO2max增加幅度均极显著性高于长链组,P<0.01(表1)。与低氧训练前基础值相比,低氧训练后短链(≤21次和≤22次)组VO2max和rVO2max显著增加,P均为0.00;而在>21次组VO2max和rVO2max增加的显著性分别为P=0.09和P=0.02,在>22次组则无显著性P=0.52和P=0.20。

表1 AR基因(CAG)n多态不同基因型携带者VO2max和体重
相关分析发现,(CAG)n重复次数与 ΔVO2max和ΔrVO2max呈显著负相关(图2),Pearson相关系数分别为-0.378和-0.384,P值均为0.002。不同基因型组中,对ΔVO2max(ΔrVO2max)增加和下降的人数进行卡方检验,发现短链组ΔVO2max(ΔrVO2max)增加的人数显著高于下降的人数(表2)。
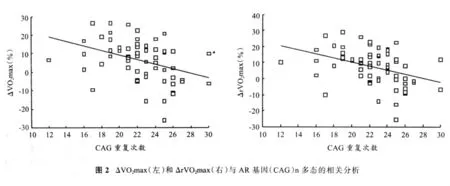
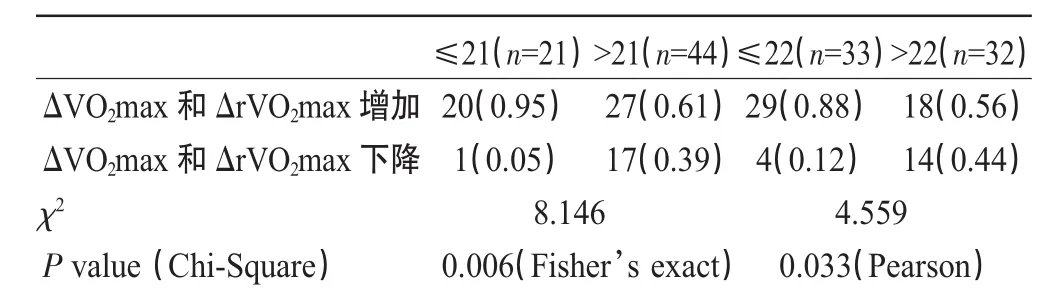
表2 AR基因(CAG)n多态不同基因型组间ΔVO2max变化分布频率
3 讨论
3.1 中国北方汉族男性AR基因(CAG)n多态的分布特征
AR中N端转录调节区域对配体引发AR活性至关重要。该区域包含一个多谷氨酸盐(Gln)n重复多态,由exon 1序列5’端的(CAG)n编码。(CAG)n在正常人中重复范围是 8~31次,平均 21±2次。AR基因(CAG)n多态在人群当中的分布具有明显的种族差异。本研究观察到(CAG)12,(CAG)16-28,(CAG)30,共 15 种重复次数的等位基因和基因型,其中22次重复分布频率最高,其次是23、24和25次重复。非洲人AR基因(CAG)n平均重复次数在18至20次之间,高加索人群的重复次数在21至22次之间,而东亚人的重复次数则在22至23次之间[8]。
3.2 AR基因(CAG)n多态与体重的关联性
本研究发现,CAG短链组体重基础值显著低于常链组,低氧训练后两组体重变化量仍存在显著性差异,但体重变化率无显著性差异。文献对AR基因CAG多态重复长度与体成分关系的报道并不完全一致。CAG重复长度与36~81岁男子的Bmi相关[9],并与男性瘦体重呈正相关[10]。然而,有研究发现CAG重复长度与 20~50岁健康男性的Bmi或体脂百分比相关[11]。也有研究报道CAG重复长度与老年男性体成分,包括体重、腰围、腰/臀比和体脂百分比之间没有直接相关,尽管较长CAG重复者的睾酮水平更低[12,13]。
3.3 AR基因(CAG)n多态与VO2max关联性
分别以重复21和22次等位基因作为分割点时,发现除≤22次组VO2max低于>22次组外,长链和短链基因型携带者组间低氧训练前VO2max和rVO2max指标均无显著性差异。≤22次组VO2max绝对值显著低于>22次组,但相对值无显著性差异。
低氧训练后,所有受试者VO2max和rVO2max均显著增加(P<0.01),说明本研究采用的HiHiLo低氧训练方法能提高耐力运动能力。结合AR(CAG)n多态分析,发现低氧训练后短链组ΔVO2max和ΔrVO2max均极显著高于长链组。与低氧训练前基础值相比,低氧训练后短链(≤21次和≤22次)组VO2max和rVO2max显著增加,P均为0.00;而在>21组仅rVO2max显著增加,在>22次组则无显著性变化。相关分析发现,(CAG)n重复次数与ΔVO2max和ΔrVO2max呈显著负相关。低氧训练后,短链组ΔVO2max和ΔrVO2max增加的人数显著性多于长链max max该组受试者的5%。因此,AR基因(CAG)n多态与中国北方汉族男性常压低氧环境下HiHiLo训练效果之间存在关联性,较短基因型携带者低氧训练后耐力水平提高更明显。
对AR基因(CAG)n多态与运动能力的报道较少。王海燕等[14]在中国北方汉族男性 AR(CAG)n多态与跑节省化的关联性研究中发现,该多态与跑节省化的初始值存在关联性,≤23次组的摄氧量初始值显著高于>23次组,提示该多态与有氧运动能力可能存在一定的关联性。但有研究在脊髓延髓肌萎缩症(SBMA)病人中发现CAG重复病理性增加,其进行12周中等强度有氧训练并未使VO2max增加[15]。本研究发现,>22次长链组受试者低氧训练后,VO2max的增加也未达到统计学意义,但≤21次组VO2max和rVO2max均显著增加。
雄激素在细胞内与AR结合后形成雄激素受体复合物后进入核内,通过一系列受体后机制将细胞外的雄激素信号传导到DNA上,调控特殊的基因表达,产生雄激素的生物效应。AR结合容量的高低决定着体内有效雄激素水平的高低,是雄激素发挥同化作用的限制因素[1]。AR中N端转录调节区域对配体引发AR活性至关重要。临床和离体研究均发现,AR转录调节活性与该区域包含的CAG重复次数呈负相关,存在短重复序列基因型携带者雄激素水平高于长重复序列的现象[3-7]。该多态与内分泌失调有关,临床上观察到较低的CAG重复次数与增强的雄性功能有关,如前列腺癌、男性秃头症、多毛症等;而在非病理的正常范围内(<35~37次重复),较高的重复次数与降低的雄性功能有关[16]。当CAG多态编码的多聚谷氨酰胺超过38次重复时将导致脊髓延髓肌萎缩症(SBMA)[17]。
本研究中,分别使用生物软件RNA Structure4.2和EMOSS3.0 in Linux对(CAG)n多态mRNA和蛋白序列进行预测,发现CAG重复将使AR mRNA二级结构中形成一个稳定的茎环结构(stem-loop structure),CAG重复次数多引起mRNA茎环结构长度增加,使mRNA形成更为稳定的二级结构,影响其转录过程。由(CAG)n多态编码的AR蛋白二级结构中的多聚谷氨酰胺(Gln)从9次重复开始增加两个β转角结构,在9次重复之后,每增加一个Gln就增加一个β转角结构。尽管增加的β转角结构对AR蛋白的作用仍不清楚,但大多数β转角结构位于蛋白表面,是蛋白生物活性的重要空间结构。
因此,AR基因(CAG)n多态性可能通过影响体内雄激素水平和活性,进而影响低氧训练效果。这可能是不同基因型组间低氧训练前后运动能力出现显著性差异的主要原因之一。
4 总结
本研究以AR基因(CAG)n多态21次和22次重复等位基因作为分割点划分基因型,分析中国北方汉族男性该重复多态与低氧训练后VO2max变化的关联性。结果发现,AR基因(CAG)n多态与常压低氧环境下HiHi-Lo者的低氧训练敏感性较好。
[1]Heinlein CA,Chang C.The Roles of Androgen Receptors and Androgen-Binding Proteins in Nongenomic Androgen Actions.Mol Endocrinol,2002,16(10):2181-2187.
[2]Edward PG.Molecular biology of the androgen receptor.J Clin Oncol,2002,20(13):3001-3015.
[3]Chamberlain NL,Driver ED,miesfeld RL.The length and locationof CAG trinucleotide repeats in the androgen receptor N-terminal domain affect transactivation function.Nucleic Acids Res,1994,22(15):3181-3186.
[4]Kazemi-Esfarjani P,Trifiro MA,Pinsky L.Evidence for a recessive function of the long polyglutamine tract in the human androgen receptor:possible pathogenetic relevance for the(CAG)n-expanded neuronopathies.Hum Mol Genet,1995,4(4):523-527.
[5]Choong CS,Kemppainen JA,Zhou ZX,et al.Reduced androgen receptor gene expression w ith first exon CAG repeat expansion.Mol Endocrinol,1996,10(12):1527-1535.
[6]Tut TG,Ghadeesy FJ,Trifiro MA,et al.Long polyglutamine tracts in the androgen receptor are associated w ith reduced transactivation,impaired sperm production,and male infertility.JClin Endocrinol Metab,1997,82(11):3777-3782.
[7]Callewaert L,Christiaens V,Haelens A,et al.Implications of a polyglutamine tract in the function of the human androgen receptor.Biochem Biophys Res Commun,2003,20(1):46-52.
[8]Zitzmann M,Nieschlag E.The CAG repeat polymorphism w ithin the androgen receptor gene and maleness.Int J Androl,2003,26(2):76-83.
[9]Gustafson DR,Wen MJ,Koppanati BM.Androgen receptor gene repeats and indices of obesity in older adults.Int JObes Relat Metab Disord,2003,27(1):75-81.
[10]Walsh S,Zmuda JM,Carley JA,et al.Androgen receptor CAG repeat polymorphismis associated w ith fat-free mass in men.JAppl Physiol,2005,98(1):132-137.
[11]Zitzmann M,Gromoll J,von Eckardstein A,et al.The CAG repeat polymorphismin the androgen receptor gene modulates body fatmass and serum concentrations of leptin and insulin inmen.Diabetologia,2003,46(1):31-39.
[12]Lapauw B,Goemaere S,Crabbe P,et al.Is the effect of testosterone on body composition modulated by the androgen receptor gene CAG repeat polymorphismin elderly men?Eur JEndocrinol,2007,156(3):395-401.
[13]Huhtaniemi IT,Pye SR,Limer KL,et al.European Male Ageing Study Group.Increased estrogen rather than decreased androgen action is associated w ith longer androgen receptor CAG repeats.J Clin Endocrinol Metab,2009,94 (1),277-284.
[14]王海燕,胡扬,席翼.中国北方汉族人群AR基因(CAG)n多态性与跑节省化的关联性研究.西安体育学院学报,2007,24(3):61-64.
[15]Preisler N,Andersen G,Th覬aersen F,et al.Effect of aerobic training in patients w ith spinal and bulbar muscular atrophy(Kennedy disease).Neurology,2009,72(4):317-323.
[16] Palazzolo I,Gliozzi A,Rusmini P,et al.The role of the polyglutamine tract in androgen receptor.JSteroid Biochem Mol Biol,2008,108(3-5),245-253.
[17]Dejager S,Bry-Gauillard H,Bruckert E,et al.A comprehensive endocrine description of Kennedy’s disease revealing androgen insensitivity linked to CAG repeat length.J Clin Endocrinol Metab,2002,87(8),3893-3901.

