端粒酶、VEGF基因蛋白在食管癌中的表达及临床意义
李 牧,宋剑非,梁岳培,郑 民,李安桂,王 玮
(桂林医学院附属医院心胸外科,广西 桂林 541001)
食管癌在中国的发生率较高,在消化道肿瘤中仅次于胃癌,其发病率男为 2.5/100000~5.0/100000,女为 1.5/100000~2.5/100000。虽然食管癌发生、发展的危险因素已被确认,但其分子机制仍在研究中。尽管现代诊断技术不断提高,但食管癌的早期诊断仍不乐观。食管癌的发生、发展是一个多基因参与、多步骤的过程,随着分子生物学的发展,基因及其产物的表达与肿瘤的关系成为食管癌防治的重点。本研究分析了端粒酶、血管内皮细胞生长因子(vascular endothelialgrow th factor,VEGF)在食管癌中的表达情况,探讨其与临床病理的关系以及他们的相关性。
1 资料与方法
1.1 一般资料 随机选择桂林医学院附属医院2002年1月12日至2008年5月17日食管癌根治术后石蜡包埋组织100例。男 69例,女 31例,年龄42~75岁,平均(59±6)岁。标本均经病理学确诊为鳞状细胞癌。其中有淋巴结转移者57例(指手术清扫的锁骨上、食管旁或肺门淋巴结组织经病理镜检诊断为阳性的病例),无淋巴结转移者43例;高分化鳞癌32例,中分化鳞癌51例,低分化鳞癌17例;侵及外膜的 67例,未侵及外膜的33例。所有患者送病理检查前均未放疗和化疗,有完整的临床和病历资料。另取癌旁正常食管黏膜组织标本41例(指癌组织切缘旁组织,经病理诊断为正常黏膜组织,无肿瘤组织残留的标本)作为正常对照组。
1.2 试剂来源 采用免疫组化SP法,鼠抗人端粒酶单克隆抗体、鼠抗人VEGF单克隆抗体、SP试剂盒、DAB显色剂均购自福州迈新公司(即用型)。PBS溶液、柠檬酸修复液、抗体稀释液、梯度乙醇等均由桂林医学院附属医院病理科提供。
1.3 方法 全部石蜡标本连续切片,厚度为4μm,免疫组化染色采用SP法,所有标本均在同一条件下严格按试剂盒说明书操作,DAB显色,以已知阳性切片作阳性对照,以PBS代替一抗进行阴性对照。
1.4 染色结果评定 结果判断标准:食管黏膜鳞状上皮细胞核、食管癌细胞核和(或)细胞质染成棕褐色为端粒酶阳性染色,每例阳性染色的癌细胞大于10%为阳性表达。细胞VEGF蛋白阳性表达定位于细胞浆中,呈棕黄色颗粒;部分肿瘤细胞细胞膜也有染色;在强阳性染色的癌组织附件可见淋巴管内皮着色。
1.5 统计学方法 采用SPSS13.0统计软件对数据进行分析,各组之间样本率的比较采用χ2检验,各指标相关分析采用Spearman等级相关。以P<0.05为差异有统计学意义。
2 结 果
2.1 食管癌和癌旁组织端粒酶、VEGF蛋白的表达情况 阳性染色特点:端粒酶蛋白在85例食管癌肿瘤细胞及5例癌旁黏膜细胞有表达,阳性表达定位于食管黏膜鳞状上皮细胞核和食管癌细胞质和(或)细胞膜核,呈棕褐色。VEGF蛋白在81例食管癌肿瘤细胞及7例癌旁黏膜细胞有表达,阳性表达定位于细胞浆中,呈棕黄色颗粒;部分肿瘤细胞细胞膜也有染色,见表1。
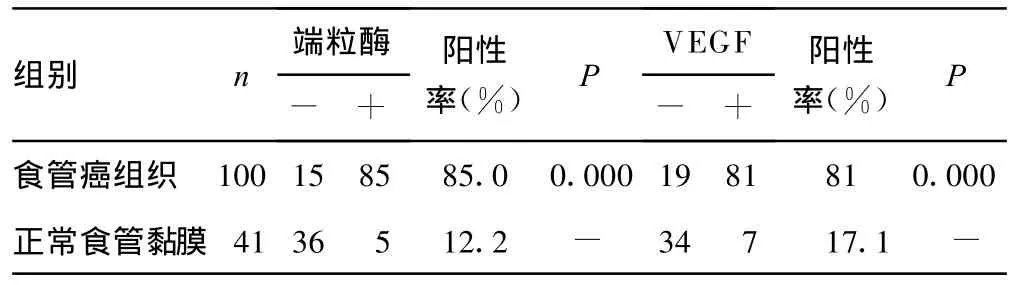
表1 端粒酶、VEGF在正常食管黏膜和组织食管鳞状细胞癌中的表达
2.2 食管癌组织端粒酶和VEGF蛋白的表达与临床病理特征的关系 食管癌组织端粒酶、VEGF蛋白的表达:(1)在不同性别、年龄及肿瘤的大小差异无统计学意义(P>0.05);(2)与淋巴结转移、临床分期以及肿瘤浸润深度显著相关,差异有统计学意义(P<0.05),见表2。

表2 端粒酶、VEGF的蛋白表达与临床病理参数的关系
2.3 端粒酶、VEGF蛋白表达间的相关性 应用端粒酶相关分析表明,端粒酶与VEGF蛋白表达存在正相关关系,相关系数(r=0.436,P<0.05),见表2。
3 讨 论
端粒酶是一种独特的核糖核蛋白酶,能够以自身为模板合成端粒,维持端粒稳定,阻止细胞凋亡甚至导致肿瘤发生。端粒酶活性使端粒长度保持稳定的状态,使细胞获得无限增殖的能力。它的活性是在染色体末端不断添加端粒DNA重复序列,阻止端粒的丢失,使细胞无限增殖而被永生化,而永生化又被认为是肿瘤恶化的必要步骤,因此,端粒酶在人类细胞永生和致癌过程中起着至关重要的作用[1]。除了少数增殖旺盛的细胞(如生殖细胞、淋巴细胞)有微弱的端粒酶活性外,其他正常细胞和组织无端粒酶活性表达[2]。因此,很多学者认为端粒酶活性是可靠的肿瘤标记物[3]。本研究所取100例食管癌标本中,端粒酶在食管癌中有高表达,正常食管黏膜组织端粒酶活性表达较低,提示其在食管癌的发生、发展过程中起重要作用。与王国磊等[4]报道基本一致。且与癌的浸润深度有一定的相关性,其表达率随浸润程度的增加而增高,从而说明端粒酶与恶性肿瘤有密切关系。本研究发现,端粒酶活性与临床分期、肿瘤浸润深度和淋巴结转移显著相关,说明端粒酶对食管癌发展和预后起重要作用,这与多数文献的报道基本一致[5]。
通过检测肿瘤切缘某些分子标记物可发现局部的隐匿性癌灶,准确判断肿瘤浸润的边界,也就是“肿瘤分子定界”,弥补了传统从细胞形态定界的不足。由于端粒酶的活化,使端粒的长度处于一种失动态平衡,而使细胞获得无限增殖的能力,导致肿瘤的发生。端粒酶在食管癌组织中的高表达,为临床诊断提供了分子学依据,同时也为以端粒酶做靶点的食管癌的基因治疗提供了理论依据。本实验中,有淋巴结转移食管癌组织中阳性率为83.6%(46/55),明显高于无淋巴结转移食管癌组织的57.1%(16/28)。随着肿瘤浸润深度增加,端粒酶阳性率呈升高趋势,可见端粒酶活性检测对食管癌患者的预后判断有一定价值[6]。
VEGF是最重要的血管源性生长因子,它可直接作用于血管内皮细胞,刺激其有丝分裂的发生,从而促进新生血管的生长,并可通过增加血管的通透性,为血管内皮细胞的迁移及肿瘤细胞的转移提供基质。本研究中VEGF的表达量,在正常食管黏膜中明显低于癌组织中,并且在癌组织的表达集中于肿瘤浸润的前缘,说明食管癌的浸润与VEGF的高表达密切相关。进一步分析显示,VEGF的表达量与淋巴结转移浸润有关,有淋巴结转移组的VEGF表达量明显高于无淋巴结转移组,说明VEGF的表达与食管癌的淋巴转移密切相关。且与癌的浸润程度有一定的相关性,其表达率随浸润程度的增加而增高。
新血管形成是保证肿瘤生长和转移的组织学基础,受多种促血管因子和抗血管生成因子的双重调节。VEGF是目前已知作用最强的促血管形成因子之一,也是肿瘤细胞分泌的血管形成因子中最重要的一种,其过度表达与许多恶性肿瘤的不良预后有关。据报道,食管鳞癌阳性率为23.9%~93.3%,本研究为81.0%。VEGF主要表达于癌细胞,具有明显的异质性,强阳性表达的细胞多位于浸润前缘,在血管内皮不表达或极少量表达,与Mbius等[7]的报道相似。推测VEGF主要以旁分泌途径作用于血管内皮细胞。近年研究还发现,VEGF可能与肿瘤淋巴结转移相关[8],有淋巴结转移组的VEGF表达量明显高于无淋巴结转移组。其可能机制为:通过促进新生血管形成而促进肿瘤生长,并使癌细胞通过静脉-淋巴管吻合处从血液进入淋巴管的概率增加;VEGF是高度特异的血管内皮细胞有丝分裂原,是肿瘤新生血管生成的重要调控因子,不仅参与肿瘤血管生成、增殖,还直接与肿瘤浸润转移有关,且其表达水平与肿瘤的恶性程度有关[9]。VEGF与食管鳞状细胞癌的浸润程度、淋巴结转移呈正相关。因此,可以作为判定食管癌生物学行为的检测及预后指标。本研究显示,VEGF在食管癌中的表达与癌旁非典型增生组织及正常食管黏膜组织比较,差异有统计学意义(P<0.05)。提示VEGF可诱导食管癌肿瘤血管形成,提高其通透性,促使肿瘤细胞浸润转移、恶性程度增加。VEGF可直接作用于血管内皮细胞,刺激其有丝分裂的发生,从而促进新生血管的生长,并可通过增加血管的通透性,为血管内皮细胞的迁移及肿瘤细胞的转移提供基质。
端粒酶和VEGF基因蛋白在正常食管黏膜组织中表达均阴性,而在食管癌组织中有不同程度的阳性表达,说明它们都参与了食管癌的发生、发展过程,证明食管癌的发生是多种基因作用的结果。端粒酶和VEGF基因蛋白随病程的进展,其表达量逐渐增加,两者之间有协同作用,它们以不同的机制促进了食管癌的发生、发展、侵袭和转移。它们可作为恶性肿瘤检测的特异性标记物,对食管癌患者进行端粒酶和VEGF的联合检测,可作为食管癌的早期诊断和评估其预后的重要分子生物学指标。判断食管癌的侵袭和转移能力,为术后高危患者制订合理的治疗方案及防止肿瘤的复发和转移提供可靠的依据。
[1]Bellon M,Nicot C.Regulation of telomerase and telomeres:humantumor viruses take control[J].Natl Cancer Inat,2008,100(2):98.
[2]左明,吴俊辉,刘宝善,等.结直肠癌端粒酶活性检测及其对预后判断的意义[J].广东医学,2007,28(8):1252.
[3]付玲,李耀明.不同癌症患者血清胆固醇水平和组织的端粒酶活性分析及临床意义[J].医药论坛杂志,2008,29(14):18.
[4]王国磊,王莉,张瑞祥,等.端粒酶催化亚单位Ex2-659A/G多态性与食管癌易感性的研究[J].中华实用诊断与治疗杂志,2009,23(12):1164.
[5]尹小青,黄立军,黄志中,等.食管癌组织中端粒酶活性检测及其意义[J].现代肿瘤,2009,17(6):1070.
[6]Pagano B,Giancola C.Energetics of quadruplex-drug recognition in anticancer therapy[J].Curr Cancer Drug Targets,2007 ,7(6):520.
[7]Mbius C ,Freire J,Becker I,et al.VEGF-C expression in squamous cell carcinoma and adenocarcinoma of the esophagus[J].World J Surg,2007 ,31(9):1768.
[8]Matsumoto M ,Natsugoe S,Okumura H,et al.Over expression ofvascular endothelial grow th factor-C correlateswith lymph nodemi-crometastasis in submucosal esophageal cancer[J].J Gastrointest Surg,2006,10(7):1016.
[9]罗君.血管内皮生长因子与胃癌的研究进展[J].重庆医学,2007,36(7):663.

