bFGF单克隆抗体抑制小鼠Lewis肺癌转移及血管新生
向军俭 李丹,2 王宏 王盼盼 邓宁
1.暨南大学生命科学技术学院抗体工程中心,广东 广州 510632;2.南方医科大学基础医学院免疫学教研室,广东 广州 510515
肺癌的发病率和死亡率在中国乃至世界许多国家居于首位,其高转移率及对放化疗药物的耐药是肺癌患者死亡的重要原因[1]。目前传统的治疗方法主要针对早期肺癌患者,对于晚期患者则疗效不佳。因此近年来新的治疗手段,尤其是靶向治疗备受关注[2]。碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)是一种较强的促有丝分裂原,在多种肿瘤中表达升高,并参与肿瘤发生、发展进程[3]。bFGF不仅可刺激肿瘤细胞的增殖,它作为一种重要的促血管新生因子,还可促进血管内皮细胞的增殖、黏附、迁移及新血管形成[4]。肿瘤的新生血管不仅为肿瘤组织的生长提供养分,更是肿瘤发生转移的基础[5]。因此本研究旨在通过建立Lewis肺癌转移模型,以bFGF为靶点检测抗bFGF抗体对肺癌生长,转移及血管新生的抑制作用,为肺癌的治疗提供一种新手段。
1 材料和方法
1.1 材料 人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)由中山大学中山医学院高国全教授馈赠。雌性C57 BL/6小鼠24只,6周龄,体质量(20±2)g,购自广州南方医科大学实验动物中心。Lewis肺癌细胞株引自美国标准菌种收藏所(ATCC),由本室保存。bFGF单抗细胞株MabF7为本室制备、纯化、保存。M199细胞培养基,SFM无血清培养基,低血清生长添加剂 (low serum growth supplement,LSGS)均购自Invitrogen公司。CCK-8试剂盒为日本同仁化学研究所产品。兔抗鼠/人CD31抗体(工作浓度为1∶1 000)及羊抗兔免疫组化试剂盒购自Santa Cruz公司。DAB显色底物购自北京天根科技生化有限公司。
1.2 HUVECs增殖抑制试验 取2~7代对数生长期的HUVECs细胞,调整细胞浓度至3×104个/mL,每孔100 μL接种到96孔细胞培养板中,37 ℃培养24 h后,将培养基换为含0.5%FBS,10 ng/mL bFGF的M199培养基,同时加入不同浓度的MabF7,对照组加入相同浓度的正常小鼠IgG,37 ℃培养3 d后,利用CCK-8试剂盒测定活细胞数量。
1.3 Lewis肺癌自发转移模型的建立 取对数生长期的Lewis肺癌细胞,采用0.25%胰酶消化,收集细胞并计数,将细胞浓度调整至2.5×106个/mL,于C57小鼠右前肢靠背部皮肤松软处接种0.2 mL。待可触及到肿瘤时,将小鼠随机分为PBS组,bFGF单抗MabF7治疗组(5 mg/mL),以及非免疫小鼠IgG阴性对照组(5 mg/mL),每组8只。抗体采用瘤周皮下注射的方式给药,每只小鼠注射0.2 mL,每3天注射1次,连续6次。
1.4 肿瘤生长曲线的绘制及肺转移的评价利用游标卡尺测量荷瘤的长和宽,利用公式:V(mm3)=π×长×宽×宽×1000/6,计算瘤体积,并绘制曲线;同时测量小鼠体质量;给药6次后眼球放血处死小鼠,取瘤、称质量。抑瘤率=(1-给药组平均瘤质量/PBS对照组平均瘤质量)×100%。完整取出双肺并于解剖镜下计数肺表面转移瘤结节数。瘤组织及肺组织以中性福尔马林固定,常规脱水,石蜡包埋后切片,肺组织进行常规HE染色,光镜下观察。
1.5 瘤组织微血管密度计数 石蜡切片常规脱蜡至水,3%双氧水阻断内源性过氧化物酶5 min;将切片放PH为6.0的柠檬酸缓冲液中,微波炉以中火修复6 min×4;封闭,37 ℃, 1 h;兔抗鼠/人CD31抗体做1∶1 000稀释,4 ℃,过夜;后续步骤按试剂盒说明操作,DAB显色,苏木精复染,中性树胶封片。显微镜下观察并拍照。对于MVD的计数原则是:按Weidner报道的方法[6],首先在低倍视野下(100倍)扫视整张石蜡切片,每张切片找出5个微血管密集区,然后在高倍视野下(400倍)计数。每张切片共计数5个视野。微血管的判断标准为:⑴与邻近的微血管、肿瘤细胞及其他结缔组织成分不相连、标记清晰的内皮细胞及内皮细胞簇均可作为一个可计数的微血管。⑵可能源于同一微血管的内皮细胞,如染色清晰且相互分离,也可作为单独的微血管计数。⑶血管腔及腔内红细胞的存在不是确认微血管的必备条件。⑷对肿瘤区内的硬化区、肿瘤细胞稀疏区及邻近良性组织区域内的血管不进行计数。
1.6 统计处理 采用SPSS 9.0软件。组间差异采用配对t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 bFGF单抗MabF7对bFGF诱导的HUVECs增殖的影响 MabF7属于IgG1亚类,不与aFGF发生交叉反应。MabF7可以剂量依赖的方式抑制bFGF诱导的HUVECs的增殖,IC50为50 μg/mL(图1)。
2.2 bFGF单抗MabF7对Lewis肺癌生长的抑制 接种后第9天小鼠成瘤率为100%,小鼠随机分为3组,并开始给药。MabF7治疗组肿瘤生长速度自第4次给药开始较PBS组减慢,IgG对照组与PBS组相比,则差异无统计学意义(图2A)。给药6次后MabF7治疗组瘤质量为(2.6±1.0)g,显著低于PBS组的(5.1±1.3)g(P<0.05),抑瘤率为48.23%。IgG对照组瘤质量为(4.7±0.4)g,与PBS组相比差异无统计学意义(P>0.05),抑瘤率为8.43 %(图2B)。
2.3 bFGF单抗MabF7对Lewis肺癌转移的抑制 本小鼠模型中Lewis肺癌发生转移的部位主要为肺,转移率超过80%。给药6次后处死小鼠,取完整肺组织于解剖镜下计数肺表面转移瘤结节数。并对双肺进行HE染色,确定此结节为转移的Lewis肺癌(图3A)。bFGF单抗MabF7组与PBS组相比肺转移瘤结节数明显降低,差异有统计学意义(P<0.01,表1),抑制率为75.59%。对照IgG组与PBS组相比差异无统计学意义(P>0.05),抑制率为3.99%(表1)。
2.4 bFGF单抗MabF7对瘤组织MVD的影响以兔抗鼠/人CD31多抗为一抗,对肿瘤组织切片进行免疫组化染色,400倍显微镜下计数肿瘤组织实质区的MVD(图3B),bFGF单抗MabF7组MVD为22.0±2.9,显著低于PBS组的43.5±11.6(P<0.05);对照IgG组MVD为45.8±5.4,与PBS组相比差异无统计学意义(P>0.05)。

图1 bFGF单抗MabF7抑制bFGF诱导的HUVECs的增殖Fig.1 Inhibition of HUVECs proliferation by injecting MabF7
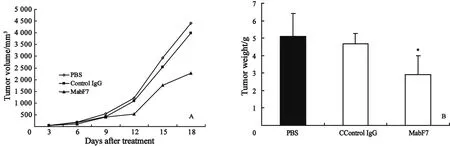
图2 bFGF单抗MabF7对Lewis肺癌生长的抑制Fig.2 Inhibition of LLC tumor growth by injecting MabF7

图3 bFGF单抗MabF7对Lewis肺癌转移及肿瘤组织MVD的抑制Fig.3 Inhibition of LLC metastasis and MVD in tumor tissue by injecting MabF7

表1 bFGF单抗MabF7对Lewis肺癌转移的抑制Tab.1 Inhibition of LLC metastasis by injecting MabF7
3 讨 论
肺癌的高转移率及对药物的耐药性是造成其高死亡率的重要原因。bFGF是成纤维生长因子家族中的一员,作为一种较强的有丝分裂原,在肺癌等多种肿瘤组织中高表达。有研究表明50%以上的非小细胞肺癌患者组织出现bFGF表达升高,且与淋巴结转移及分期相关,其在伴有淋巴结转移及中晚期肺癌组织中的表达明显高于早期[7-8]。大多数学者认为患者血清中bFGF的水平可作为肺癌早期诊断及预后的标志[9]。另外多种体外研究也证实bFGF不仅促进肺癌细胞的增殖,还是肺癌细胞对化疗耐药的重要原因之一。bFGF与肿瘤细胞的表面高亲和力受体FGFRs结合,使后者通过二聚化而活化,活化的受体可激活下游MEK、PKC、PI3K等信号通路,从而促进细胞的增殖及逃避凋亡[10-11]。因此bFGF可能成为肺癌治疗的良好靶点。很多研究也表明抑制bFGF及其受体的表达可显著地抑制肺癌的生长[12]。
近年来随着生物学及医药技术的发展,抗体药物因其靶向性好、特异性高、疗效好、毒性低而成为现代生物制药的核心。bFGF抗体也被许多学者用于不同肿瘤治疗的研究[13-14]。MabF7是本室以人重组bFGF免疫小鼠,通过传统杂交瘤技术获得的能够阻断bFGF生物学活性的单克隆抗体,前期工作显示此单抗可在体内外抑制黑色素瘤细胞的生长,并能提高黑色素瘤对化疗药物的敏感性[15-16]。本研究首先通过血管内皮细胞增殖抑制实验证实MabF7可抑制外源性bFGF,刺激HUVECs增殖的活性,证明MabF7为特异性针对bFGF的中和性单抗。接下来以Lewis肺癌细胞建立C57 BL/6小鼠自发性肺癌转移模型。Lewis肺癌可高表达bFGF,并且bFGF的表达量与沙利度胺、魟鱼软骨多糖等药物抑制肺癌生长及转移密切相关[17-18]。本研究以此为模型发现bFGF单抗MabF7可显著抑制肿瘤的生长及向肺组织的转移。
肿瘤的增殖、转移及耐药性的产生都依赖于肿瘤血管新生。血管新生过程包括细胞外基质的降解,内皮细胞迁移、黏附、内皮细胞增殖、管腔的形成、细胞基质的沉积和血管成熟等过程。此过程由一系列的促血管新生因子及抗血管新生因子所调控,其中bFGF和VEGF就是重要的促血管新生因子[4-5]。bFGF不仅可促进血管内皮细胞的增殖,还可调节细胞外基质和基质金属蛋白酶MMPs的表达,从而影响血管内皮细胞的黏附迁移及成管过程。除此之外bFGF还与VEGF、PDGF等细胞因子相互协同,组成血管新生的调节网络[19-20]。肿瘤内的新生血管由于其较低的成熟度和较高的渗透性,成为肿瘤细胞向其他器官发生转移的物质基础,因此抑制肿瘤血管新生的过程可有效地阻止肿瘤转移。本研究发现bFGF单抗MabF7可显著地抑制Lewis肺癌组织的微血管密度,这可能是MabF7有效抑制肺癌转移的主要原因之一。
综上所述,bFGF单抗可通过控制肺癌细胞的增殖及血管新生等途径对Lewis肺癌的生长及转移起到抑制作用。其具体的作用机制及与化疗药物的联合作用还需进一步研究。
[1] 毛友生, 高燕宁, 赫捷, 等. 肺癌分子生物学特性与转移和预后的关系[J]. 中华肿瘤杂志, 2006, 28(8): 632-634.
[2] 操乐杰. 血管生成抑制剂治疗肺癌进展[J].世界临床药物, 2004, 25(5): 288-296.
[3] Bikfalvi A, Klein S, Pintucci G, et al. Biological roles of fibroblast growth factor-2 [J]. Endocr Rev, 1997, 18(1):26-45.
[4] Presta M, Dell’Era P, Mitola S, et al. Fibroblast growth factor/fibroblast growth factor receptor system in angiogenesis [J].Cytokine Growth Factor Rev, 2005, 16(2): 159-178.
[5] Cox G, Jones JL, Walker RA, et al. Angiogenesis and nonsmall cell lung cancer [J]. Lung Cancer, 2000, 27(2): 81-100.
[6] Weidner N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors[J]. Breast Cancer Res Treat, 1995,36(2): 169-180.
[7] 夏钰弘, 杨国仪, 洪建刚, 等. IGFBP-3、bFGF、Ki-67蛋白在非小细胞肺癌组织中的表达及意义[J]. 江苏医药,2009, 35(1): 41-43.
[8] 高双荣, 钟雪云, 向军俭. LN,FN,bFGF及EGFR与肺癌转移[J]. 广东医学, 2002, 23(9): 909-911.
[9] Joensuu H, Anttonen A, Eriksson M, et al. Soluble syndecan-1 and serum basic fibroblast growth factor are new prognostic factors in lung cancer [J]. Cancer Res, 2002, 62(18): 5210-5217.
[10] Kuhn H, Köpff C, Konrad J, et al. Influence of basic fibroblast growth factor on the proliferation of non-small cell lung cancer cell lines [J]. Lung Cancer, 2004, 44(22): 167-174.
[11] Pardo OE, Wellbrock C, Khanzada UK, et al. FGF-2 protects small cell lung cancer cells from apoptosis through a complex involving PKCε, B-Raf and S6K2 [J]. EMBO J, 2006,25(13): 3078-3088.
[12] Pardo OE, Latigo J, Jeffery RE, et al. The fibroblast growth factor receptor inhibitor PD173074 blocks small cell lung cancer growth in vitro and in vivo [J]. Cancer Res, 2009,69(22): 8645-8651.
[13] Hori A, Sasada R, Matsutani E, et al. Suppression of solid tumor growth by immunoneutralizing monoclonal antibody against human basic fibroblast growth factor [J]. Cancer Res, 1991, 51(22): 6180-6184.
[14] Rofstad EK, Halsor EF. Vascular endothelial growth factor,interleukin 8, platelet-derived endothelial cell growth factor,and basic fibroblast growth factor promote angiogenesis and metastasis in human melanoma xenografts [J]. Cancer Res,2000, 60(17): 4932-4938.
[15] 向军俭, 靳英杰, 黄红亮, 等. 人bFGF单克隆抗体的制备及MabF7对黑色素瘤B16的体外抗瘤效应[J]. 中华肿瘤防治杂志, 2008, 15(1): 19-22.
[16] 刘李登, 王宏, 向军俭, 等. bFGF单抗与顺铂体外联合抑制黑色素瘤B16细胞增殖效应的研究[J]. 中华肿瘤防治杂志, 2010, 17(1): 1-4.
[17] 王革芳, 王杰军, 高勇, 等. 反应停调控Lewis肺癌表达bFGF和MMP-2[J]. 肿瘤, 2003, 23(5): 393-395.
[18] 高斌, 袁戈. 魟鱼软骨多糖对小鼠Lewis肺癌的作用及分子机制探讨[J]. 辽宁中医杂志, 2007, 34(1): 110-112.
[19] Kuhn H, Konrad J, Holtz S, et al. Enhanced expression of VEGF following bFGF inhibition in non small cell lung cancer cell lines [J]. Lung Cancer, 2006, 54(2): 149-153.
[20] Giavazzi R, Senninno B, Coltrini D, et al. Distinct role of fibroblast growth factor 2 and vascular endothelial growth factor on tumor growth and angiogenesis [J]. Am J Pathol,2003, 162(6): 1913-1926.

