肝素化牛心包膜对VEGF165控释的体外研究
魏屹晗 胡帼颖 刘 欣 罗 涛 晏飞燕 顾汉卿,*
1(天津医科大学生物医学工程学院,天津 300070)
2(天津市泌尿外科研究所,天津 300211)
3(中国人民解放军第254医院,天津 300142)
引言
小口径人工血管一直未获得满意效果,常因移植后血管内壁难以快速自发地形成功能性内膜,即内皮细胞(endothelial cells,ECs)层,往往发生血栓或内膜增生,导致人工血管闭塞。ECs具有抗凝、调节血管张力、识别各种理化信号、调控细胞增殖等重要功能,因此如何提高ECs在人工血管内壁粘附并生长是解决移植后血管通畅率的关键问题。虽然已有大量组织工程化血管的相关研究,即植入前在体外向材料内壁种植内皮细胞以实现内皮化,但是构建组织工程化血管所需时间长,增大了细菌感染风险,而且价格昂贵,临床应用可行性受限。
材料表面结合生长因子能够显著改善人工血管的内皮化进程。生长因子是具有诱导和刺激细胞增殖、维持细胞存活等生物效应的蛋白类物质。血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)是对血管生长有诱导作用的众多生长因子中唯一特异作用于ECs的因子,是特异性的ECs促有丝分裂剂,具有强烈促血管内皮增殖作用[1-3],可促进血管生成和诱导血管通透性增加。但是,VEGF在血液循环中的半衰期很短,仅为数十分钟,难以长久发挥促ECs增殖作用,因此,设计出生长因子的持续释放系统是延长生长因子作用时间的关键。
本研究采用新鲜牛心包膜作为基底材料,由于它富含Ⅰ型胶原,广泛应用于各种先天性和后天性心脏、大血管疾病的手术治疗,效果良好,是一种优良的心血管修补、重建材料[4],而且牛心包来源丰富、取材便捷、价格低廉。通过对牛心包表面肝素化修饰以提高它对生长因子的亲和力,进而构建出一种生长因子的缓释系统。材料表面肝素化的方法主要包括离子结合和共价键合[5-6]。离子结合方式可最大限度保持肝素活性,但是肝素结合不稳定;而共价键合将肝素多点牢固地键合在材料表面,但降低了其生物活性。因此,本研究采用共价键合、离子结合以及共价-离子联合作用对碳化二亚胺(N-(3-dimethylaminopropyl)-N'-ethylcarbodiimide hydrochloride,EDC)交联的脱细胞牛心包膜进行表面肝素化改性,并研究它们对VEGF165结合及体外控释的影响,旨在发挥两种结合方式的长处,克服生物反应器体外构建细胞—材料复合体时间周期过长的缺陷,以期在临床急症中简单、快捷、有效地解决小口径血管病损问题。
1 材料与方法
1.1 牛心包膜的前期处理
首先对新鲜牛心包膜(广东冠昊生物科技有限公司免费提供)采用本实验室已成熟的脱细胞方法—反复冻融+TritonX-100联合作用进行脱细胞处理:新鲜牛心包 PBS液浸泡,-80℃,4 h,37℃水浴0.5 h,反复冻融3次;PBS充分漂洗;0.25%TritonX-100和0.25%脱氧胆酸钠的PBS液37℃震荡24 h;PBS充分漂洗。HE染色显示清除细胞彻底,细胞外基质保存完整。利用EDC—N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)对脱细胞牛心包膜进行化学交联[7]。将1 g干重脱细胞基质浸入0.05 M MES缓冲液(pH=5.40)预置>0.5 h,取出置入含有 1.731 g EDC、0.431 g NHS的 215 mL 0.05M MES溶液中,轻微震荡,室温反应4 h。将此基质在0.1 M Na2HPO4中清洗2 h,蒸馏水清洗2 h,冷冻干燥后室温保存待用。
1.2 牛心包膜表面肝素化
1.2.1 共价键合肝素
采用Wissink等方法[7],将1 g干重已交联基质浸入0.05 M MES缓冲液(pH=5.60)预置>0.5 h,按照EDC:NHS:Hep(购自北京百灵威化学技术有限公司)摩尔比=7.5∶12.5∶1,将 EDC和 NHS溶于188.3 mL含有2%(W/V)Hep的0.05M MES缓冲液中作用10 min,然后将预置好的基质放入此溶液,轻微震荡,室温反应24 h。基质在0.1 M Na2HPO4溶液中清洗2 h,4 M NaCl溶液中清洗24 h(每6 h更换一次NaCl溶液),蒸馏水清洗24 h(每6 h更换一次蒸馏水),冷冻干燥后室温保存待用。下文将该组简称为EDC-Hep组。
1.2.2 离子结合肝素
采用相对分子质量1800 D的聚乙烯亚胺(polyethylenimine,PEI)作为阳离子剂(购自北京百灵威化学技术有限公司)。根据毛峥伟等的方法[8],将已交联基质(1 cm ×1 cm)浸入2 mL含1 mg/mL PEI的0.15 M NaCl水溶液中作用0.5 h,PBS冲洗3遍,再放入2 mL含0.5 mg/mlHep-PBS溶液中作用0.5 h,PBS冲洗3遍;将上述PEI与肝素交替处理及冲洗过程反复15次,层层叠加结合Hep。下文将该组简称为PEI1800-Hep×15组。
1.2.3 共价-离子联合结合肝素
将上述共价键合肝素法和离子结合肝素法联合使用,即对已交联基质先进行EDC共价键合肝素处理,而后在此基础上再进行离子结合肝素实验。下文将该组简称为EDC-PEI1800-Hep×15组。
1.3 考察肝素化基质表面亲疏水性能
采用JC2000C1接触角测量仪,考察无重力影响下,1 mm直径蒸馏水与基质表面接触情况,从而表征基质表面的亲疏水性,每份样品平行测定3次。
1.4 肝素化基质对生长因子VEGF165控释实验
1.4.1 VEGF165的放射标记
由中国医学科学院放射医学研究所标记,用氯胺-T法对VEGF165(江苏思坦维生物技术有限公司提供)进行放射性Na125I标记,SephadexG-25柱进行纯化。比放射性为 7.02 mci/mg,放化纯度约为99%。
1.4.2125I-VEGF165与基质结合
1.4.2.1125I-VEGF165与交联空白组结合
配制结合液:125I-VEGF165溶于 PBS(PH7.2)溶液中,125I-VEGF165浓度为 1000 ng/mL,4℃ 分装保存。
将交联空白组基质浸泡到1 mL结合液中,4℃孵育过夜,室温下PBS漂洗2次,每次10 min,以洗去未结合的125I-VEGF165,在放射性免疫伽马计数器上测定各支架的放射性强度,从而考察基质125IVEGF165的结合情况。
1.4.2.2125I-VEGF165与EDC-Hep组结合
过程同交联空白组。
1.4.2.3125I-VEGF165与 PEI1800-Hep×15组结合
过程同1.2.2,区别在于0.5 mg/mL肝素PBS溶液更换为含有1000 ng/mL125I-VEGF165的0.5 mg/mL肝素PBS溶液。15层处理完毕后,室温下PBS漂洗2次,每次10 min,以洗去未结合的125IVEGF165,在放射性免疫伽马计数器上测定各支架的放射性强度,从而考察基质125I-VEGF165的结合情况。
1.4.2.4125I-VEGF165与 EDC-PEI1800-Hep×15组结合
处理过程:基质表面EDC共价键合Hep(过程同1.2.1)→125I-VEGF165与EDC-Hep基质结合(过程同1.4.2.1)→基质表面 PEI1800离子结合Hep-125I-VEGF165(同1.4.2.3)。处理完毕后,室温下PBS漂洗2次,每次10 min,以洗去未结合的125IVEGF165,在放射性免疫伽马计数器上测定各支架的放射性强度,从而考察基质125I-VEGF165的结合情况。
1.4.3125I-VEGF165体外释放实验
释放液使用内皮细胞培养基,包含M199培养液、胎牛血清、双抗、谷氨酰胺。将交联空白组,EDC-Hep-125I-VEGF165组,PEI1800-Hep×15-125IVEGF165组、EDC-PEI1800-Hep×15-125I-VEGF165组的各组基质分别放入1 mL释放液中,置于37℃恒温水浴箱。观察30 d释放液中的释放强度,前4 d每天一次,以后2 d一次,每次测定后换上新鲜释放液。在放射性免疫伽马计数器上测定各释放液的放射性强度,从而考察125I-VEGF165的释放情况。
1.5 负载VEGF165的肝素化基质对ECs生长及贴附率的影响
1.5.1 人脐静脉ECs的培养
参照王若光等的方法[9],取医大二院妇产科正常足月新生儿新鲜脐带,长约15 cm,以生理盐水反复冲洗脐静脉,37℃预温的0.1%Ⅱ型胶原酶(Gibco公司)PBS溶液插管消化,获得人脐静脉内皮细 胞 (human umbilical vein endothelial cells,HUVECs)。常规培养达平台期后,按1∶2传代,达到足够数量后制成悬液备用。
1.5.2 HUVECs在基质上的增殖实验
实验分组同 VEGF165控释实验。各组基质(1 cm×1 cm)经16KGy60Coγ射线辐照灭菌,干态保存。
干态基质置入M199培养基(不含VEGF165)孵育2 h成湿态。向每片基质加入1 mL 2×104/mL的HUVECs悬浮液,37℃ 5%CO2孵箱中培养。分别在1、2、4、6 d时间点,对各组基质片上的细胞用血细胞计数板进行计数。
2 结果
2.1 基质表面亲疏水性能表征
检测发现,由于材料是生物膜,所有组别具有高亲水性,与水滴接触后短时间内或是瞬间水滴即被吸收,无法有效测量接触角,可通过考察水滴吸收速度,探究各组间基质表面亲疏水性能差异。按照水滴吸收速度分级(见图1):1级,瞬间吸收(1 s内完成);2级,匀速吸收(3~5 s内匀速完成)。
由表1可知,肝素化前后的交联基质均具有较好的亲水性能,但肝素化方式的不同会影响材料表面的亲疏水性。EDC共价键合肝素的方法提高了交联基质的亲水性;PEI离子结合肝素以及共价-离子联合结合肝素作用后,两组基质的亲水性与交联空白组均无显著差异。
2.2 肝素化基质与VEGF165结合量测定
交联空白与肝素化基质各组对125I-VEGF165结合率比较结果如图2所示。
图2表明,共价-离子联合肝素化VEGF165的结合最高,为 5.4% ±0.3%,其次是离子肝素化VEGF165结合 3.3% ±0.2%,共价键合肝素化VEGF165结合为2.8% ±0.2%,而未肝素化基质与VEGF165结合最低,为1.6% ±0.1%,说明肝素化能够显著提高基质对VEGF165的结合能力(P<0.01);共价-离子联合肝素化VEGF165的结合最多,与两种单独肝素化方式VEGF165的结合相比具有统计学意义(P<0.01)。

图1 水滴接触牛心包瞬间抓拍图像。(a)1级瞬间吸收(1 s内完成);(b)2级匀速吸收(3~5 s内匀速完成)Fig.1 Photographs of the droplets'status right after they contact the substrates.(a)Grade 1(absorption was happened within 1 s);(b)Grade 2(Absorption was happened within 3~5 s)

表1 交联空白与肝素化基质各组表面亲疏水性能比较Tab.1 Grades of the hydrophilicity of the substrates
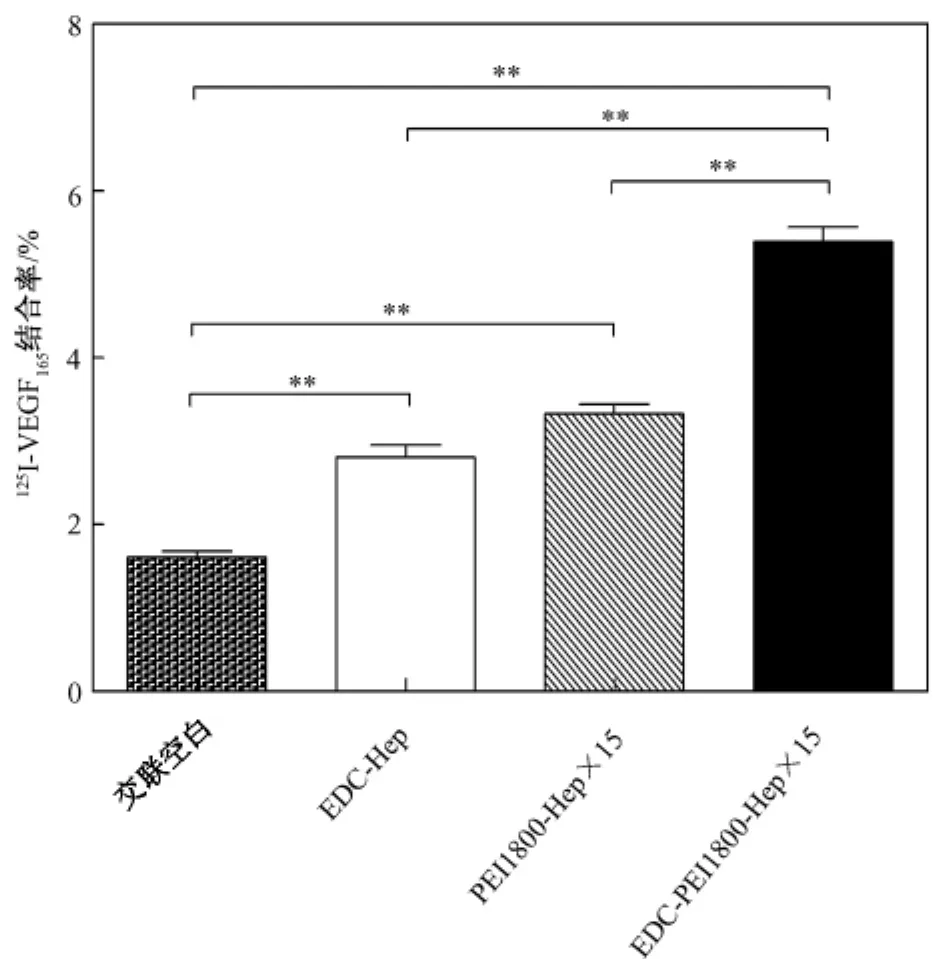
图2 交联空白与肝素化基质各组对125 I-VEGF165结合率比较.**P<0.01Fig.2 Binding rate of 125 I-VEGF165 on(heparinized)substrates.**P<0.01
2.3 肝素化基质对VEGF165的体外控释检测
VEGF165体外释放过程进行了30 d的观察,释放液使用含血清的内皮细胞培养液,并在37℃条件下进行以接近生理环境。交联空白与肝素化基质各组125I-VEGF165日释放率及累积释放率如图3和图4所示。
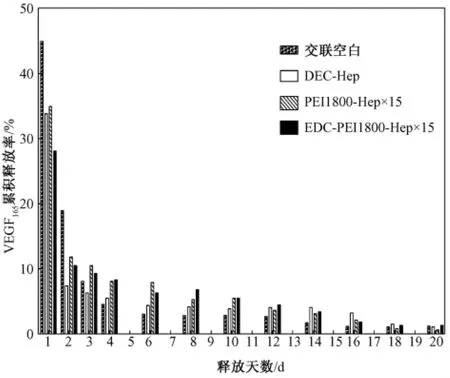
图3 空白与肝素化基质各组125 I-VEGF165日释放率Fig.3 Daily release rate of 125 I-VEGF165 on(heparinized)substrates
由图3和图4可知,各组在第1 d均出现爆发释放现象,可能是由于未结合的VEGF165洗脱不彻底造成的。后续观察发现交联空白组的确为爆发型释放,前3 d累计释放已达72%;EDC-Hep组呈相对缓慢型释放,日释放率从第2 d的7.4%下降至第16 d的4.1%,16 d时累积释放77%;PEI1800-Hep×15组与 EDC-PEI1800-Hep×15组释放趋势相似,介于空白组爆发型释放和EDC-Hep组缓慢型释放之间,PEI1800-Hep×15组日释放率从第 2 d的11.8%下降至第16 d的2.4%,16 d时累积释放92.8%,EDC-PEI1800-Hep×15组日释放率从第2 d的10.5%下降至第16 d的2.3%,16 d时累积释放84.5%。
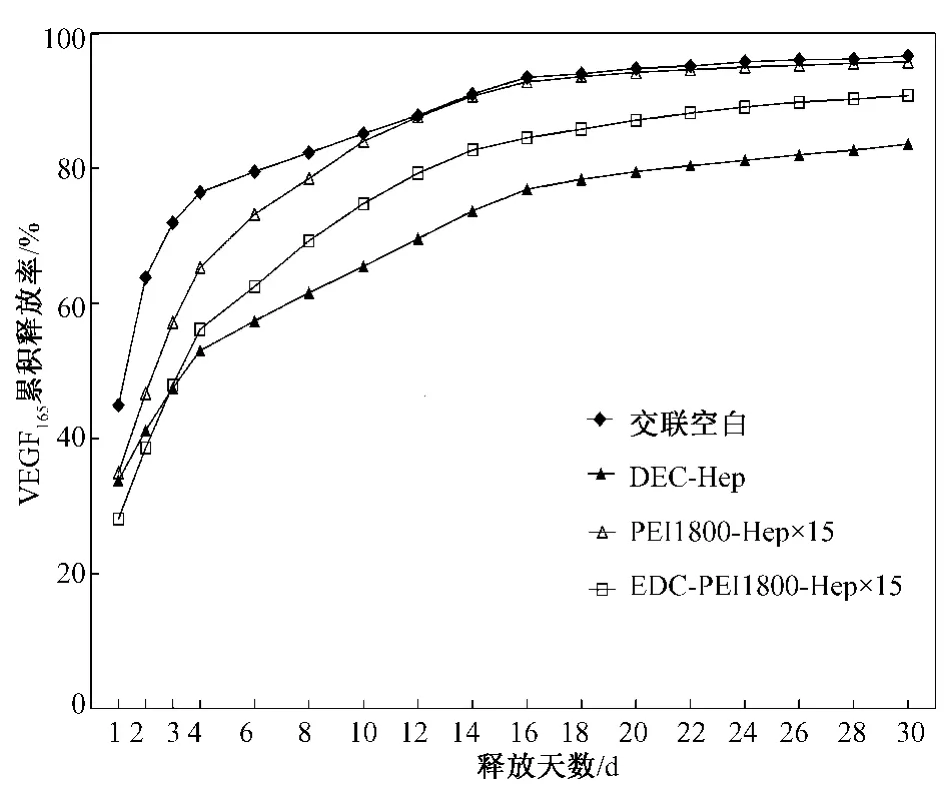
图4 空白与肝素化基质各组125 I-VEGF165累积释放率Fig.4 Accumulate release rate of 125 I-VEGF165 on(heparinized)substrates
2.4 HUVECs在基质上的黏附情况
HUVECs种植于各基质组24 h后,黏附率如图5所示。
以2×104/mL细胞密度接种,倒置显微镜下观察,基质不透光,基质边缘可见HUVECs,接种后4 h见经胰酶消化后呈圆形的部分细胞逐渐贴壁伸展,表明内皮细胞已存活生长。接种后24 h,交联空白组粘附率约50%,而EDC-Hep-VEGF165组、PEI1800-Hep×15-VEGF165组和 EDC-PEI1800-Hep×15-VEGF165组的粘附率分别约为25%、38%和50%,说明基质表面改性会影响细胞粘附,而EDC-PEI1800-Hep×15-VEGF165共价-离子结合肝素负载VEGF165细胞粘附效果最好。
2.5 HUVECs在基质上的增殖情况
细胞接种后1周内,HUVECs在各组基质上的增殖情况如图6所示。
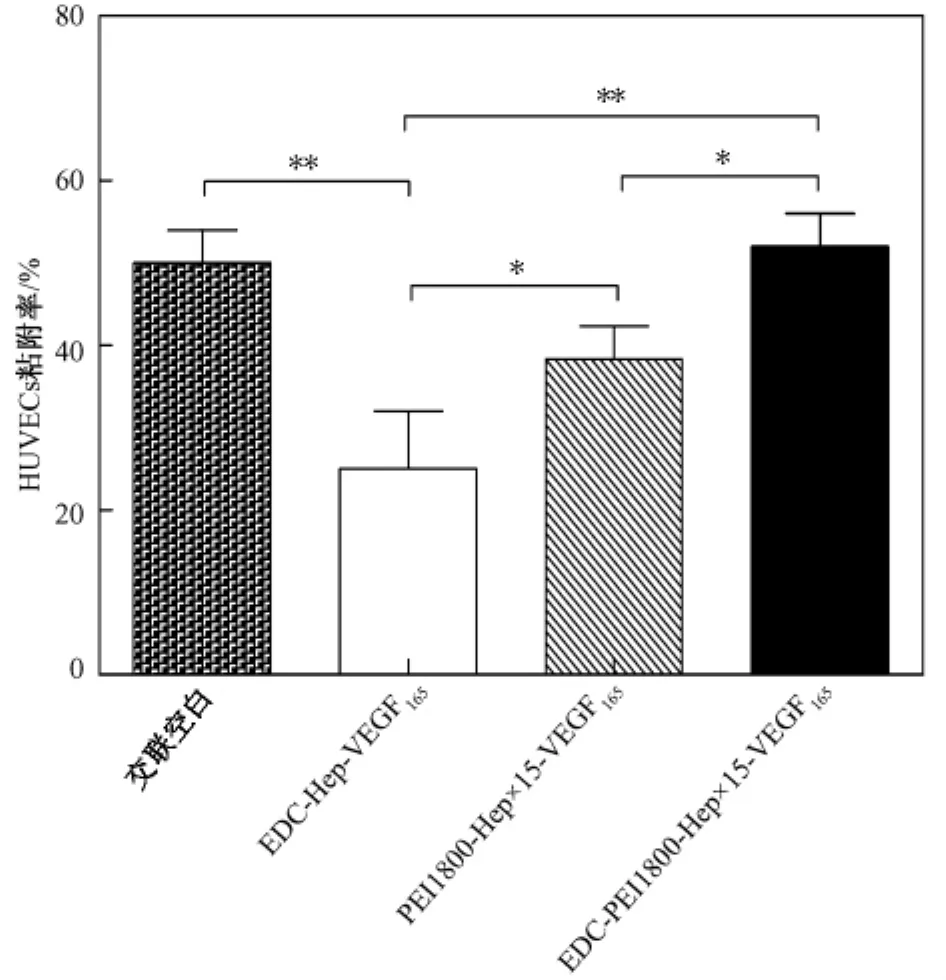
图5 HUVECs种植于基质24 h后黏附率比较.*P<0.05,**P<0.01Fig.5 Adhesive rate of HUVECs after seeding for 24 h.*P<0.05,**P<0.01
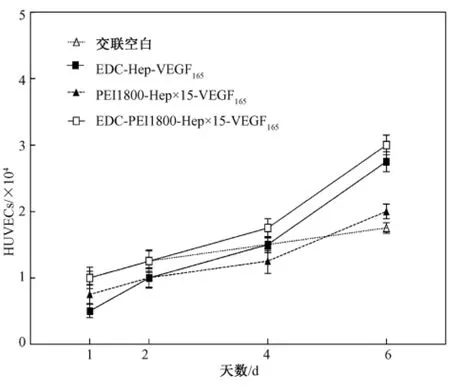
图6 HUVECs种植于基质后增殖情况比较Fig.6 Proliferation of ECs on substrates
接种后48 h,各组细胞形态良好,增殖不明显;接种后4 d,各组细胞形态良好,增殖缓慢,表现出生长潜伏期;接种后6 d,各组均出现明显的细胞增殖现象,表现出指数生长期。其中EDC-Hep-VEGF165组和EDC-PEI1800-Hep×15-VEGF165组细胞增殖最为显著。从这几个时间点(1、2、4、6 d)细胞增殖趋势来看,无VEGF165的交联空白组在初期黏附率很高的情况下,细胞增殖非常缓慢;EDC-Hep-VEGF165组初期粘附率低,即起点低,但细胞增殖较快;PEI1800-Hep×15-VEGF165组黏附率稍高于前者,但细胞增殖缓慢。EDC-PEI1800-Hep×15-VEGF165共价-离子结合肝素负载VEGF165的细胞黏附附率最好,而且细胞增殖速度最快,说明该组促细胞增殖能力最强。
3 讨论
生长因子与肝素之间可通过特定的离子键作用结合,肝素分子上的 2-O-硫酸基和 N-硫酸基[10-11]与生长因子上的精氨酸和赖氨酸侧链基团[12-13]结合。因此,对材料表面的肝素化可显著改善基质对生长因子的结合及控释能力。目前此类研究中使用的材料肝素化方法包括离子结合肝素及共价键合肝素。
离子结合是指先将带有大量正电荷的阳离子物质涂抹材料表面,通过正、负电荷的相互作用将带有-OSO3-和-COO-等负电荷的肝素固定在材料的内表面上。离子结合方式能够维持肝素的天然构象,可以最大限度保持肝素活性。毛峥伟等利用PEI与肝素的正负电荷吸引作用[8],将肝素-酸性成纤维细胞生长因子(aFGF)混合物以层层叠加自组装的方式结合到基质表面,通过结合层数的增加显著提高了aFGF结合量。
共价键合是指通过化学方法,利用肝素分子-OH和-NH-上的活泼氢与基底材料之间形成共价键,将肝素分子牢固地结合在材料表面,这种结合远较离子结合稳定。Wissink等采用EDC在胶原基质表面共价键合肝素[7],未肝素化的胶原基质碱性成纤维细胞生长因子(bFGF)结合率为10%,肝素化后bFGF结合率达到了22%,这种结合bFGF的肝素化胶原膜可以促进HUVECs的粘附与增殖。Yao等同样是利用EDC共价键合肝素并负载VEGF对胶原进行改性[14],发现肝素化材料组的血管化进程显著高于未肝素化材料。
然而,离子和共价的结合方式均有其不足之处。离子结合肝素不稳定,容易解离被其它负离子置换;而共价键合改变了肝素的正常构象,因而降低了其生物活性。本研究在上述2种肝素化方式的基础上,考察比较了这2种方式以及联合肝素化方式的优劣,分组为:EDC共价键合肝素组、PEI离子结合肝素组以及EDC-PEI共价-离子联合肝素化组,同时以脱细胞交联处理的牛心包膜作为交联空白组。通过考察各组对VEGF165的结合及控释能力,以及结合VEGF165的基质对ECs粘附增殖的影响,筛选出具有最佳VEGF165控释能力的肝素化方式。
在肝素化基质与VEGF165结合量测试中,首先采用125I放射标记VEGF165,这种技术比较成熟,标记蛋白具有很高的稳定性,125I主要标记在因子的酪氨酸残基上,不易引起碘脱落,而且该方法灵敏度高,测得的因子可精确到pg级,并且可忽略碘脱落造成的实验误差。VEGF165结合实验结果表明肝素化能够显著提高基质对VEGF165的结合能力,此外共价-离子联合肝素化VEGF165的结合量最高,约为共价、离子单独肝素化VEGF165结合量之和,反映出联合肝素化结合VEGF165处理方式为共价、离子两种单独结合方式的叠加。
Wissink等对结合bFGF基质进行了10 d的体外释放实验,结果显示,初期6 h bFGF释放率,未结合肝素组为30%,结合肝素组为2%,10 d后两组对bFGF释放率分别为83%和42%,表明肝素化处理显著提高了材料对生长因子的控释能力[15]。这种缓释作用在本实验中也得到了验证。经过30 d的体外观察,发现交联空白组对VEGF165呈爆发型释放,说明结合力很弱;EDC共价键合肝素对VEGF165呈缓慢释放模式;而 PEI1800-Hep×15组与 EDCPEI1800-Hep×15组释放趋势相似,介于空白组爆发型释放和 EDC-Hep组缓慢型释放之间,其中PEI1800-Hep×15组释放更快些,16 d 累积释放92.8%,EDC-PEI1800-Hep×15组 16 天累积释放84.5%,反映出 PEI1800-Hep×15组结合VEGF165的稳定性较差,而 EDC-PEI1800-Hep×15组由于外层是PEI1800-Hep×15,内层为 EDC-Hep,因此它的释放模式既与PEI1800-Hep×15组相似,又不如后者释放快,再加上它的VEGF165结合量最大,因而在30 d释放过程中表现出良好的VEGF165控释能力;通过组间比较,EDC共价键合组呈缓慢释放,其VEGF165稳定性强于PEI离子结合,但是EDC-Hep结合VEGF165量相对较少,而且固定不变,不如PEI-Hep组随层数变化可以任意调节肝素和VEGF165结合量,因此将EDC-Hep和PEI-Hep联合使用可以取长补短,增大肝素和VEGF165结合量的同时,还具有了良好的VEGF165控释能力。
血清中纤维连接蛋白和玻连蛋白在材料表面的吸附是影响细胞粘附的重要因素之一,所以材料上细胞粘附生长很大程度上取决于表面吸附蛋白的数量和性质。影响蛋白质吸附的关键因素是材料表面的亲疏水性,一般是材料表面疏水性增加,吸附的蛋白也增多,不过疏水性增强后,吸附蛋白的构象将发生变化[16],以至影响蛋白间的相互作用。但表面亲水性增加减少了蛋白吸附或可能抵抗蛋白吸附[17],也不利于细胞生长,所以通常材料表面应具有中等润湿性才有利于细胞黏附生长[18]。根据2.1中基质表面接触角测试结果,EDC-Hep组亲水性最强,PEI1800-Hep×15组和 EDC-PEI1800-Hep×15组与空白对照材料表面亲疏水性能相近,属于中等润湿性,表明各组亲疏水性与细胞黏附率变化一致,从而验证了材料表面中等润湿性更有利于细胞黏附。
Wissink等将肝素化胶原和未肝素化胶原结合bFGF后,考察两组对HUVECs的增殖影响,结果显示,肝素化胶原所需的最低细胞种植密度较未肝素化的降低了4倍(250:1000细胞数/cm2),说明肝素化基质结合生长因子后,促细胞增殖能力增强,反映出肝素化处理利于生长因子结合,有效保护了生长因子活性[19]。这一点在2.5的交联空白组和肝素化各组结合VEGF后促细胞增殖结果中得到验证。结合2.3中VEGF释放实验结果可知:EDCHep-VEGF165组细胞增殖较快,说明缓释有利于保护生长因子的活性,使生长因子更有效地促进细胞增殖;PEI1800-Hep×15-VEGF165组粘附率稍高于前者,但细胞增殖缓慢,表明该组的VEGF165流失较快,稳定性差;EDC-PEI1800-Hep×15-VEGF165共价-离子结合肝素负载VEGF165组的细胞黏附情况最好,而且细胞增殖速度最快,说明该组结合了EDC-Hep-VEGF165组和PEI1800-Hep×15-VEGF165组的优点,既利于细胞黏附,又结合了大量生长因子,促细胞增殖能力最强,表明该组具备了良好的VEGF165控释能力。
4 结论
采用共价-离子联合方法对基质实施肝素化并结合VEGF165,使基质兼具了共价键合肝素结合VEGF165稳定性强、离子结合肝素表面易于细胞粘附且VEGF165量可随结合层数任意调节的优点。经联合方式改性的基质负载肝素量和VEGF165结合量分别是共价、离子单独结合量的叠加,其表面的中等润湿性利于细胞黏附,对VEGF165的有效控释促进了HUVECs快速增殖,具备了良好的VEGF165控释能力和促HUVECs增殖能力,有望成为构建可诱导再生的小口径人工血管的新材料。
[1]Lery AP,Levy NS,Wegner S,et al.Transcriptional regulation of the rat vascular endothelial growth factor gene by hypoxia[J].J Biol Chem,1995,270:13333-13340.
[2]Engler DA.Use of vascular endothelial growth factor for therapeutic angiogenesis[J].Circulation,1996,94(7):1496-1498.
[3]Yang HT,Deschenes MR,Ogilvi RW,et al.Basic fibroblastgrowth factor increases collateral blood flow in rats with femoral arterial ligation[J].Circ Res,1996,79:62-69.
[4]李勇刚,张尔永.牛心包片在心血管外科的应用[J].华西医学2002,17(3):420-421.
[5]麻开旺,高玮,蔡绍皙,等.肝素固定化技术研究进展[J].生物医学工程杂志2007,24(2):466-469.
[6]侯长军,张文彬,霍丹群.肝素化结合方式及本体材料的研究进展[J]. 化工进展 2003,22(7):703-708.
[7]Wissink MJB,Beernink R,Pieper JS.Binding and release of basic fibroblast growth factor from heparinized collagen matrices[J].Biomaterials 2001,22:2291-2299.
[8]Mao Zhengwei,Lie Ma,.Bioactive thin film of acidic fibroblast growth factor fabricated by layer-by-layer assembly[J].Bioconjugate Chem,2005,16:1316-1322.
[9]秦明春,王若光,秦莉花,等.人脐静脉内皮细胞的体外分离培养及鉴定[J].湖南中医药大学学报2007,27(4):12-15.
[10]Rusnati M,Coltrini D,Caccia P,et al.Distinct role of 2-O-,N-,and 6-O-sulphate groups of heparin in the formation of the ternary complex with basic fibroblast growth factor and soluble FGF receptor-1[J].Biochem Biophys Res Commun,1994,203(1):450-458.
[11]Ishihara M,Shaklee PN,Yang ZC,et al.Structural features in heparin which modulate specific biological activities mediated by basic fibroblast growth factor[J].Glycobiology,1994,4(4):451-458.
[12]Zhang J,Cousens LS,Barr PJ,et al.Three dimensional structure of human basic fibroblast growth factor,a structural homolog of interleukin 1beta[J].Proc Natl Acad Sci USA,1991,88:3446-3450.
[13]Erikson AE,Cousens LS,Weaver LH,et al.Three-dimensional structure of human basic fibroblast growth factor[J].Proc Natl Acad Sci USA,1991,88:3441-3445.
[14]Chang Y,Pascale P,Sabine K,et al.Modification of collagen matrices for enhancing angiogenesis[J].Cells Tissue Organs,2004,178:189-196.
[15]Wissink MJB,Beernink R,Poot AA,et al.Improved endothelialization of vascular grafts by local release of growth factor from heparinized collagen matrices[J].Journal of Controlled Release,2000,64:103-114.
[16]Williams RL,Hunt JA,Tengvall P.Fibroblast adhesion onto methyl-silica gradients with and without preadsorbed protein[J].J Biomed Mater Res,1995,29(12):1545-1555.
[17]Bhatia SK,Teixeira JL,Anderson M,et al.Fabrication of surfaces resistant to protein adsorption and application to two-dimensional protein patterning[J].Anal Biochem,1993,208(1):197-205.
[18]Lanza RP,Langer R,Chick WL.Principle of tissue engineering[M].Austin: R.G.Lander Company,1996.229-235.
[19]Wissink MJB,Beernink R,Poot AA,et al.Endothelial cell seeding of(heparinized)collagen matrices:effects of bFGF preloading on proliferation(after low density seeding)and procoagulant factors[J].Journal of Controlled Release,2000,67:141-155.

