瘤胃酸中毒与NADH辅因子的营养调控
欧阳克蕙 瞿明仁 黎观红
瘤胃酸中毒是指反刍动物采食大量易发酵碳水化合物饲料后,导致瘤胃有机酸产生过多,瘤胃pH值的非生理性下降和有毒物质的产生,而引起瘤胃微生物区系失调和消化道瘤胃功能紊乱的一种代谢性疾病。在反刍动物育肥过程中,急性和慢性瘤胃酸中毒仍是困扰经营者的一大关键问题(Owens等,1998)[1]。据Martin等(1999)[2]保守估计,每年仅美国的肉牛肥育生产因瘤胃酸中毒造成的直接经济损失就高达0.6~1亿美元。我国也随着肉牛产业的发展,集约化规模化肉牛养殖数量增加,高精料饲养的肥育肉牛比率越来越大,由之而带来的瘤胃酸中毒所造成的损失巨大。因此,如何防止反刍动物瘤胃酸中毒倍受关注。
1 瘤胃酸中毒发生机制
目前,大多数学者认为急性酸中毒的发生原因是瘤胃内乳酸产生菌与乳酸利用菌的菌群失调,致使乳酸含量增加而引发的(Krehbiel等,1995;Nocek,1997;Owens等,1998;Enenmark 等,2002)[1,3-5]。而亚急性瘤胃酸中毒(subacute ruminal acidosis,SARA)则是VFA(挥发性脂肪酸)在瘤胃内过量蓄积所导致(Martin,1998;Oetzel等,1999;Darren,2005;常影,2006)[6-9],特别是丁酸的过量蓄积(胡红莲,2008)[10]。
正常情况下,瘤胃pH值能维持相对稳定。这主要得益于日粮和唾液中碱性物质的中和作用、瘤胃缓冲系统的缓冲作用、瘤胃微生物对乳酸的代谢利用以及瘤胃壁对有机酸的吸收等机制(肖训军和孟庆翔,2000)[11],使得瘤胃的pH值保持在正常的6.2~6.8[12]。Stock 和 Britton(1993),Beauchemin(2007)指出,如果瘤胃内VFA产生、吸收和中和之间的这种动态平衡被破坏,就会造成VFA在瘤胃大量累积和pH值的降低,从而发生瘤胃酸中毒[13-14]。在这些VFA当中,又以丁酸的积累对瘤胃pH值的影响最大[10]。
VFA的产生与日粮类型有密切关系。不同的日粮造成瘤胃微生物代谢过程发生改变,酸代谢的产物也不同(见表1)。
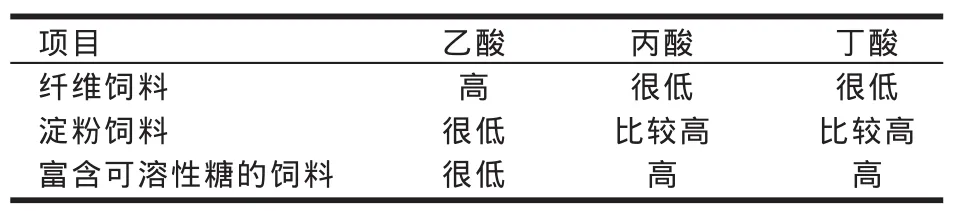
表1 部分饲料酸代谢产物的比较[引自杨凤(2005)][16]
对羊瘤胃连续监测的结果也显示,随着日粮NFC/NDF(非纤维性碳水化合物/中性洗涤纤维)比例提高,瘤胃TVFA(总挥发性脂肪酸)摩尔浓度显著增加,其中丙酸、丁酸浓度呈现递增趋势,而乙酸浓度及A/P(乙酸/丙酸)则呈降低趋势(胡红莲,2008)[10]。这一结果与 Goad 等(1998)、Oetzel等(1999)、常影(2006)[15,7,9]的研究报道是一致的。
乙酸、丙酸、丁酸的酸度相近(pKa分别为4.76、4.87、4.81),因此,三种酸产生和吸收的速率成为其影响瘤胃内酸度的关键。据测定,乙酸、丙酸、丁酸在瘤胃内的吸收率分别为92.70%、76.51%和73.90%[10]。当日粮中含有足量的纤维性饲料时,正常瘤胃内酸代谢产物以乙酸为主,较易被瘤胃壁吸收掉。因此,即使乙酸产量的大幅度提高也并不意味着酸中毒危险性的增加(Beauchemin,2007)[14]。但当易发酵的淀粉和糖类饲料比例增加后,瘤胃内酸代谢则以丙酸和丁酸为主产物,较低的吸收率导致瘤胃内酸蓄积而pH值下降。在诱导发生SARA的山羊、阉牛中都发现瘤胃内VFA各组分摩尔比例的这种显著性变化规律(即丙酸显著增加、丁酸极显著增加,而乙酸浓度显著降低)(Harmon 等,1985;Brossard 等,2004;常影,2006;胡红莲,2008)[17-18,9-10]。
乳酸是瘤胃微生物利用底物发酵产生的另一种酸性物质,在正常瘤胃发酵状态下,乳酸并不是瘤胃发酵的一种重要中间产物,也不被吸收(段得贤,1981)[19]。乳酸浓度的升高,是在瘤胃pH值长期处于较低水平时,瘤胃内乳酸产生菌增加而乳酸利用菌减少所导致。对瘤胃的持续监测可以发现,瘤胃内容物乳酸含量的高峰,是在较晚的时间,即病极期才开始增加(李光辉,1999)[20]。由于乳酸的酸度(pKa=3.1)远高于 VFA酸度(pKa=4.8),因此,乳酸浓度升高导致瘤胃pH值迅速下降,发生急性瘤胃酸中毒。
综上所述,饲喂大量易消化的碳水化合物饲料,是瘤胃酸中毒的启动环节[20]。瘤胃微生物代谢失衡,酸代谢产物的改变,导致瘤胃内有机酸动态平衡丧失,是造成瘤胃酸中毒的直接原因。
2 瘤胃酸中毒的营养调控措施
科学的饲喂制度和正确的日粮配比,如控制易发酵碳水化合物的比例和保证有效中性洗涤纤维(eNDF)是防止瘤胃酸中毒发生的根本措施。除此之外,在日粮中添加一些物质也可对瘤胃酸中毒进行营养调控。
2.1 添加缓冲剂
日粮中添加一定量的缓冲物能够起到稳定pH值的作用,常用的缓冲物质有:碳酸氢钠、氧化镁和碳酸钙。它们可通过提高瘤胃液的流速、中和瘤胃产生的部分有机酸或者两方面结合来发挥缓冲效应,达到阻止瘤胃中有机酸的积累,预防瘤胃酸中毒的目的。目前最常用的做法是在肉牛精料中添加0.8%~1.5%的碳酸氢钠。伍一军等(1991)报道[21],添喂NaHCO3+MgO能防止瘤胃液pH值下降,它虽然不能明显改变奶牛瘤胃氨氮浓度和TVFA浓度,但能增加瘤胃乙酸比例,降低丙、丁酸比例,且能抑制瘤胃内乳酸的产生。但也有些研究指出,添加碳酸氢钠在育肥早期能有效地减轻酸中毒,而在以后则效果不明显或完全无效[11]。同时,碳酸氢钠在使用过程中存在增加拌料麻烦,降低磺胺类药物的药效,以及可能因产生过多二氧化碳而引发继发性酸中毒等缺点。
2.2 添加离子载体类抗生素
一些离子载体类抗生素可以抑制某些乳酸产生菌的生长和降低采食量的变化范围,从而降低因消化功能紊乱而引起动物的死亡率(Cooper等,1996)[22]。莫能霉素是目前反刍动物肥育过程中使用最广泛的一种抗生素。大量的研究表明,莫能菌素能有效降低乙酸/丙酸比例和蛋白质在瘤胃内降解为氨的比例(Yang等,1993)[23],并通过降低挥发性脂肪酸和乳酸的产生量来提高瘤胃pH值,减少瘤胃酸中毒的发生(Bergen等,1984)[24]。实际生产中,精料中添加30mg/kg莫能菌素可降低瘤胃酸中毒的发病率。当然莫能霉素对饲料利用也有负面效果,例如抑制了纤维分解菌对粗饲料的降解(Busquet,2005)[25]。另外,抗生素的残留以及抗药性的问题,使得抗生素将被逐渐禁用(2006年1月1日起欧洲已禁止在饲料中使用抗生素)。
2.3 添加电子受体
苹果酸、延胡索酸(富马酸)和琥珀酸等有机酸是瘤胃内重要的电子受体,是瘤胃微生物发酵生成丙酸的中间产物(Martin,1998)[6]。与抗生素相反,这些有机酸的作用是促进乳酸利用菌对乳酸的利用,从而预防瘤胃pH值的下降,避免了酸中毒的发生,其中以苹果酸效果最为显著。Martin等(1999)给育肥期肉牛饲喂80%精料水平日粮,分别添加4、8、12 mmol/l三种不同浓度苹果酸,发现三种处理饲喂2~4 h内,瘤胃pH值均高于不添加苹果酸组。同时还发现随着苹果酸添加量的上升,瘤胃pH值和乙酸含量升高,总VFA产生量下降,丙酸、丁酸、L-乳酸含量以及乙/丙比例均没有明显变化[26]。此外,苹果酸等可被微生物利用,无残留。但是苹果酸的价格昂贵,生长育肥牛每天按添加80 g/头计,需增加成本0.18美元/头,从而限制了有机酸在生产中的应用。
2.4 接种益生菌
益生菌主要是一些细菌、真菌及其培养物,在单胃动物中使用普遍,在反刍动物中使用较少。研究发现,通过给病牛瘤胃接种健康牛的瘤胃液、乳酸利用菌、产乳酸菌都可以改善瘤胃发酵。其机制是与乳酸产生菌S.bovis(牛链球菌)竞争葡萄糖、麦芽糖等发酵底物,抑制S.bovis的生长,从而减少乳酸的产生量,如埃氏巨型球菌[27];或者将乳酸和葡萄糖转化为乙酸和丙酸,如丙酸菌和丙酸杆菌[28-30]。真菌如酵母能清除瘤胃中过量的氧气,从而为厌氧细菌提供有利的生存环境,促进瘤胃微生物的发酵。体外模拟研究表明,当日粮中含大量易发酵碳水化合物时,S.cerevisiae(啤酒酵母)能与S.bovis竞争葡萄糖,从而减少其乳酸的产量,同时,S.cerevisiae可以促进乳酸利用菌如S.ruminantium(反刍兽新月单胞菌)对乳酸的利用能力[31],其原因可能是其含有双羧酸(如苹果酸)或其他生长因子(张耿等,2005)[32]。但是,目前尚不清楚的是,在瘤胃微生物激烈竟争的环境中,接种微生物能否在瘤胃长期存活并发挥改变瘤胃微生物区系的作用。
2.5 使用植物提取物
使用植物提取物调控瘤胃的发酵,是目前反刍动物营养研究的热点(Busquet等,2006)[33]。例如黄莲(张元庆等,2007)[34]和肉桂(Busquet等,2005)[35]等提取物都可调控瘤胃发酵,提高瘤胃pH值。这可能是其中的精油对瘤胃内某些微生物的选择性抑制作用(Cardozo等,2006)[36]。而植物中的皂角苷则会通过破坏细胞膜从而抑制原虫和革兰氏阳性菌的活性,而使革兰氏阴性菌在瘤胃内环境中大量繁殖,从而造成丙酸的积累,影响瘤胃发酵类型(Busquet等,2006;Lila等,2003)[33,37]。但这些研究目前还以体外培养的方法为主,迫切需要开展动物试验。而且由于植物物种和提取工艺的差异,以及动物种类或饲粮类型的不同,使得这些试验结果变得不确定。
3 NADH辅因子与瘤胃酸中毒的营养调控
由前所述,瘤胃酸中毒的根本是瘤胃微生物代谢失调所造成的瘤胃内酸代谢失衡所致。因此,调控瘤胃内微生物代谢,控制瘤胃内酸代谢途径和速度,减少乳酸和丁酸的浓度,是防制瘤胃酸中毒的根本措施。然而,瘤胃内酸代谢是一个综合的、复杂的微生物代谢网络。由于瘤胃微生物的数量多而复杂,甚至有些微生物是我们目前还未知的,要确切地了解整个瘤胃微生物代谢网络并进行调控十分困难。单纯增加或减少某一种微生物、某一种代谢产物,调控某一种关键酶活性,对整个瘤胃微生物酸代谢网络所产生的影响难以确定。
本世纪以来微生物代谢工程兴起了一个重要分支——辅因子工程。即通过调节微生物胞内一些关键辅因子的形式与浓度,来改变和优化微生物细胞的代谢功能,定向控制代谢流的方向。这种在辅因子层面上调控碳代谢流的策略,甚至比改进微生物代谢网络中若干节点处的酶活性对碳代谢流的影响更为有效(Hugenholtz等,1999)[38]。作为碳代谢和氮代谢的关键辅因子,辅酶ⅠNAD+/NADH(Nicotinamide Adenine Dinucleotide,烟酰胺腺嘌呤二核苷酸)是最受关注的一对辅因子。通过调整胞内NAD(+/H)浓度及NAD+/NADH的比例,会对整个代谢网络产生极大的影响(Ying,2006;王桂兰等,2009)[9,40]。例如,荷兰的Hugenholtz等在乳酸乳球菌(Streptococcus lactis)发酵过程中,通过提高NAD+/NADH比例,使S.lactis由同型发酵迅速转入异型发酵,产物由单一的乳酸变为乳酸、乙酸和乙醇(de Felipe等,1998)[41]。张铁丹(2008)在用Lb.Paracasei(副干酪乳杆菌)发酵生产L-乳酸的过程中,发现乳酸的生成速度随NADH的浓度增大而增大,当NADH浓度增大到0.2 mmol/l后,体系的反应速度趋于平缓[42]。这些研究表明,NADH可对微生物细胞内的有机酸代谢路径和代谢速度进行有效调控。
那么,NADH对瘤胃微生物酸代谢有没有调控作用?许多学者发现,在应激和高产奶牛日粮中添加NAD+前体——烟酸,可提高奶牛产奶量(Jaster等,1983)[43]。添加一定量烟酸可促进育肥牛尽快适应育肥期日粮,显著提高日增重与饲料利用率,在高精料饲粮中添加烟酸能提高公牛和羔羊的生产性能(李新建等,2006)[44]。我们的实验也表明,在育肥肉牛高精料日粮(精粗比8:2)中单独添加400mg/kg干物质的烟酸,所取得的效果与添加1%碳酸氢钠的对照组差异不显著。另有研究表明,添加酵母可缓解瘤胃酸中毒,也可能是因为酵母中含有丰富的烟酸,可大量生成NAD+(Martin等,1992;Chaucheryras等,1995)[45-46]。
NADH辅因子调控瘤胃微生物酸代谢的机理,目前仍然不是十分清楚。根据目前的研究,NADH辅因子调控瘤胃微生物酸代谢可能的机理如图1所示。
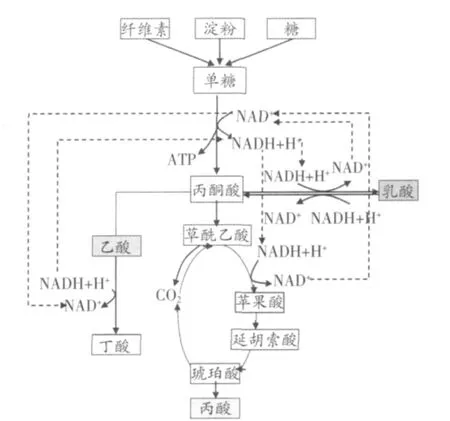
图1 NADH与瘤胃酸代谢的关系(瞿明仁等,2010)
4 展望
通过营养措施调控瘤胃发酵,防止瘤胃酸中毒发生,是提高反刍动物生产性能的重要手段。由于抗生素和化学添加剂的致畸、致癌、致突变作用,药物残留等问题,以及欧盟禁用抗生素法令的颁布实施,寻找新的天然替代品,采用更有效的方法调控瘤胃的发酵将成为反刍动物营养的研究热点。
21世纪以来,以NADH等辅因子手段调控复杂微生物代谢网络的技术方法在工业发酵上的研究越来越多,应用也越来越广。借助NADH辅因子调控手段对庞大复杂的瘤胃微生物代谢网络进行调控,将有助于我们从生化角度进一步理解瘤胃酸中毒的发生机制,并采取更有效的方法防制瘤胃酸中毒,其研究与应用前景十分广阔。
但是,与单纯的工业发酵相比,由于瘤胃微生物种类更多,代谢路径更复杂,采用NADH辅因子调控手段,对瘤胃酸代谢进行调控,还有许多工作要做,有许多困难要克服,因此,希望广大科技工作者共同努力,攻克瘤胃酸代谢调控的难题,为丰富和发展反刍动物营养理论作出自己的贡献。
[1]Owens F N,Secrist D S,Hill W J,et al.Acidosis in cattle:A review[J].J.Anim.Sci.,1998,76:275-286.
[2]Martin S A,Al-Khaldi S F,Evans J D,et al.Potential for manipulating gastrointestinal microflora:alternatives to antibiotics and ionophores[J].Recent Research Develop Microbio,1999(3):441-454.
[3]Krehbiel C R,Britton R A,Harmon D L,et al.The effects of ruminal acidosis on volatile fatty acid absorption and plasma activities of pancreatic enzymes in lambs[J].J.Anim.Sci.,1995,73:3111-3121.
[4]Nocek J E.Bovine acidosis:implications on laminitis[J].J.dairy Sci.,1997,80:1005-1028.
[5]Enenmark J M,Jrgensen R J,Enemark.Rumen acidosis with special emphasis on diagnostic aspects of subclinical rumen acidsis:a review[J].Vet Zootec,2002,20:16-29.
[6]Martin S A.Manipulation of ruminal fermentation with organic acids:A review[J].J.Anim.Sci.,1998,76:3123-3132.
[7]Oetzel G R,Nordlund K V,Garrett E F.Effect of ruminal pH and stage of lactation on ruminal lactate concentration in dairy cows[J].J.Dairy Sci.,1999,82(Suppl.1):38.
[8]Darren W B.Effect of the number of step-up diets fed during grain adaptation on acidosis and feeding behaviour of feedlot cattle[D].Master thesis,the University of Saskatchewan,2005.
[9]常影.阉牛亚急性瘤胃酸中毒发病机理和饲喂高油玉米籽粒缓解效果的研究[D].北京:中国农业大学,2006.
[10]胡红莲.奶山羊亚急性瘤胃酸中毒营养生理机制的研究[D].呼和浩特:内蒙古农业大学,2008.
[11]肖训军,孟庆翔.反刍动物瘤胃酸中毒及其防制措施[J].中国动物保健,2000,2(3):11-12.
[12]李祥辉,苗树君,连学昭.反刍动物瘤胃酸中毒的防治[J].黑龙江畜牧兽医,2006(6):72-73.
[13]Stock R,Britton R A.Acidosis in feedlot cattle.proceedings of scientific update on rumen-sin/tylan for the professional feedlot consultant[C].Elanco Animal Health,Indiannapolis,1993:A1-A13.
[14]Beauchemin K A.Ruminal acidosis in dairy cows:balancing physically effective fiber with starch availability[C].proceedings of florida ruminant nutrition symposium.2007:16-27.
[15]Goad D W,Goad C L,Nagaraja T G.Ruminal microbial and fermentative change associated with experimentally induced subacute acidosis in steers[J].J.Anim.Sci.,1998,76:234-241.
[16]杨凤.动物营养学(第二版)[M].北京:中国农业出版社,2005.
[17]Harmon D L,Britton R A,Prior R L,et al.Net portal absorption of lactate and volatile fatty acids in steers experiencing glucoseinduced acidosis or fed a 70%concentrate diet adlibitum[J].J.Anim.Sci.,1985,60:560-569.
[18]Brossard L,Martin C,Durand F C,et al.Protoza involved in butyric rather than lactic fermentative pattern during latent acidosis in sheep[J].Reprod.Nutr.Dev.,2004,44:195-206.
[19]段得贤,贺信恒,曹光荣.奶山羊过食谷物中毒的研究[J].西北农学院学报,1981(3):21-33.
[20]李光辉译.反刍动物瘤胃酸中毒的发病机制及分类[J].国外畜牧科技,1999,26(5):42-43.
[21]伍一军,韩正康,陈杰.用缓冲剂调控奶牛瘤胃消化代谢及其泌乳性能的研究[J].南京农业大学学报,1990,13(S1):88-94.
[22]Cooper R,Klopfenstein T.Effect of rumensin and feed intake variation on ruminal pH[A].Scientific Update on Rumensin/Tylan/Mycotil for the Professional Feedlot Consultant[C].Elanco Animal Health,Indianapolis,1996:A1-A14.
[23]Yang C M,Russell J B.The effect of monensin supplementation on ruminal ammonia accumulation in vivo and the numbers of amino acid fermenting bacteria[J].J.Anim.Sci.,1993,71(12):3470-3476.
[24]BergenWG,BatesDB.Ionophores:theireffectonproduction efficiency and mode of action[J].J.Anim.Sci.,1984,58:1465-1483
[25]Busquet M,Calsaimglia S,Ferret A,et al.Effects of cinnamaldehyde and garlic oilon rumen microbial fermentation in adual flow continuous culture[J].J.Dairy Sci.,2005,88:2508-2516.
[26]Martin S A,Streeter M N,Nisbet D J,et al.Effects of DL-malate on ruminal metabolism and performance of cattle fed a high concentrate diet[J].J.Anim.Sci.,1999,77(4):1008-1015.
[27]Kung L J,Hession A O.Preventing in vitro lactate accumulation in ruminal fermentations by inoculation with Megasphaera elsdenii[J].J.Anim.Sci.,1995,73:250-256.
[28]Ghorbani G R,Morgavi D P,Beauchemin K A,et al.Effects of bacterial direct-fed microbials on ruminal fermentation,blood variables,and the microbial populations of feedlot cattle[J].J.Anim.Sci.,2002,80(7):1977-1985.
[29]Newbold C J,Wallace R J,McIntosh F M.Mode of action of the yeast Saccharomyces cerevisiaeas a feed additive for ruminants[J].Br.J.Nutr.,1996,76(2):249-261.
[30]Limin K J.Direct-fed microbials for lactating dairy cows proceedings [M].12th Annual Florida Ruminant Nutrition Symposium,2001,22-28.
[31]Chaucheyras F,Fonty G,Bertin G.Effects of a strain of Saccharomyces cerevisiae (Levucell SC),a microbial additive for ruminants,on lactate metabolism in vitro[J].Can.J.Microbiol.,1996,42(9):927-933.
[32]张耿,毛胜勇,朱伟云.反刍动物瘤胃酸中毒发病机制及其研究进展[J].畜牧与兽医,2005,37(12):51-54.
[33]Busquet M,Calsamiglia S,Ferret A,et al.Plant extracts affect in vitro rumen microbial fermentation[J].J.Dairy Sci.,2006,89(2):761-771.
[34]张元庆,肖训军,孟庆翔.毛茛科植物提取物添加量对瘤胃微生物体外动态发酵的影响[J].中国畜牧杂志,2007,43(5):27-31.
[35]Busquet M,Calsamiglia S,Ferret A,et al.Effects of cinnamaldehyde and garlic oil on rumen microbial fermentation in a dual flow continuous culture[J].J.Dairy Sci.,2005,88(5):2508-2516.
[36]Garcia V,Catala P,Madrid J,et al.Potential of carvacrol to modify in vitro rumen fermentation as compared with monensin[J].Anim.,2007,1(5):675-680.
[37]Lila Z A,Mohammed N,Kanda S,et al.Effect of sarsaponin on rumen fermentation with particular reference to methane production in Vitro[J].J.Dairy Sci.,2003,86:3330-3336.
[38]Hugenholtz J,Kleerebezem M.Metabolic engineering of lactic acid bacteria:Overview of the approaches and results of pathway rerouting involved in food fermentations[J].Curropin Biotechnol,1999,10(5):492-497.
[39]Ying W.NAD(+)and NADH in cellular functions and cell death[J].Front Biosci,2006,11:3129-3148.
[40]王桂兰,王益娜,马江锋,等.不同还原性碳源对重组大肠杆菌厌氧发酵生产丁二酸的影响[J].中国酿造,2009(3):16-19.
[41]de Felipe F L,Kleerebezem M,de Vos W M,et al.Cofactor engineering:A novel approach to metabolic engineering in Lactococcus lactis by controlled expression of NADH oxidase[J].J.Bacteriol,1998,180(15):3804-3808.
[42]张铁丹.Lb.paracasei HD 1.7合成L-乳酸的代谢调控及L-乳酸的提取纯化[D].哈尔滨:黑龙江大学,2008.
[43]Jaster E H,Bell D F,Mcperson T A.Nicotinic acid and serum metabolite concent rations of lactating dairy cows fed supplemental niacin[J].J.Dairy Sci.,1983,66:1039-1045.
[44]李新建,高腾云,王永才.烟酸在反刍动物营养中的研究进展[J].安徽农学通报,2006,12(3):133-135.
[45]Martin S A,Nisbet D J.Effect of direct-fed microbials on rumen microbial fermentation[J].J.Dairy Sci.,1992,75:1736-174.
[46]Chaucheryras F,Fonty G,Bertin G,et al.In vitroutilization by a ruminal acetogenic bacterium cultivated alone or in associationwith an Archeamethanogen is stimulated by a probiotic strain of Saccharomyces cerevisiae[J].Appl.Environ Micro.,1995,61:3466-3467.

