鹅源新城疫病毒HN基因在Bac to Bac系统中的表达及抗原性检测
杨雪晶,鞠环宇,高明春,马 波,王君伟
(东北农业大学动物医学学院,哈尔滨 150030)
鹅源新城疫病毒病是由鹅副粘病毒引起的鹅的一种急性、烈性传染病,具有较高的发病率和死亡率,给养鹅业带来了严重的危害[1]。传统观点认为新城疫在水禽不引起发病,鹅源新城疫1997年在我国发现引起了人们的注意,经系统研究表明将鹅副粘病毒列入F基因型Ⅶ型NDV中[2]。
HN基因是主要的宿主保护性抗原基因[3]和毒力基因[4-5],HN蛋白是构成病毒囊膜表面重要的功能性糖蛋白,具有血凝素(HA)和神经氨酸酶(NA)两种活性,可以吸附细胞表面含唾液酸的受体,还可以由NA催化裂解唾液酸受体,在病毒感染过程中起着识别宿主细胞受体,使病毒吸附于宿主细胞膜上,并可破坏受体活性[6]。此外,HN还具有促进F蛋白融合作用的融合启动功能和抗肿瘤作用[7],还有研究报道HN蛋白在病毒毒力和影响病毒的组织的亲嗜性。HN蛋白在GPMV致病过程中起着重要作用,因此,本试验利用Bac to Bac杆状表达系统表达GPMV HN蛋白,为该病的免疫监测和诊断提供优良的检测抗原。
1 材料与方法
1.1 毒株、菌种、载体和细胞
毒株JS/1/97/Go(由扬州大学焦新安教授惠赠);大肠杆菌 DH5α(DE3)pLysS 感受态细胞(购自Novagen公司);大肠杆菌TG1和DH10Bac感受态细胞(本实验室制备并保存);pMD18-T-simple克隆载体(购自大连宝生物工程有限公司);pFast-HTb杆状病毒穿梭载体和草地贪夜蛾(Spodopera frugierda,sf9)昆虫细胞(本实验室保存)。
1.2 主要试剂、抗血清及酶标抗血清
限制性内切酶、连接酶、Ex Taq DNA聚合酶(购自大连TaKaRa生物工程公司);胶回收试剂盒(购自北京百泰克生物技术有限公司);Graces Insect Cell Culture Medium 和 CellfectinReagent(购 自Invitrogen公司);胎牛血清(购自Gibco公司);异硫氰酸荧光素(FITC)标记的兔抗鸡荧光抗体和兔抗鸡IgG辣根过氧化物酶标记抗体(购自Sigma公司);鸡抗NDV血清(哈尔滨兽医研究所提供)。
1.3 引物
试验所用引物由上海生工生物工程技术服务有限公司合成。GPMV-HN基因引物pHN1/pHN2;鉴定重组病毒引物M13Forward(-40)/M13Reverse。
pHN1:GGAATTCTCATGGACCGCGCGGTCAAT(划线部分为Eco RⅠ酶切位点)
pHN2:CTCGAGTGATTGGTGCGGTGTCGTCTT(划线部分为XhoⅠ酶切位点)
M13Forward(-40):GTTTTCCCAGTCACGAC
M13Reverse:CAGGAAACAGCTATGAC
1.4 HN基因的扩增、克隆及鉴定
以pMD18-T-HN质粒为模板,pHN1/pHN2为引物进行PCR扩增:95℃、5 min;94℃、1 min,58.6℃、1 min,72℃、1 min 50 s,共30个循环;72℃、10 min。PCR产物做1.0%琼脂糖电泳分析后,胶回收试剂盒回收目的片段,-20℃保存备用。
1.5 重组转座载体的构建
1.5.1 目的基因的扩增、克隆及鉴定
PCR回收纯化产物GPMV-HN基因与pMD18-T-simple载体连接,连接产物的转化(CaCl2法)、质粒提取(碱裂解法)参照文献[8]、质粒鉴定(单双酶切鉴定),所得阳性质粒命名为T-HN。测序工作由上海生工生物工程技术服务有限公司完成。
1.5.2 重组转座载体的构建
限制性内切酶Eco RⅠ和XhoⅠ分别消化供体质粒pFastHTb和T-HN质粒。T4DNA连接酶连接具有相同粘末端的GPMV-HN和pFastHTb片段,连接产物转化DH5а感受态细胞,筛选阳性克隆,得到重组转座载体pFastHTb-HN。
1.6 重组杆粒的构建
pFastHTb-HN转化含有穿梭载体bacmid的E.coli DH10Bac,在含X-gal、IPTG及四环素、卡那霉素、庆大霉素的LB琼脂平板上倒置培养24~48 h,蓝白斑筛选并经纯培养后提取bacmid杆状病毒质粒即重组杆粒DNA。以提取的重组杆粒为模板,以通用引物 M13Forward(-40)/M13Reverse,进行 PCR鉴定。同时设立未插入外源基因片段的DH10 bacmid杆粒对照组。10 g·L-1琼脂糖凝胶电泳,阳性的重组杆粒命名为rBacmid-HN。
1.7 重组F蛋白在昆虫细胞sf9中的表达
第1代病毒液P1以体积分数1%接种传代,得到第2代重组病毒提取杆状病毒DNA,以M13Forward(-40)/M13Reverse为引物进行 PCR鉴定重组杆状病毒。
1.8 重组蛋白表达及抗原性的检测
间接免疫荧光检测重组蛋白的表达,PBS清洗病变细胞3遍,4%多聚甲醛固定细胞,检测用一抗血清为鸡抗NDV血清,二抗为异硫氰酸荧光素(FITC)标记的兔抗鸡荧光抗体;Western blot检测蛋白的抗原性,PBS清洗病变细胞3遍,细胞裂解液裂解,反复冻融3次。检测用一抗血清为鸡抗NDV血清,二抗血清为兔抗鸡IgG辣根过氧化物酶标记抗体。
2 结果与分析
2.1 HN基因克隆载体及重组转座载体的构建
结果见图1、2。
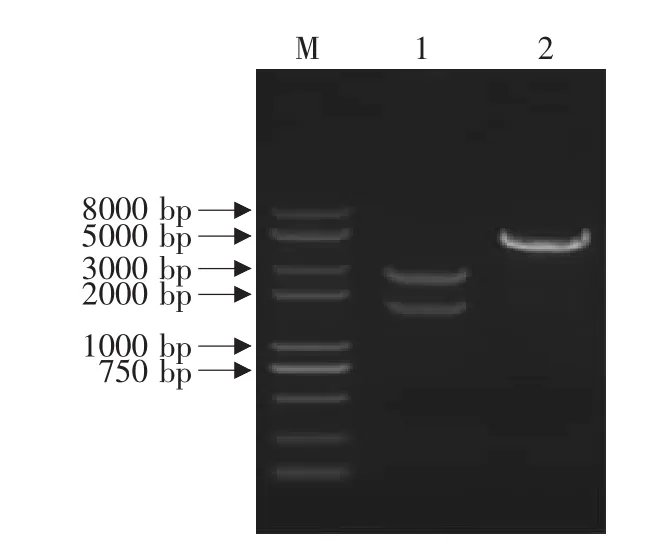
图1 重组质粒pMD18-T-simple-HN的酶切鉴定Fig.1 Identifications of the recombinant pMD18-T-simple-HN by restriction enzymes
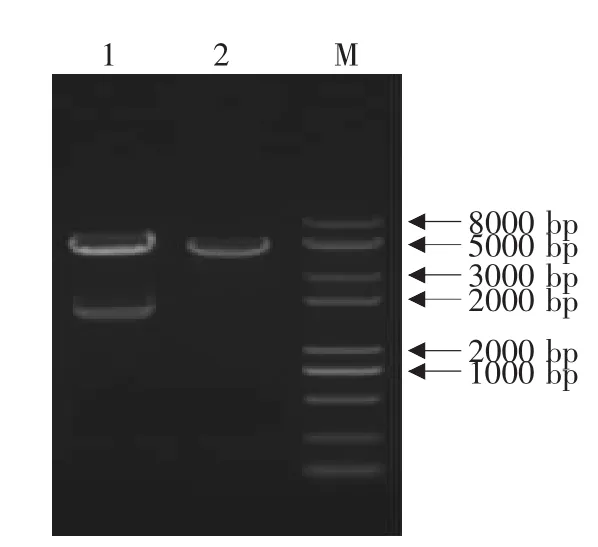
图2 重组转移载体pFastHtb-HN的鉴定Fig.2 Identifications of the recombinant plasmid pFastHtb-HN by restriction enzymes
由图1、2可见,经pHN1/pHN2为引物进行PCR扩增后,扩增出的片段大小为1 800 bp左右,与预期的1 795 bp大小相符,将其连接到pMD18-T载体上,单、双酶切鉴定,测序结果与pMD18-T阳性质粒中HN基因的序列完全一致。将HN基因亚克隆到pFastHtb转座载体,经单、双酶切及PCR鉴定。
2.2 重组杆粒rBacmid-HN的PCR鉴定
鉴定结果见图3。表明GPMV-HN基因已正确克隆到Bacmid中,即成功构建了重组杆粒rBacmid-HN。
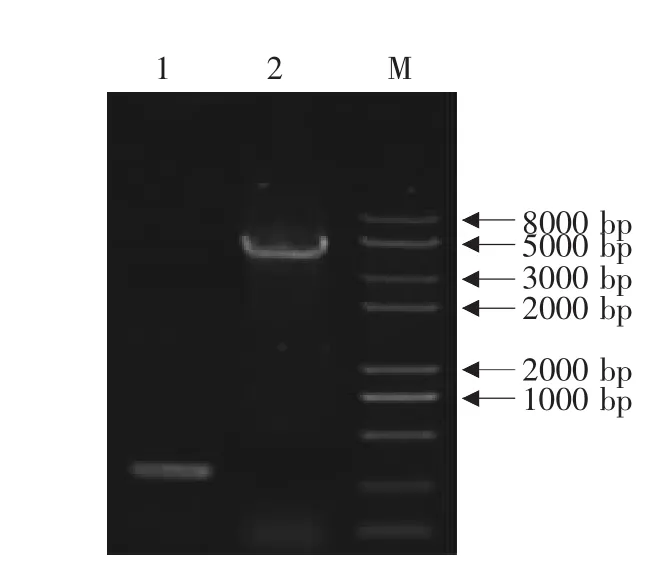
图3 重组杆粒rBacmid-HN的PCR鉴定Fig.3 Identifications of the recombinant bacmid rBacmid-HN by PCR
2.3 转染后sf9细胞病变及初步鉴定
重组杆粒rBacmid-HN转染sf9细胞后,72 h后细胞病变明显,即细胞变大变圆,折光性增强,但增殖缓慢,符合杆粒感染后细胞的变化特点。结果见图4。
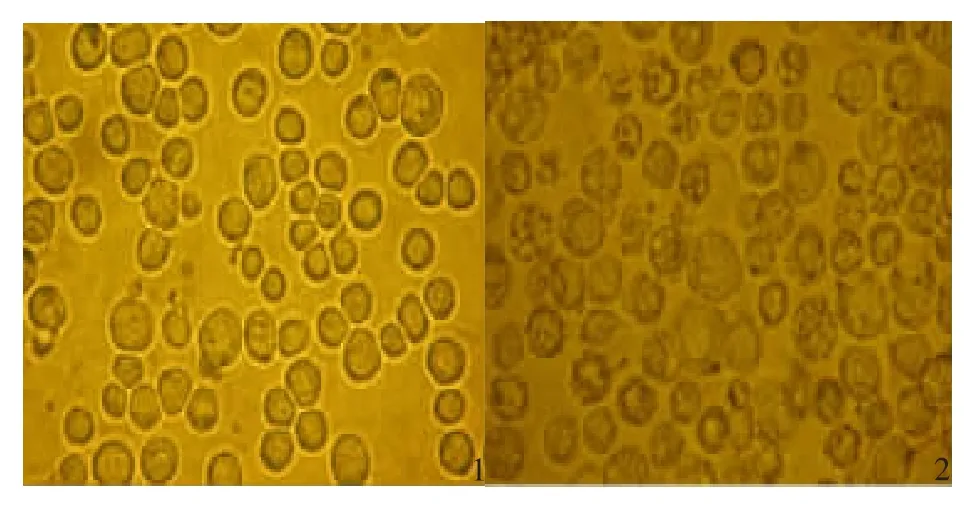
图4 倒置显微镜观察到的sf9细胞(10×40)Fig.4 Microscope pictures of different sf9 cells(10×40)
2.4 重组病毒的鉴定
2.4.1 重组杆状病毒P2代的PCR鉴定结果结果见图5。
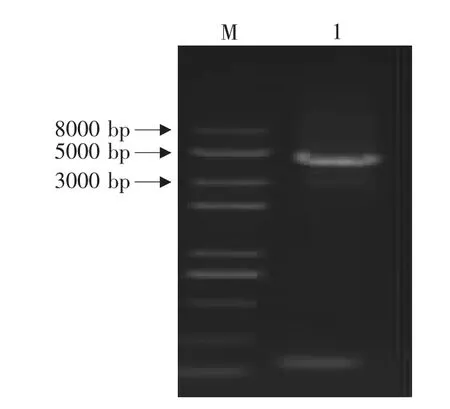
图5 重组杆状病毒rBv-HN P2代PCR鉴定Fig.5 Identifications of P2recombinant baculo virus by PCR
2.4.2 重组杆状病毒表达HN蛋白IFA鉴定结果
重组杆状病毒感染sf9细胞后,于72 h内细胞病变完全,经IFA检测,转染rBacmid-HN的sf9细胞具有很强的特异荧光,而sf9对照细胞无特异荧光见图6,说明HN蛋白在昆虫细胞内得到表达。
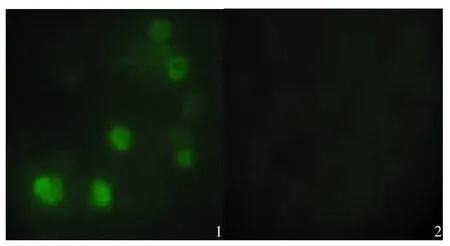
图6 转染rBacmid-HN和sf9细胞对照(72 h)Fig.6 Sf9 cells 72 h after transfected with Bacmid-HN and control
2.4.3 重组杆状病毒表达HN蛋白的SDS-PAGE和Western blot分析
图7为重组杆状病毒表达HN蛋白的SDSPAGE电泳图,与空细胞对照1泳道相比2泳道上的特异带,进一步证明了HN蛋白在杆状病毒表达系统的表达。Western blot检测,如图8所示,与细胞对照(1泳道)相比,病变细胞(2泳道:感染rBv-HN)所表达的蛋白能特异地与鸡抗NDV血清反应,表明sf9细胞所表达的HN蛋白具有良好的反应原性。
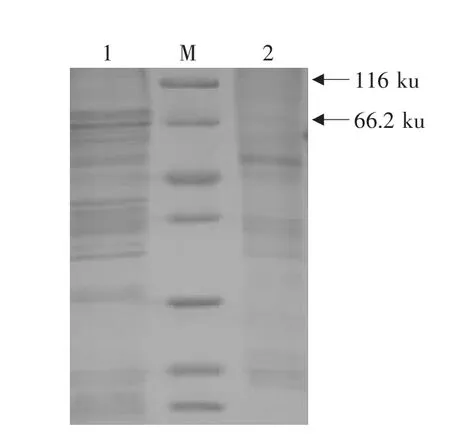
图7 表达产物的SDS-PAGE分析Fig.7 SDS-PAGE analysis of the recombinant protein expressed in sf9 cells

图8 表达产物的Western blot分析Fig.8 Western blot detection for expressed protein
2.4.4 重组杆状病毒表达HN蛋白的Dot-ELISA分析
对表达的目的蛋白进行Dot-ELISA检测,分析其抗原性,发现其可与鸡抗NDV阳性血清发生特异性免疫反应,而空细胞对照却没有(见图9)。进一步证明了表达产物的良好的反应原性。

图9 HN表达蛋白的Dot-ELISA分析Fig.9 Dot-ELISA analysis of expressed HN protein
3 讨论与结论
目前,临床上对GPMV感染尚无特效的治疗药物,接种疫苗是预防和控制该病发生的主要手段和途径。一般认为在预防和控制鹅源副粘病毒病中,应该选择与本地区正在流行的、抗原性相近的、免疫原性好的、同源毒株作为疫苗株,才能有效的控制该病的发生和流行,应用传统的活疫苗如LaSota、C30等由于其基因型不同(传统的疫苗属于F基因Ⅰ型、Ⅱ型[9]GPMV属于F基因Ⅶ型),因而造成疫苗只能起到部分的保护作用。本试验选用F基因Ⅶ型的GPMV的JS/1/97/Go毒株作为研究对象,利用基因工程技术克隆GPMV中具有较高抗原性且能产生中和抗体的HN基因,并在杆状病毒系统中成功表达了HN蛋白。对于该病的诊断与防治以及建立相关的血清学诊断方法奠定了良好的基础。
杆状病毒表达系统Bac to Bac系统是1993年Luckow等创建的[10],与其他病毒表达系统相比,该系统其突出的特点是阳性重组率高,重组体不需空斑纯化即可获得,大大减少了鉴定和纯化重组病毒的时间。重组质粒pFastHTb-HN转座成功是获得GPMV-HN基因在杆状病毒表达系统中表达的前提,即获得重组杆粒Bacmid-HN。因杆粒的片段太大(>135 kb),难以用常规的限制性内切酶进行酶切分析,而pUC/M13上下游扩增引物(M13Forward(-40)/M13Reverse)分别与 Bacmid 中lacZα-互补区内的mini-attTn7位点的两端相同,因此,在抗生素抗性及蓝白斑筛选的基础上,外源基因的插入可从PCR产物的大小来判断。未重组的杆粒PCR扩增产物的大小为270 bp左右,而重组杆粒rBacmid-HN的PCR扩增产物的大小为2 430 bp加上目的基因的大小。
本研究对鹅源新城疫HN基因利用Bac to Bac杆状病毒表达系统在昆虫细胞sf9中进行表达。通过SDS-PAGE电泳和Western blot结果显示的分子质量表明,表达产物的分子质量至少约为70 ku,比理论值稍大,HN基因的理论值为69 ku,说明HN蛋白在昆虫细胞内可能发生了不完全糖基化。本试验通过Bac to Bac杆状病毒表达系统表达鹅源新城疫HN蛋白为GPMV的抗原结构的分析、鹅源新城疫的诊断及基因工程疫苗的研制提供依据。对于表达蛋白的免疫学特性尚待进一步的研究。另外,试验过程中在检测HN蛋白反应原性使用了鸡抗NDV血清,从另一个侧面也反应了所表达的F蛋白可以作为新城疫的预防和治疗的研究基础。
[1]王永坤,田慧芳,周继宏,等.鹅副粘病毒病感染的研究[J].广西畜牧兽医,1999,15(6)∶7-11.
[2]严维巍,王永坤,周继宏,等.一株鸡副粘病毒的分子特性研究[J].扬州大学学报∶自然科学版,2000,3(1)∶27-31.
[3]宋长绪,刘福安.新城疫病毒的分子生物学[J].动物医学进展,1998,18(2)∶5-6.
[4]Panda R,Huang Z,Elankumaran S,et al.Role of fusion protein cleavage site inthe virulence of Newcastle disease viruse[J].Microbial Pathogenesis,2004,36∶1-10.
[5]Peeters B P,Dd Leeuw O S,Koch G,et al.Rescue of Newcastle disease virus from cloned cDNA∶evidence that cleavability of the fusion protein is a major determinant for virulence[J].J Vir,1999,73(6)∶5001-5009.
[6]Glickman R L,Syddall R J,Iorio R M,et al.Qusntitative basicresidue requirements in the cleavage-activation site of the fusion glycoprotein as a determinant of virulence for Newcastle disease virus[J].Journal of Virology,1988,62∶354-356.
[7]李霄,金宁一,连海,等.表达新城疫病毒血凝素-神经氨酸酶基因重组禽痘病毒的构建及其抑瘤作用[J].科学通报,2006,51(19)∶2252-2257.
[8]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].3版.北京∶科学出版社,2002∶32-36,48-50.
[9]Moss B.Genetically engineered poxviruses for recombinant gene expression,vaccination and safety[J].Proe Natl Acad Sci,USA,1996,93∶13341-13348.
[10]Luckow V A,Lee S C,Barry G F,et al.Efficient generation infectious recombinant baculovirus,by site-specific transposon mediated insertion of foreign gene into baculovirus genome propagated in Escherichia coli[J].J Virol,1993,67∶4566-4579.

