犬瘟热病毒小熊猫株核蛋白和融合蛋白基因克隆及序列分析
鞠会艳,乔 军,高玉伟,杨松涛,夏咸柱*
(1.吉林大学农学部,长春 130062;2.军事医学科学院军事兽医研究所,长春 130062;3.石河子大学动物科技学院,新疆 石河子 832003)
犬瘟热病毒(Canine Distemper Virus,CDV)传染性强,发病率高,呈世界性分布,易感宿主范围广,自然条件下,CDV感染犬、大熊猫、小熊猫、狮、虎和豹等食肉目所有8个科、偶蹄目猪科、灵长目的猕猴属和鳍足目海豹科等多种动物,严重危害了我国养犬业和珍稀野生动物保护业[1]。犬瘟热是危害国家二级保护动物-小熊猫(Ailurus fulgens)的最大疾病。小熊猫作为浣熊科动物,对CDV非常敏感,自然感染CDV的病例时有发生,甚至死亡[2-4]。本文用的CDV LP株是本研究室从死亡小熊猫肝脏病料中分离并鉴定的一株犬瘟热病毒。人工接种试验发现,该毒株能诱导幼犬产生高效价的中和抗体,表明CDV LP株是具有很强免疫原性的毒株。在CDV结构蛋白中,N蛋白是保守性较强的免疫原性蛋白,而且,N蛋白除含有B细胞表位外,还含有T细胞表位,在细胞免疫中发挥着重要作用[5-8]。F蛋白是诱导产生中和抗体的主要表面糖蛋白,F蛋白诱导的免疫反应能阻止病毒感染,并且在有病毒增殖的情况下抑制症状的发生[9]。鉴于N蛋白和F蛋白在CDV结构蛋白中的重要地位,本试验对这两种结构蛋白基因进行了克隆、测序和序列分析,旨在了解该毒株的分子生物学背景,为进一步研究安全有效的CDV基因疫苗和重组活载体疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 病毒、细胞与菌株
犬瘟热病毒小熊猫株(CDV LP)是本实验室用犬肾传代细胞从某动物园死亡的小熊猫肝脏中分离得到的;犬肾传代细胞(MDCK)购自中国兽医药品监察所;E.coli JM109由本实验室保存。
1.1.2 主要试剂
经典总RNA提取试剂盒和Taq plus DNA聚合酶(购自上海生物工程公司);反转录酶(AMV)、反转录酶抑制剂(RNase Inhibitor)、T4DNA连接酶及dNTP(购自NEB生物公司);DNA凝胶回收试剂盒(DNA Gel Extraction Kit)(购自 Vitagene公司);MEM培养基(为GlBCO产品);Random和Oligod(T)引物、无RNase的DEPC水、pMD18-T载体,各种限制性内切酶和DL 15000+2000的DNA Marker(购自TakaRa生物公司)。
1.2 方法
1.2.1 CDV的细胞培养
CDV LP株用MDCK细胞培养,生长液为含8%犊牛血清的MEM培养液,维持液为含2%犊牛血清的MEM培养液。在细胞长成单层时接毒,待70%细胞出现典型的CPE时收毒。将收毒的细胞瓶反复冻融3次,倒出CDV培养液,5 000 r·min-1离心10 min,取上清作为提取总RNA的材料。
1.2.2 DNA操作技术
大肠杆菌感受态细胞的制备、外源DNA片段与载体的连接反应、连接物的转化、质粒DNA的小量制备(碱裂解法)、DNA琼脂糖凝胶电泳、限制性内切酶酶切反应及目的DNA片段的回收皆按照文献[10]方法进行。
1.2.3 CDV LP株N和F蛋白基因的克隆和测序
1.2.3.1 引物的设计
参考GenBank中报道的CDV Onderstepoort株和A75/17株N和F蛋白基因序列,按照引物的设计原则设计了以下两对特异性引物,分别用于CDV LP株N和F蛋白基因的扩增。其中,P1和P2用于N蛋白基因的扩增,P3和P4用于F蛋白基因的扩增。为方便下一步克隆,分别在上、下游引物中引入Eco RⅠ(GAATTC)和 NotⅠ(GCGGCCGC)酶切位点。引物由宝生物工程(大连)有限公司合成。
N基因上游引物 P1:5′GAATTCAATATGGCT AGCCTTCTTAAGAGCCTC 3′;
N基因下游引物 P2:5′GCGGCCGCTTAATTG AGTAGCTCTCTATCATTG 3′;
F 基因上游引物 P3:5′GAATTCACCATGGAC AACAAAATCCCCAAAATAT 3′;
F 基因下游引物 P4:5′GCGGCCGCTTAGAGT GATCTTACATAGGATTTC 3′。
1.2.3.2 总RNA的提取
利用经典总RNA抽提试剂盒从反复冻融的CDV细胞培养液中直接提取总RNA。具体操作步骤见试剂盒说明书。
1.2.3.3 RT反应
在20 μL反应体系中分别加入提取的细胞总RNA 2 μL,5×反转录缓冲液 4 μL,2.5 mmol·L-1的dNTP 4 μL,RNase Inhibitor(40 U·μL-1) 0.5 μL,10 U·μL-1的 AMV 反转录酶 0.5 μL,Oligo d(T)(10 pmol·μL-1)1 μL,6 μL 的无 RNase 的 DEPC 水,将此20 μL反应体系中的各组分分别加到1.5 mL灭菌的Eppendorf管中,瞬间离心后,于42℃水浴中反应 1~1.5 h。
1.2.3.4 PCR扩增
在50 μL PCR反应体系中分别加入10×PCR反应缓冲液 5 μL,2.5 mmol·L-1dNTP 4 μL,上游引物(25 pmol·μL-1)1 μL,下游引物(25 pmol·μL-1)1 μL,RT产物5 μL,Taq plus DNA聚合酶(5 U·μL-1)0.3 μL,补加ddH2O至50 μL。经反复试验,确定了N和F基因的最佳PCR扩增参数。N基因的扩增条件是:96℃预变性200 s,94℃变性30 s,52℃退火30 s,72℃延伸120 s;均为33个循环,最后,72℃再延伸10 min;F基因的扩增条件是:96℃预变性200 s,94℃变性30 s,56℃退火30 s,72℃延伸150 s。PCR产物用1%琼脂糖凝胶电泳分析。
1.2.3.5 N和F蛋白基因的克隆
分别取经RT-PCR扩增所得的CDV LP株N和F蛋白基因的DNA回收片段4.5 μL,加连接液5 μL、pMD18-T 载体 0.5 μL,16 ℃连接 1 h,将连接产物转化大肠杆菌JM109菌株,然后按常规方法涂在含适量氨苄青霉素的LB琼脂平板(转化前在平板的琼脂表面加200 mg·mL-1的IPTG 4 μL和20 mg·mL-1的 X-gal 40 μL,涂匀,37 ℃放置 3 h)上培养12 h左右,挑选白色菌落,扩大培养后提取质粒,获得重组质粒pMD18-N和pMD18-F。然后用各种限制性内切酶酶切鉴定及以挑选的质粒为模板按上述的PCR条件进行扩增,通过酶切和PCR鉴定筛选出阳性重组质粒。
1.2.3.6 N和F蛋白基因的测序分析
将鉴定正确的重组质粒pMD18-N和pMD18-F各挑取1个阳性克隆送到上海联合基因生物公司进行序列测定。用DNASIS和DNAstar软件对测定的N和F基因序列及其推导的氨基酸序列进行分析,并与国内外不同的CDV分离株相应的基因序列进行分析比较。
2 结果与分析
2.1 N蛋白基因的扩增、克隆及重组质粒pMD18-N的鉴定
用含Eco RⅠ和NotⅠ酶切位点的N基因引物P1和P2,利用RT-PCR方法从犬瘟热病毒中扩增的N基因产物大小为1 571 bp,与理论值相符(见图1)。将N基因PCR产物连接到pMD18-T载体上,克隆得到重组质粒pMD18-N。该重组质粒经Eco RⅠ和NotⅠ双酶切得到2 660和1 571 bp两个片段,其中1 571 bp片段即为N基因片段;经Eco RⅠ酶切得到4 231 bp大小的线性化片段;PstⅠ酶切得到3 690和541 bp两个片段;BglⅡ酶切得到3 331和900 bp两个片段;KpnⅠ酶切得到4 231 bp大小的线性化片段(见图2)。以重组质粒pMD 18-N为模板,用N基因引物按PCR方法扩增可得到与目的基因-N基因大小一致的片段(见图3)。酶切和PCR鉴定证明N基因已正确克隆到T载体中。
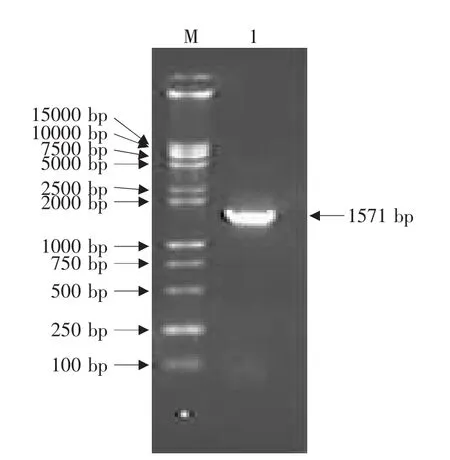
图1 N基因的PCR产物Fig.1 PCR production of N gene
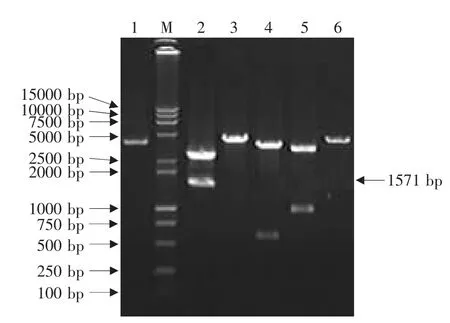
图2 重组质粒pMD18-N的酶切鉴定Fig.2 Identification of pMD18-N by restriction endonuclease digestion
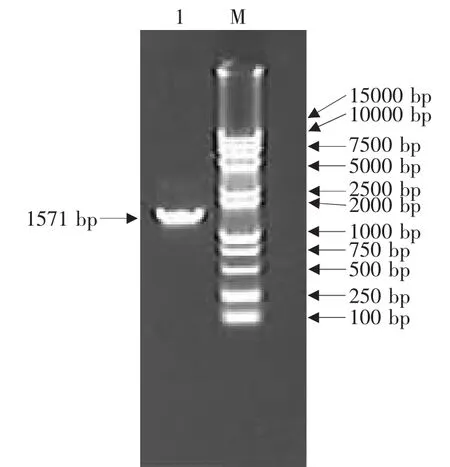
图3 重组质粒pMD18-N的PCR鉴定Fig.3 Identification of pMD18-N by PCR
2.2 F蛋白基因的扩增、克隆及重组质粒pMD18-F的鉴定
琼脂糖凝胶电泳结果表明CDV LP株F基因RT-PCR产物大小约为2 000 bp,与预期结果相符(见图4)。将PCR产物连接到pMD18-T载体上,克隆得到重组质粒pMD18-F。该重组质粒经Eco RⅠ和NotⅠ双酶切得到2 660和2 000 bp两个片段,其中2 000 bp片段即为F基因片段;经NotⅠ酶切得到4 660 bp大小的线性化片段;KpnⅠ酶切也得到4 660 bp大小的线性化片段(见图5)。以重组质粒pMD18-F为模板,用F基因引物按PCR方法扩增可得到与目的基因F基因大小一致的片段(见图6)。酶切和PCR鉴定证明F基因已正确克隆到T载体中。
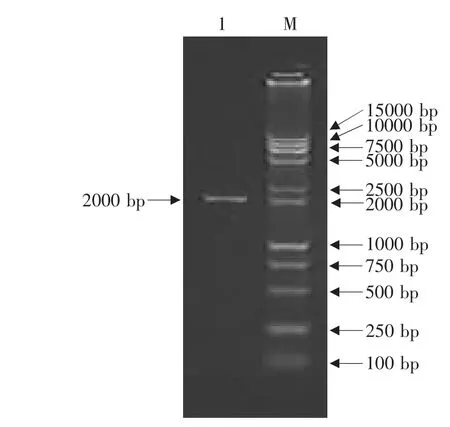
图4 F基因的PCR产物Fig.4 PCR production of F gene
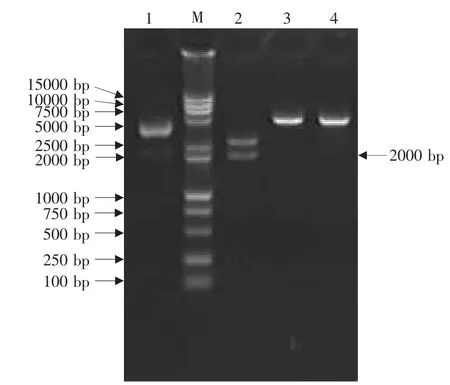
图5 重组质粒pMD18-F的酶切鉴定Fig.5 Identification of pMD18-F by restrictionendonuclease digestion
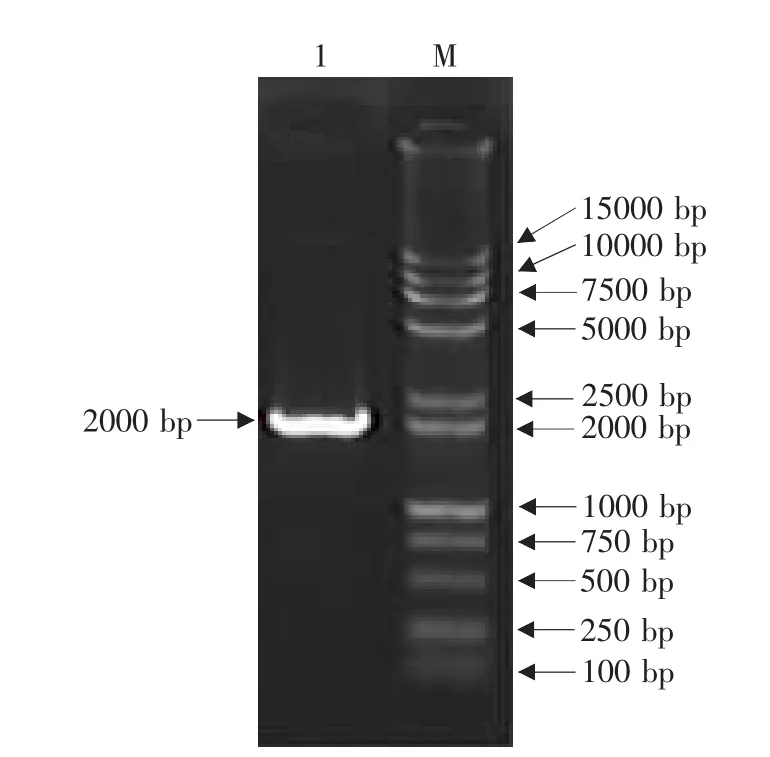
图6 重组质粒pMD18-F的PCR鉴定Fig.6 Identification of pMD18-F by PCR
2.3 N蛋白基因核苷酸序列及推导的氨基酸序列分析
2.3.1 N蛋白基因序列测定结果及推导的氨基酸序列经序列测定表明,CDV LP株N蛋白基因全长1 571 bp,编码523个氨基酸,与Onderstepoort弱毒株和A75/17强毒株N蛋白大小相同。从推导的N蛋白氨基酸序列比较结果可以看出,野毒株和弱毒株差异主要在N端和C端。CDV LP株N蛋白氨基酸序列与其它野毒株一样可分为三个区,即N端可变区(17-159位氨基酸残基)、C端可变区(408-519位氨基酸残基)和中间的高度保守区(160-407位氨基酸残基)。有研究表明,在所有的麻疹病毒属成员中N蛋白中间区域都是保守的,因为它含有N蛋白与RNA相互作用、病毒RNA的核衣壳化以及核衣壳的包装等必需的信息,这个区域的任何变化都有可能导致病毒包装不完全,而使病毒死亡。另外,在CDVLP株N蛋白N端281-289位上存在Y-P-A-L-G-L-H-E-F 9肽的序列,推测它可能是诱导CTL活性的靶蛋白的抗原表位之一。用BioEdit软件对推导的CDV LP株N蛋白氨基酸组成进行了分析,发现亮氨酸(Leu)占所有氨基酸残基的 9.54%(50/523);丝氨酸(Ser)占 9.35%(49/523);异亮氨酸(Ile)占 8.78%(46/523),远远高于其他氨基酸所占比例。氨基酸组成分析结果提示N蛋白具有易折叠的分子结构。
2.3.2 CDV不同毒株N基因同源性分析
结果见图7。
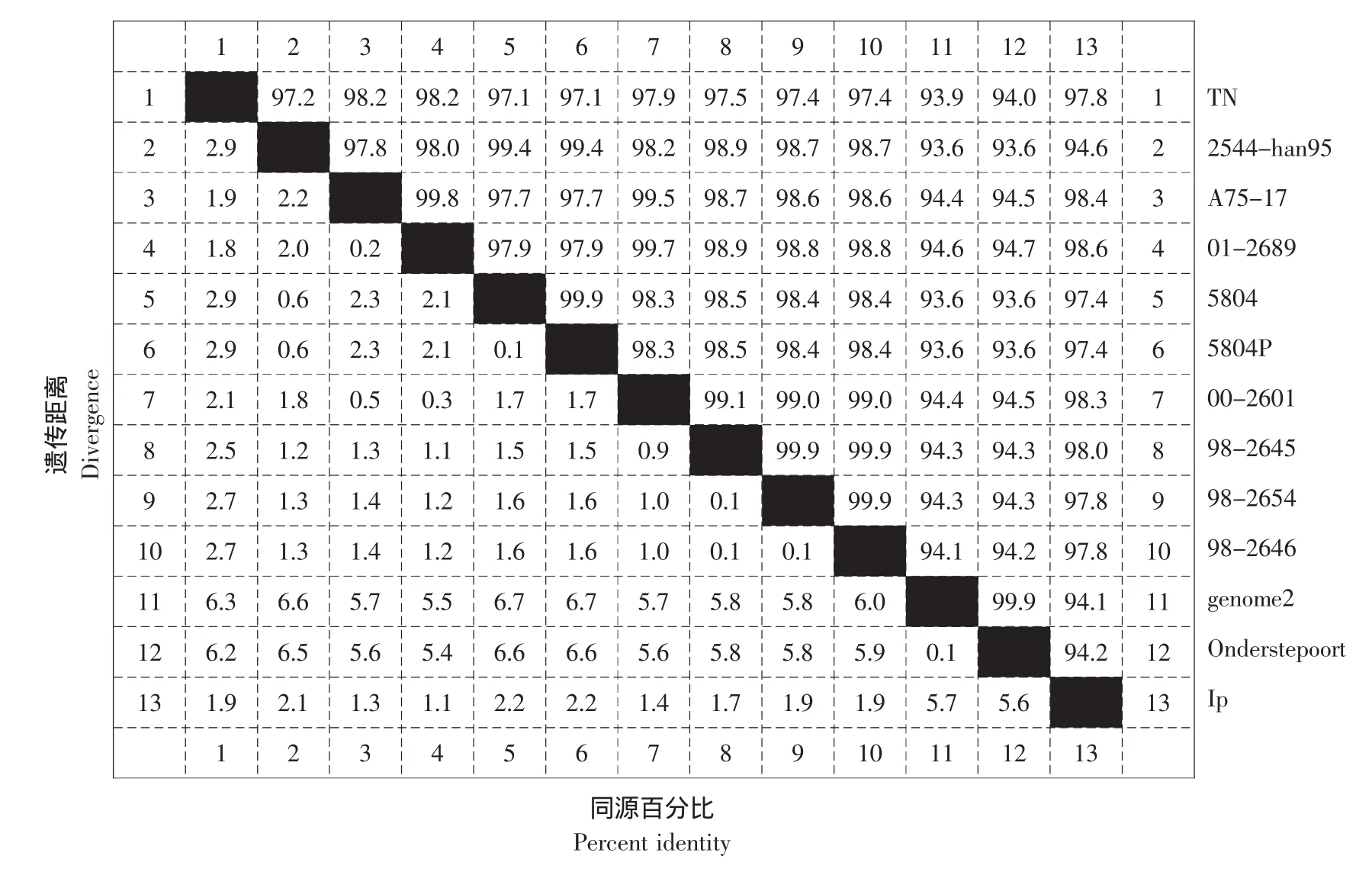
图7 CDV不同毒株N基因同源性分析Fig.7 Identities of N genes among different strains of CDV
基于CDV N基因的聚类结果表明,CDV LP株与A75-17、TN、5804和5804P等强毒株的亲缘关系要比Onderstepoort弱毒株更近(见图7)。通过序列比较,发现N蛋白具有高度的保守性,我们分析其原因,可能是由于CDV H和F蛋白位于病毒的表面,直接与免疫系统相接触,受到免疫系统的压力更大,为了在体内生存不得不发生较快的变异;而作为N蛋白,其主要功能是在病毒装配、转录和复制过程中起调控作用,发生较大的变异则不利于病毒的增殖;即使N基因发生了突变,在大多数情况下也是同义突变,其氨基酸序列也不会发生改变。
2.4 F蛋白基因核苷酸序列及推导的氨基酸序列分析
2.4.1 F蛋白基因序列测定结果及推导的氨基酸序列分析
经序列测定表明,CDV LP株F蛋白基因全长1 989 bp,编码662个氨基酸,与Onderstepoort弱毒株F蛋白大小相同。CDV LP株F蛋白含有17个半胱氨酸残基,而Onderstepoort弱毒株含有16个半胱氨酸残基。Onderstepoort弱毒株F蛋白含有4个潜在的N-联糖基化位点,而CDV LP野毒株推导的F蛋白氨基酸序列中则含有5个潜在的N-联糖基化位点,分别位于62-64、108-110、141-143、173-175、179-181位氨基酸,其中108-110位氨基酸残基上所形成的潜在糖基化位点是CDV LP野毒株拥有而Onderstepoort弱毒株所没有的。另外,通过对副粘病毒F蛋白基因转录研究发现,F基因mRNA翻译的最初产物是F0蛋白,在蛋白水解酶的作用下,裂解为F1和F2两个亚单位,二者再通过二硫键连接成蛋白二聚体。通过分析F1亚单位N末端氨基酸序列已经确认了CDV LP株F0蛋白的裂解位点位于220-224氨基酸残基部位。用TMHMM软件分析还发现,在F蛋白中还发现了两个跨膜区,分别位于225-247和606-628位氨基酸残基处。
2.4.2 CDV不同毒株F基因同源性分析
结果见图8。
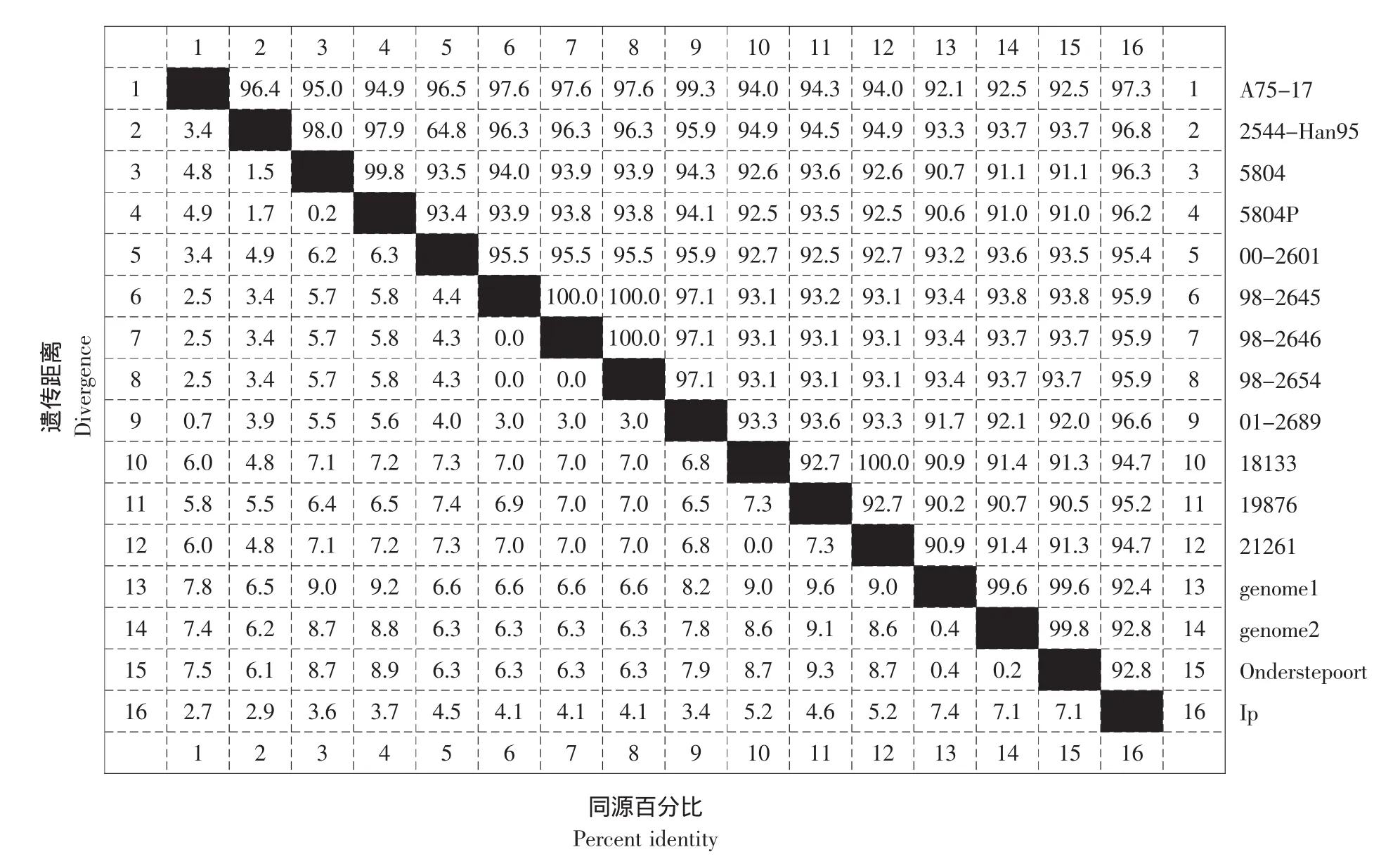
图8 CDV不同毒株F基因同源性分析Fig.8 Identities of F genes among different strains of CDV
与GenBank中已发表的15个CDV毒株相比,CDV LP株F基因核苷酸的同源性在90.2%~100.0%;推导的氨基酸序列的同源性在91.0%~100.0%之间(见图8)。CDV LP株与19876野毒株的亲缘关系较近,而与弱毒株Onderstepoort株的亲缘关系较远;Onderstepoort株是30年代从北美养狐农场分离出来,后经雪貂传代,又经数代鸡胚传代后的标准弱毒株,而19876野毒株则是最近从发病水貂脑中分离出来的一株强毒株。聚类分析提示,CDV LP株是一株与CDV强毒株亲源关系很近的毒株。
2.5 N和F蛋白疏水性、抗原表位和表面极性预测分析
用 DNAStar软件对 Onderstepoort弱毒株和CDV LP株N蛋白和F蛋白进行了疏水性及抗原表位预测比较分析。通过预测分析发现CDV LP毒株推导的N蛋白和F蛋白在疏水性、Jameson-Wolf抗原表位方面与标准弱毒株Onderstepoort株有一定的差异(见图9)。与Onderstepoort弱毒株相比,CDV LP野毒株N蛋白在475-485位氨基酸处有明显Jameson-Wolf抗原表位优势,CDV LP野毒株F蛋白在105-115位和365-375位氨基酸处有明显Jameson-Wolf抗原表位优势(见箭头所示)。这种抗原表位差异提示,CDV LP株N蛋白和F蛋白的免疫原性可能要优于Onderstepoort弱毒株。
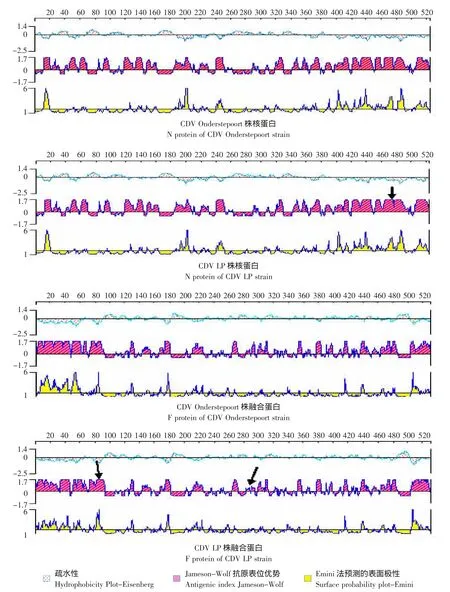
图9 DNAStar软件对推导的Onderstepoort弱毒株和CDV LP株N和F蛋白疏水性、抗原表位及表面极性预测Fig.9 Analysis of hydrophobicity,antigenic index and surface probability of N and F protein of Onderstepoort and CDV LP strain
3 讨 论
3.1 CDV LP株N蛋白基因和F蛋白基因序列分析
为探究犬瘟热病毒小熊猫株(CDV LP株)N和F蛋白基因是否适合作为深入研究CDV基因疫苗和重组活载体疫苗的目的基因,本研究对CDV LP株核蛋白(N)和融合蛋白(F)两种主要结构蛋白基因进行了克隆、测序及序列分析。CDV LP株N蛋白基因全长1 571 bp,编码523个氨基酸,与Onderstepoort弱毒株和A75/17强毒株的N蛋白大小相同。在CDV LP株N蛋白N端281-289位上存在Y-P-A-L-G-L-H-E-F 9肽的序列,推测它可能是诱导CTL活性的靶蛋白的抗原表位之一。CDV N基因的聚类分析表明,CDV LP株与A75-17、TN、5804和5804P等强毒株的亲缘关系要比Onderstepoort弱毒株更近。通过序列比较发现N蛋白具有高度的保守性,这可能是因为N蛋白的主要功能是在病毒装配、转录和复制过程中起调控作用,发生较大的变异则不利于病毒的增殖[11]。即使N基因发生了突变,在大多数情况下也是同义突变,其氨基酸序列也不会发生改变。
CDV LP株F蛋白基因全长为1 989 bp,编码662个氨基酸,与Onderstepoort弱毒株F蛋白大小相同。CDV LP野毒株推导的F蛋白氨基酸序列中含有5个潜在的N-联糖基化位点,而Onderstepoort弱毒株F蛋白则含有4个潜在的N-联糖基化位点,CDV LP株108-110位氨基酸残基上所形成的潜在糖基化位点是Onderstepoort弱毒株所没有的。糖基化位点的不同可能影响病毒的抗原性,CDV LP株比Onderstepoort弱毒株多一个潜在的N-联糖基化位点,预示着CDV LP株的抗原性可能优于Onderstepoort弱毒株。聚类分析提示,CDV LP株是一株与CDV强毒株亲源关系很近的毒株。
DNAstar软件对CDV LP和Onderstepoort弱毒株N蛋白和F蛋白进行的疏水性及抗原表位预测分析表明CDV LP野毒株与Onderstepoort弱毒株相比F蛋白在105-115位和365-375位氨基酸处有明显Jameson-Wolf抗原表位优势,CDV LP野毒株N蛋白在475-485位氨基酸处有明显Jameson-Wolf抗原表位优势,这种抗原表位差异提示CDV LP毒株N和F蛋白的免疫原性可能要优于Onderstepoort弱毒株。
不同毒株间氨基酸的变化很可能影响毒株的毒力和免疫原性,所以利用分子生物学方法对CDV LP野毒株N和F蛋白进行了序列分析,阐明了CDV LP株是一株免疫原性较好的毒株,为以CDV LP株的N和F蛋白基因为目的基因,深入研究基因疫苗和重组活载体疫苗打下基础。
4 结论
a.成功克隆了CDV LP株N和F蛋白全长cDNA。N蛋白基因全长1 571 bp,编码523个氨基酸。F蛋白基因全长1 989 bp,编码662个氨基酸,含有17个半胱氨酸残基,推导的F蛋白氨基酸序列中含有5个潜在的N-联糖基化位点。
b.与GenBank中已发表的15个CDV毒株相比,F基因核苷酸的同源性在90.2%~100.0%;推导的氨基酸序列的同源性在91.0%~100.0%之间。聚类分析表明CDV LP株是一株与CDV强毒株亲源关系很近的毒株。
c.用DNAStar软件对CDV LP株N蛋白和F蛋白进行的疏水性及抗原表位预测分析表明CDV LP株N蛋白和F蛋白抗原表位优势要明显优于Onderstepoort弱毒株,在分子水平上阐明了其免疫原性要优于Onderstepoort疫苗株的原因。
[1]葛艳华.Asia-1型犬瘟热病毒分离株H蛋白免疫原性分析及重组犬腺病毒2型的构建[D].哈尔滨∶东北农业大学,2009∶1-2.
[2]Deem S L,Spelman L H,Yates R A,et al.Canine distemper in terrestrial carnivores∶a review[J].J Zoo Wildl Med,2000,31(4)∶441-451.
[3]Evermann J F,Leathers C W,Gorham J R,et al.Pathogenesis of two strains of lion(Panthera leo)morbillivirus in ferrets(Mustela putoriusfuro)[J].VetPathol,2001,38(3)∶311-316.
[4]Rima B K,Duprex W P.Morbilliviruses and human disease[J].J Pathol,2006,208(2)∶199-214.
[5]Beauverger P,Buckland R,Wild T F.Measles virus antigens induce both type-specific and canine distemper virus cross-reactive cytotoxic T lymphocytes in mice∶localization of a common Ld-restricted nucleoproteinepitope[J].JGenVirol,1993,74(11)∶2357-2363.
[6]Beauverger P,Chadwick J,Buckland R,et al.Serotype-specific and caninedistemperviruscross-reactiveH-2Kk-restrictedcytotoxicT lymphocyte epitopes in the measles virus nucleoprotein[J].Virology,1994,203(1)∶172-177.
[7]Pare J A,Barker I K,Crawshaw G J,et al.Humoral response and protection from experimental challenge following vaccination of raccoon pups with a modified-live canine distemper virus vaccine[J].JWildlDis,1999,35(3)∶430-439.
[8]Endo Y,Uema M,Miura R,et al.Prevalence of canine distemper virus,feline immunodeficiency virus and feline leukemia virus in captive African lions(Panthera leo)in Japan[J].J Vet Med Sci,2004,66(12)∶1587-1589.
[9]Schadeck E B,Partidos C D,Fooks A R,et al.CTL epitopes identified with a defective recombinant adenovirus expressing measles virus nucleoprotein and evaluation of their protective capacity in mice[J].VirusRes,1999,65(1)∶75-86.
[10]Sambrook J,Russell D W.分子克隆实验指南[M].黄培堂等译.3版.北京∶科学出版社,2002.
[11]Stettler M,Zurbriggen A.Nucleotide and deduced amino acid sequences of the nucleocapsid protein of the virulent A75/17-CDV strain of canine distemper virus[J].Vet Microbiol,1995,44(2/4)∶211-217.

