黄芪注射液对心肌细胞氧化应激性损伤的保护作用
关凤英,李红,于秀霞,杨世杰
中药黄芪为豆科植物膜荚黄芪(Astragalus membranaceus Bge)和蒙古黄芪(Astragalus membranaceus Bge.Var.monhokicus(Bge)Hasiao)的干燥根。其味甘、性温,有补气升阳、固表止汗、托毒排脓、利水消肿和生肌等功效,为补气要药。其作用非常广泛,对多种疾病尤其是心血管疾病,如缺血缺氧心肌具有确切的保护作用。它的药理作用机制大多是综合性的,主要涉及到心肌代谢的改善、自由基的清除、Na+-K+-ATPase活性的抑制等方面,但对其确切的保护机制缺乏深入研究。本实验在离体细胞水平就黄芪注射液(Astragalus injection,AI)预适应作用保护机制进行研究。
1 材料与方法
1.1 材料 1 d龄新生清洁级Wistar大鼠乳鼠:吉林大学基础医学院实验动物中心。四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MT T):SIGMA公司;黄芪注射液(每支10 ml,相当于原生药20 g,批号:Z51021776):成都地奥九泓制药厂;小牛血清:杭州四季青公司;高糖Dulbecco最低必需培养液(IMDM):Hyclone公司;胰酶:DIFICO公司;乳酸脱氢酶(lac-tate dehydrogenase,LDH)及一氧化氮(nitric oxide,NO)检测试剂盒:南京建成生物工程研究所。胞内活性氧(reactive oxygen species,ROS)荧光探针DCFH、内皮型一氧化氮合成酶抑制剂(NG-nitro-L-arginine methyl ester,L-NAME)、罗 丹 明-123(Rhodamine123,Rh123):SIGMA公司;细胞凋亡AnnixinV/FITC/PI双染试剂盒:晶美。酶标仪:成都泰盟仪器有限公司;GF-200半自动生化测定仪:山东高密彩虹仪器有限公司;6010-紫外分光光度计:安揭伦上海分析仪器厂生产。
1.2 细胞培养及分组 取出生1 d Wistar大鼠乳鼠,在其剑突下剪开十字切口,取下心脏;磷酸缓冲液(PBS)冲洗后,将心肌组织剪碎,经0.1%胰酶消化;收集消化后的悬液,加入含10%胎牛血清IMDM,1500 r/min离心10 min,弃去上清,以含10%胎牛血清 IMDM悬浮,接种于10 cm培养瓶中;用差速贴壁法于CO2孵箱中培养90 min。加入成纤维细胞抑制剂5-溴脱氧脲苷100 μ mol/L,记数后以2×105/L密度再次接种于孔板或培养瓶中,待心肌细胞呈半融合状态后换为不含血清的IMDM培养液,同步化12 h后进行实验。
实验分为:①对照组(Control):心肌细胞不做任何处理;②模型组(Model):加入过氧化氢(hydrogen peroside,H2O2)0.15 mmol/L制备氧化损伤模型;③黄芪注射液高、中、低剂量组(AI,90 g/L、30 g/L和10 g/L):AI+Model;④L-NAME干预组:AI(90 g/L)+Model+L-NAME(20 μ g/L)。 ③、④组心肌细胞加入各种药后孵育30 min,再加入H2O2损伤5 h。
1.3 MT T法测定细胞存活力 与实验孔平行设不加细胞只加培养液的空白对照孔,比色时以空白孔调零。心肌细胞存活力以酶标仪490 nm处(A)值表示。
1.4 培养基中LDH、NO含量测定 取心肌细胞培养上清200 μL,检测LDH 和NO含量,按照试剂盒说明进行操作。
1.5 ROS生成量 加入H2O2后 30 min,每组3复孔,将处理过的心肌细胞弃去培养基,用Hepes液洗3次。加入 DCFH 10 μ mol/L负载液,避光孵育 30 min,弃去负载液;Hepes液洗3次后,重新添加Hepes液200 μL。将负载好的细胞放在激光共聚焦显微镜下,设定参数,在波长485 nm处激发,发射波长530 nm,扫描细胞(1次/s),记录 ROS荧光强度。
1.6 心肌细胞线粒体膜电位(ΔΨ m) 心肌细胞以2×105/L密度接种于24孔板,同上实验分为4组,每组3复孔。将处理过的心肌细胞弃去培养基,加入0.25%胰酶消化后收集到1.5 ml的Effindoff管中,用PBS洗3次。加入5 mg/L Rh123负载液50 μL,避光孵育10 min,弃去负载液,PBS洗3次,用EILITE型流式细胞仪检测荧光强度变化。
1.7 细胞凋亡率 分组同前。原代培养心肌细胞以1×106/L接种于100 ml培养瓶,0.25%胰蛋白酶消化,PBS 洗涤 2次,加入200 μL结合缓冲液悬起,取 100 μL细胞悬液于5 ml流式管中,加入5 μL annixinV/FITC和 20 μ g/ml碘化丙啶(propidium iodide,PI)10 μL,混匀后室温避光孵育 15 min,在反应管中加PBS 400 μL,以正常对照组设定检测参数,用EILITE型流式细胞仪检测,光源为488 nm氩离子激光器,FITC受激发后发绿色荧光,PI发红色荧光。每个样本至少收集10000个细胞,流式细胞仪分析,获得四个象限组成的细胞直方图,每个象限的细胞数就是检测细胞总数所在点的组分。左下象限代表正常细胞(An-PI-),右下象限代表早期凋亡细胞(An+PI-),右上象限代表晚期凋亡细胞和坏死细胞(An+PI+),左上象限代表细胞收集过程中出现的损伤细胞(An-PI+)。
1.8 统计学方法 采用SPSS 11.5统计软件处理数据,数据以(±s)表示,组间比较采用单因素方差分析。
2 结果
2.1 心肌细胞存活力 模型组心肌细胞存活力较对照组明显下降(P<0.01),各剂量AI组心肌细胞存活力较模型组显著增高(P<0.05),其中高剂量组效果最好,见表1。故以下实验均只选用高剂量组数据。
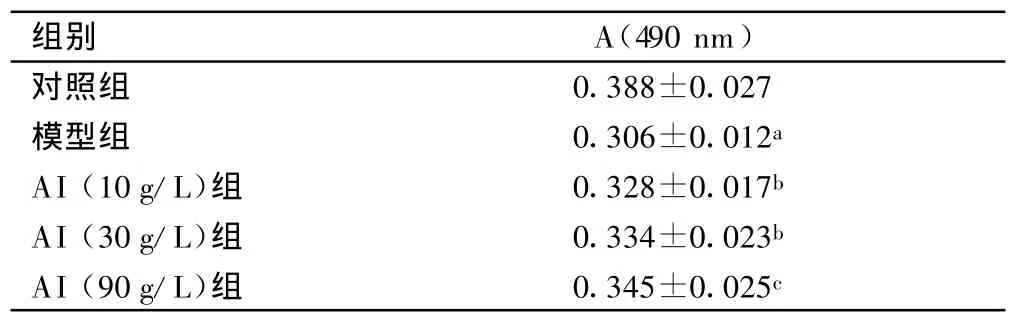
表1 乳鼠心肌细胞生存能力比较(n=6)
2.2 L-NAME对黄芪注射液保护作用的干预 模型组心肌细胞存活力较对照组明显下降(P<0.01),培养上清中LDH活性增高(P<0.05),NO含量略有升高,但无显著性差异,ROS明显升高(P<0.01),ΔΨ m明显下降(P<0.01),细胞凋亡率明显上升(P<0.01);AI组心肌细胞存活力较模型组明显增高(P<0.01),LDH活性明显降低(P<0.01),NO活性明显增高(P<0.01),ROS明显降低(P<0.01),ΔΨ m 明显上升(P<0.01),细胞凋亡率明显下降(P<0.01);L-NAME组心肌细胞存活力较AI组下降(P<0.05),LDH活性明显增高(P<0.01),NO含量下降(P<0.05),ROS降低幅度减弱(P<0.05),ΔΨ m下降(P<0.05),细胞凋亡率上升(P<0.05)。见表2。
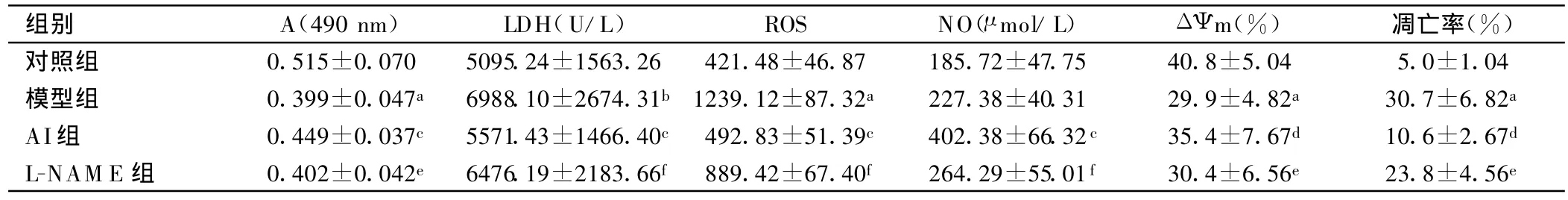
表2 各组乳鼠心肌细胞实验指标比较(n=6)
3 讨论
心肌细胞受外来因素的影响会发生氧化状态的改变,即胞内ROS升高。ROS是生物体有氧代谢产生的一类活性含氧化合物的总称,包括超氧阴离子、羟自由基与高活性的单线态氧、过氧化氢等。过量的ROS可引起细胞大分子的氧化损伤。H2O2是体内氧化代谢的中间产物之一,也是ROS的重要组成部分,大量积聚时会对细胞产生毒性作用,浓度在0.1~1.0 mmol/L范围内,细胞毒性呈剂量依赖关系[1]。本实验采用H2O2损伤心肌细胞来模拟体内氧化应激这一许多心血管疾病共同的病理生理过程,具有细胞损伤形态学明显,损伤可被药物对抗,模型稳定的特点。实验结果显示,采用0.15 mmol/L制备的损伤模型无论从心肌细胞存活力、LDH漏出量还是细胞凋亡率方面都显示出心肌氧化应激损伤的模型成立。
本实验首先考察了不同浓度AI对H2O2损伤心肌细胞的保护作用,结果显示各浓度AI对受损心肌细胞均具有保护作用,其中高剂量组(90 g/L)效果最好。故随后的机制研究实验均选用高剂量组。本实验研究证实,与模型组比较,AI预处理则可以诱导NO的生成,ROS显著降低、线粒体膜电位升高及细胞凋亡率下降,说明AI预处理后可减少活性氧的生成,降低细胞受损程度。
NO可由多种细胞产生,具有广泛的生理功能。NO和H2O2都是可跨膜的物质,在许多情况下,NO和H2O2信号之间相互联系。植物学研究显示,NO是ROS的清除剂,NO可通过影响过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和抗坏血酸过氧化物酶(ASAPOD)的活性调节内源性H2O2含量。NO能够显著诱导盐胁迫下小麦叶 SOD和 CAT活力的上升,延缓O2-和H2O2积累,同时促进抗氧化物质脯氨酸的含量上升,从而减轻盐胁迫下小麦叶片的氧化损伤[2]。已有大量研究证明,NO与缺血预适应作用有关[3-4]。我们在实验中发现,AI能够诱导NO生成,从而推测AI可能通过NO的生成产生保护作用。
NO由一氧化氮合酶(oxide synthase,NOS)催化左旋精氨酸生成。迄今为止,已知至少有3种NOS参与NO的生物合成:内皮型(eNOS)、诱导型(iNOS)和神经元型(nNOS)。eNOS位于内皮细胞的细胞膜上,也存在于心肌细胞上[5-6],基础活性较低;某些生理活性物质与内皮细胞膜上的相应受体结合后,动员细胞Ca2+,引起eNOS活化,触发一系列生物事件,如mitoKATP通道开放等[7-8],发挥保护作用。当AI与eNOS抑制剂 L-NAME共孵育后我们发现,L-NAME降低了AI对受损心肌细胞的保护程度。NOS是NO合成的限速酶,由于NOS活力水平的下降引起NO合成减少,综合分析可推测AI的心肌细胞保护作用可能与促进eNOS生成NO有关。NO是预适应保护作用中最重要的触发因子,故而其诱导的保护作用可启动一系列信号的传导,最终诱导保护性蛋白,从而抑制心肌细胞凋亡,稳定线粒体膜电位,发挥保护作用。其具体下游事件的发生尚有待系统研究。
[1]余卫平,钱之玉,绪广林,等.西红华酸对心肌细胞氧化应激性损伤的作用[J].中国药科大学学报,2003,34(5):452-455.
[2]阮海华.一氧化氮对盐胁迫下小麦叶片氧化损伤的保护效应[J].科学通报,2001,46(23):1993-1997.
[3]Cohen MV,Yang XM,Downey JM.Nitric oxide is a preconditioning mimetic and cardioprotectant and is the basis of many available infarct-sparing strategies[J].Cardiovasc Res,2006,70(2):231-239.
[4]Vinten-Johansen J,Zhao ZQ,Jiang R,et al.Myocardial protection in reperfusion with postconditioning[J].Expert Rev Cardiovasc T-her,2005,3(6):1035-1045.
[5]Brahmajothi MV,Campbell DL.Heterogeneous basal expression of nitric oxide synthase and superoxide dismutase isoforms in mammalian heart:implications for mechanisms governing indirect and direct nitric oxide-related effects[J].Circ Res,1999,85:575-587.
[6]Wei C,Jiang S,Lust JA,et al.Genetic ex pression of endothelial nitric oxide synthase in human atrial myocardium[J].May o Clin Proc,1996,71:346-350.
[7]Grossini E,Molinari C,Caimmi PP,et al.Levosimendan induces NO production throug h p38 MAPK,ERK and Akt in porcine coronary endothelial cells:role for mitochondrial K(ATP)channel[J].Br JPharmacol,2009,156(2):250-261.
[8]Kaneda K,Miyamae M,Sugioka S,et al.Sevoflurane enhances ethanol-induced cardiac preconditioning through modulation of protein kinase C,mitochondrial KAT P channels,and nitric oxide synthase,in guinea pig hearts[J].Anesth Analg,2008,106(1):9-16.

