PCR与Real-time PCR方法检测海产品创伤弧菌的比较
徐素惠,曾 静,除守建,程 刚,赵立红
(1.中国农业大学动物医学院,北京 海淀 100193;2.北京市出入境检验检疫局朝阳分局,北京 朝阳 100026)
创伤弧菌自然生存于近海和海湾的海水和海底沉积物中,其分布与海水的温度和盐度密切相关[1]。进食被创伤弧菌污染的食物后,创伤弧菌能迅速通过肠黏膜侵入血液,引起原发性败血症。据报道美国每年有20~40个原发性创伤败血症病例,死亡率高达50%,在佛罗里达创伤弧菌感染是导致食源性死亡的主要原因[2-3]。我国近年来也有相关报道[4-5],因此加强对海产品中创伤弧菌的检查对保证食品安全具有重要意义。
1 材料与方法
1.1 材料 鱼、虾、贝类等海产品以及创伤弧菌标准阳性菌株,均由北京市出入境检验检疫局提供。
1.2 引物 引物参照FDA细菌分析手册扩增vvhA基因上一段519 bp的序列 PCR引物序列上游为 :5′-ccg cgg tac agg ttg gcg ca-3′,下游为 :5′-cgc cac cca ctt tcg ggc c-3′;Real-time PCR引物序列上游为 :5′-ttc caa ctt caa acc gaa cta tga c-3′,下游为:5′-att cca gtc gat gcg aat acg ttg-3′;荧光探针:5′-FAM-aac tat cgt gca cgc ttt ggt acc gt-TAMRA-3′。
1.3 样品处理 分别将标准菌株和经高速匀浆处理待检海产品样本,在碱性蛋白胨水(APW)中增殖,37℃ ,16~18 h,用煮沸法提取DNA,13000 r/min离心5 min,取上清液备用。
1.4 细菌DNA的PCR扩增 以提取的创伤弧菌DNA为模板进行扩增,反应体系为:10×Buffer 2.5μL;dNTP 2μL;上 下游 引物 各 1μL;Taq 酶0.1μL;超纯水 17.4μL;模板 1μL 。反应条件94 ℃预变性3 min,94℃变性45 s,60℃退火45 s,72℃延伸45 s,最后72℃延伸 10 min,扩增35个循环。产物经1.5%琼脂糖凝胶电泳检测。
1.5 细菌DNA的Real-time PCR扩增 以提取的创伤弧菌DNA为模板进行扩增,反应体系为:2×Taq mix 12.5μL,上下游 引物各 1μL,荧光探 针0.5μL,超纯水 9μL,模板 1μL,进行扩增 。
1.6 灵敏度比较 取两份过夜培养的标准菌液各1mL,分别以10-1~10-9梯度稀释。一份采用煮沸法提取DNA,分别进行PCR和Real-time PCR检测,以确定检测限。另一份做相应的菌落计数以定量,比较两种方法的敏感度。
1.7 特异性试验 对标准阳性菌株和阳性样品,阴性样品和超纯水空白对照,以及近源菌(与创伤弧菌同属不同种,如副溶血弧菌、霍乱弧菌)、远源菌(与创伤弧菌不同属,如大肠杆菌、金黄色葡萄球菌)共60株进行PCR和Real-time PCR反应,检测其交叉反应性。
1.8 待检样品的检测 分别用PCR和Real-time PCR对196份待检海产品样品进行检查,确定其实用性。
2 结果
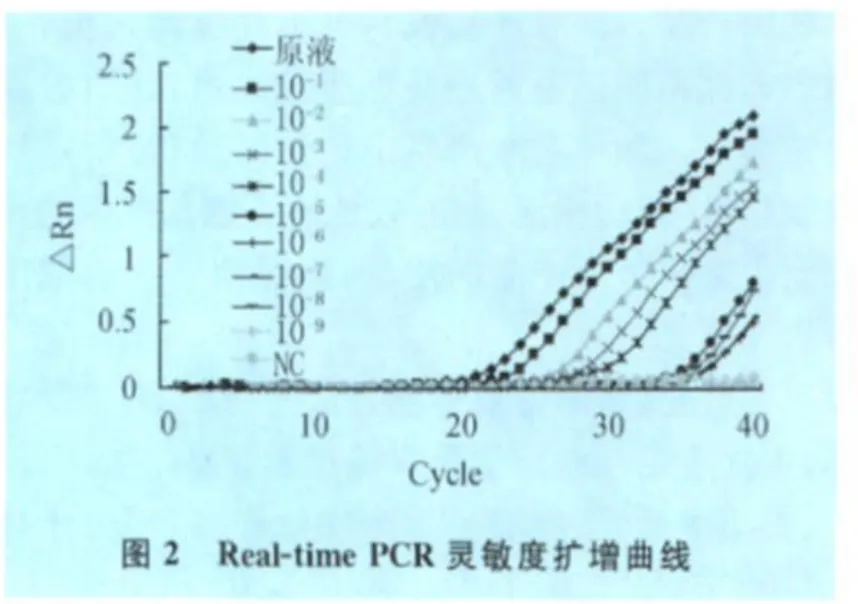
2.1 灵敏度 从图1和图2可知,PCR的检查限为10-4,可检出菌落数为375 CFU/mL,Real-time PCR检查限达10-8,可检出菌落数为21 CFU/mL。

2.2 特异性
2.2.1 PCR反应 从图3可知,标准阳性菌株和阳性样品均可见约为519 bp大小的清晰电泳条带,阴性样品和空白对照均未见任何电泳条带。
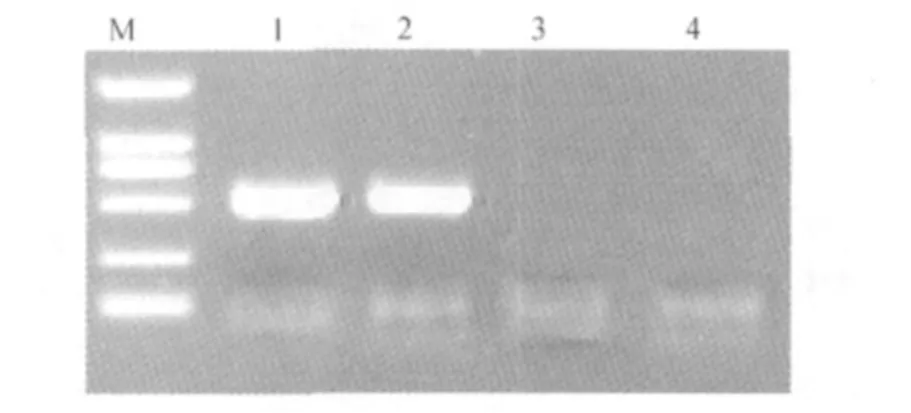
图3 PCR电泳图
2.2.2 Real-time PCR扩增 由图4可知,标准阳性菌株的Ct=23.29,阳性样品Ct=18.32,均呈明显的扩增,而阴性样品和空白对照均未有扩增。

2.2.3 近源菌和远源菌的特异性检测 结果发现60株创伤弧菌的近源菌和远源菌的PCR和Realtime PCR检测均为阴性。
2.3 两种方法对待检海产品检查结果 对196份海产品样品检查结果显示,PCR阳性率为10.67%,Real-time PCR阳性率为17.98%。
3 讨论
随着人民生活水平的不断提高以及观念意识的更新,海产品因其较高的营养价值越来越受广大消费者欢迎,为保持口感鲜嫩,人们喜欢食用生的或半熟的海产品。而海产品极易被创伤弧菌污染,食入后创伤弧菌能迅速通过肠黏膜侵入血液,引起原发性败血症。加强对海产品中创伤弧菌(特别是致病性创伤弧菌)的检测,对有效地防止创伤弧菌的传播和监控进出口海产品的质量,确保消费者的健康具有重要意义。
3.1 创伤弧菌的常规检测方法需经增菌、选择性培养、生化鉴定和血清学反应等过程,操作繁琐、耗时长、检出率低,不能满足生产实际需要,而分子生物学检测方法敏感、特异。本试验用 PCR和 Realtime PCR分别对不同稀释度的标准创伤弧菌创伤弧菌增菌液进行,结果表明PCR的检测限为10-4,菌落形成单位为375 CFU/mL,Real-time PCR的检测限达10-8,菌落形成单位为21 CFU/mL。可见Real-time PCR对创伤弧菌的检测灵敏度比PCR更高,更能满足实验室快速、准确诊断的需要。
3.2 用PCR和Real-time PCR检测标准阳性菌株和阳性样品均呈阳性,阴性样品和空白对照则未见扩增;对近源菌和远源菌共60株的检测也均表现为阴性。可见两种方法对创伤弧菌的检测有很好的特异性。
3.3 为避免杂菌和碱性蛋白胨水(APW)对检测的干扰,本试验还将标准菌株增菌液离心,弃去上清,用 TA缓冲液重悬,重复两次,再提取DNA,与直接用标准菌株增菌液煮沸提取DNA进行比较,观察碱性蛋白胨水(APW)对检测的干扰,发现结果没有差异。将标准菌株增菌液与海产品中经常分离到的杂菌进行不同浓度的混合,观察杂菌的存在是否会影响检出限,结果表明,不论对PCR还是Real-time PCR的检出限均无影响。
3.4 比较196份待检海产品的检测结果发现,PCR检测阳性率为10.67%,Real-time PCR阳性率为17.98%。表明 Real-time PCR比PCR灵敏度更高,更能满足实际应用。
综上所述,PCR与Real-time PCR对海产品中的创伤弧菌的检测均具有很好的特异性,但 Realtime PCR灵敏度更高,而且不需要琼脂糖凝胶电泳,快速省力(2 h即可报告结果),是实验室快速检测创伤弧菌的首选方法。
另据报道,有基于 toxR基因[6]、rpoS基因[7]建立的检测创伤弧菌的Real-time PCR,虽然基于这些基因的Real-time PCR能很好地鉴定创伤弧菌,但无法区别有毒无毒菌种。而基于16S rDNA基因[8]的Real-time PCR,由于其基因的缓慢进化不适合区别弧菌的种。本试验所用的PCR和 Realtime PCR均基于创伤弧菌的毒力基因vvhA,在保证敏感性和特异性的基础上可以直接检出对人体有毒害的创伤弧菌,对保障海产品的食品卫生更具意义。
[1]Motes M L,Depaola A,Cook D W,et al.Influence of Water temperature and salinity on vibrio vulnif icus in northern gulf and atlantic coast Oysters(Crassostrea virginica)[J].Applied and environmental microbiology,1998,64(4):1459-1465.
[2]Shapiro R L,Altekruse S.The role of Gulf Coast oysters harvested in warmer months in Vibrio vulni ficus infections in the United States,1988-1996[J].Infect Dis,1998,178:752-759.
[3]Jackson J K,M urphree R L,Tamplin M L.Evidence that mortality from Vibrio vulni ficus infection results from single strains among heterogeneous populations in shellfish[J].Clin Microbiol,1997,35:2098-2101.
[4]高仲雷.原发性创伤弧菌败血症 19例分析[J].浙江临床医学,2004,6(2):135-136.
[5]孙来芳,应斌宇,卢中秋,等.原发性创伤弧菌败血症17例诊治分析[J].岭南急诊医学杂志,2003(1):48-49.
[6]Hajime Takahashi,Yukiko Hara-Kudo,Jiro Miyasaka,et al.Development of a quantitative real-time polymerase chain reaction targeted to the toxR for detection of vibrio vulnificus[J].Journal of Microbiological Methods,2005,61:77-85.
[7]Kim Dong-Gyun,Sun-Hee Ahn.A pplication of the rpoS Gene for species-specific detection of vibrio vulnificus by real-time PCR[J].Microbiol.Biotechnol,2008,18(11):1841-1847.
[8]Katrina V Gordon,Michael C Vickery,Angelo DePaola,et al.Real-Time PCR assays for quantification and differentiation of vibrio vulnif icus Strains in oysters and water[J].Applied and environmental microbiology,2008,74(6):1704-1709.
——以青岛市为例

