狂犬病病毒ERA株糖蛋白基因的克隆与序列分析
高明华,张志琰,樊庆徳,杨晓刚,夏咸柱
(1.呼伦贝尔学院生命科学与化学学院,内蒙古 呼伦贝尔 021008;2.军事医学科学院军事兽医研究所,吉林 长春 130062)
狂犬病病毒(RV)属于弹状病毒科(Rhabdoviridae)狂犬病病毒属(Lyssavirus),是人兽重要共患狂犬病的病原[1-2]。根据血清学试验和种属发生规律,已知的狂犬病病毒及狂犬病相关病毒分为5个血清型[3-4]和7个基因型[5-7]。7个基因型又分属两个不同的遗传进化群[8]。基因Ⅰ型包括在自然界中流行的野毒株和固定毒株(如 ERA、SRV9、CVS、PV、Flury、aG株等)。RV结构蛋白包括核蛋白(N)、糖蛋白(G)、磷蛋白(P)、基质蛋白(M)和依赖RNA的RNA多聚酶(L)。糖蛋白是狂犬病病毒的主要保护性抗原,是惟一诱导机体产生中和抗体的蛋白,其免疫作用与全病毒疫苗相当[9-10]。鉴于糖蛋白在RV结构中的重要地位和在免疫上的重要作用,我们对RV ERA株G蛋白基因进行了克隆和序列分析,以期了解该毒株G基因的分子生物学背景和G蛋白的抗原性,同时也为进一步研究狂犬病安全有效的基因工程疫苗和新型检测方法奠定必要的基础。
1 材料与方法
1.1 病毒、质粒、菌种与主要试剂 RV ERA株由本实验室保存;反转录酶M-MLV、RNase抑制剂、T4DNA 连接酶 、dNTPs、pMD18-T 载体、限制性内切酶等购自宝生物工程(大连)有限公司;经典总RNA抽提试剂盒、Taq plus DNA聚合酶和DNA凝胶回收试剂盒购自上海生工生物工程技术服务有限公司;E.coli JM109由本实验室保存。
1.2 引物设计 根据GenBank公布的RV G基因序列,并分析其内部酶切位点,设计了1对特异性引物。上游引物:5′-AGCGAATTCGATGGT TCCTCAGGCTCTCCTGTT TG-3′,下游引物 :5′-TTAG CGGCCGCCTCACAGTCT -GGTCTCACCCCCA-3′为进一步克隆和构建表达载体需要,分别在上、下游引物的5′端引入 EcoRⅠ和NotⅠ酶切位点(下划线部分),并加3个保护性碱基。
1.3 病毒培养及总RNA提取 按常规方法培养病毒。采用经典总RNA抽提试剂盒提取总RNA。
1.4 RV ERA株G基因RT-PCR扩增、克隆与序列分析 RT-PCR扩增目的基因,产物用琼脂糖凝胶电泳分析,回收目的DNA片段,并与pMD18-T载体连接。连接产物转化 JM109,并用Amp+LB琼脂平板筛选。酶切鉴定重组质粒,正确者命名为pMD-G,送上海联合基因生物公司进行测序[11-12]。用软件分析序列并与其他毒株G基因进行同源性比较。
1.5 ERA株与其他不同毒株G基因及其推导的氨基酸序列分析 用分子生物学软件对测定的G基因序列及其推导的氨基酸序列进行分析;ERA株与GenBank上登录的其他国内外不同RV毒株糖蛋白主要抗原表位、糖基化位点和神经毒性残基等进行比较和分析。
2 结果
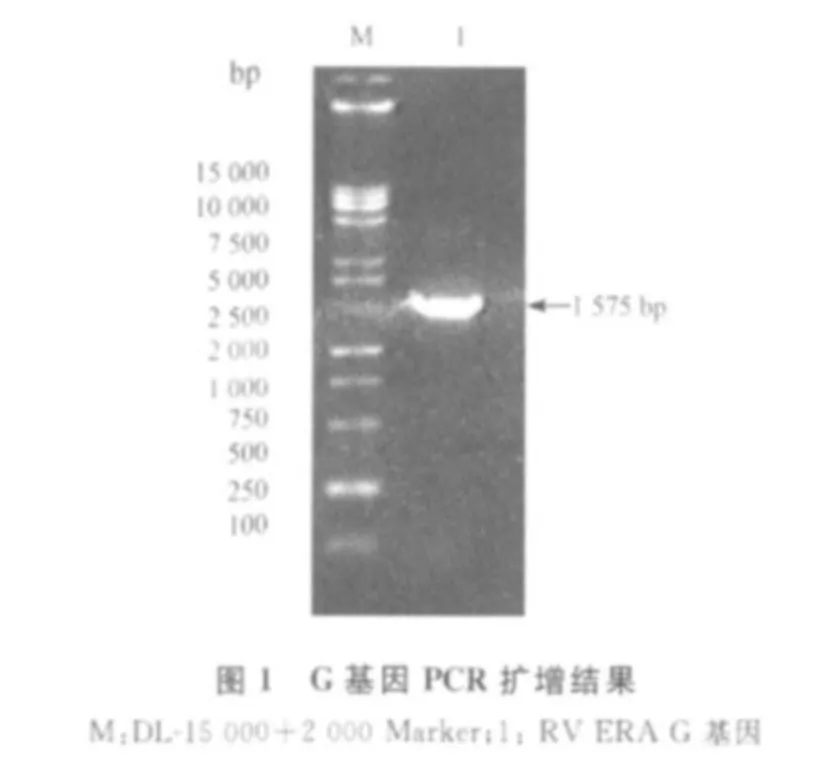
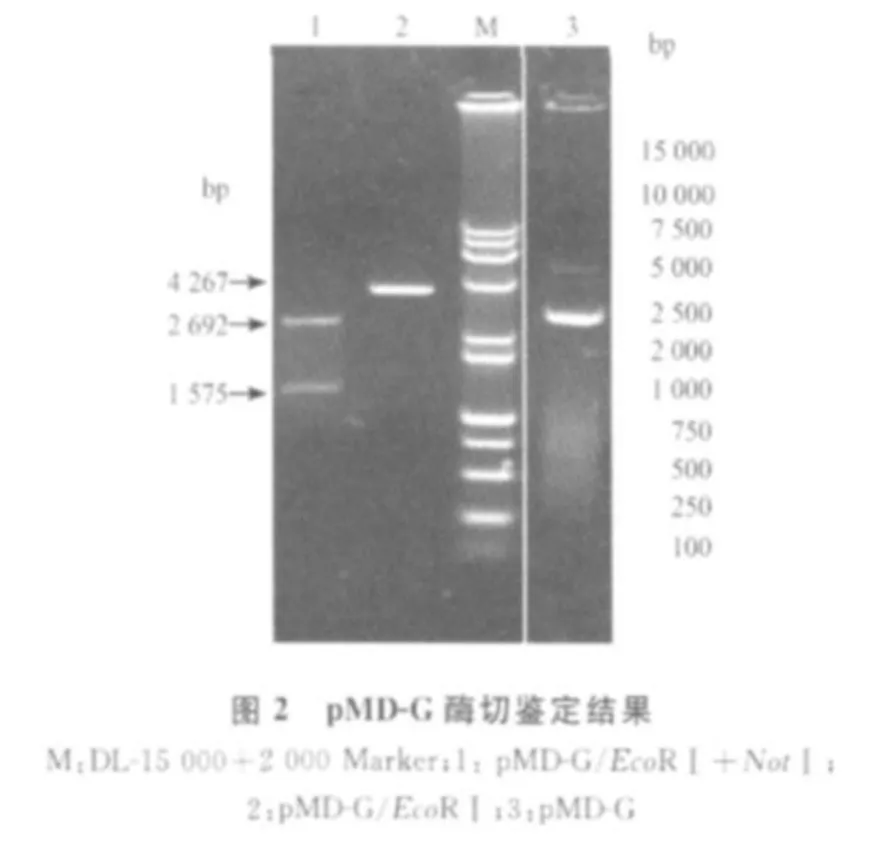
2.1 G基因的扩增与克隆 RT-PCR产物经琼脂糖凝胶电泳分析,扩增产物与预期大小一致(图1)。回收该片段,用pMD18-T载体克隆,筛选得到重组质粒pMD-G,经EcoRⅠ酶切,得到约4267 bp的DNA大片段;经EcoRⅠ和 NotⅠ双酶切,得到约1575 bp的插入DNA片段和2692 bp的载体大片段,表明G基因已克隆入 T载体中(图2)。以pMD-G为模板,用特异性引物进行PCR扩增,得到了1575 bp大小的核酸片段,表明已正确克隆了G基因。
2.2 序列测定结果及ERA株与其他毒株G基因核苷酸及推导的氨基酸序列同源性比较 序列测定结果,RV ERA株G蛋白基因全长1575 bp,编码524个氨基酸。分析表明,在推导的G蛋白氨基酸序列中,第1~19位和440~461位氨基酸是两个明显的疏水区,前一个疏水区构成该蛋白的信号肽序列,后一疏水区推测是该蛋白的跨膜区。测序结果与GenBank登录的RV ERA株核苷酸序列完全一致,说明本室保存的毒株在连续传代过程中没有发生变异。
ERA株与GenBank中发表的其他基因 I型RV毒株相比,G基因核苷酸的同源性为89.1%~99.1%,推导氨基酸序列的同源性为89.7%~99.3%。序列比较发现,不同RV各固定毒株糖蛋白的氨基酸同源性有一定的差异,其中穿膜区和膜内区差异较大(同源性50%~60%),而膜外区的保守性略高(同源性大于90%)。
2.3 糖基化位点与神经毒性残基分析 用PROSITE软件分析发现,推导的RV ERA株G蛋白上存在3个潜在的N-联糖基化位点(Asn37,247,319),与RV其他毒株相比糖基化位点数目和部位略有差异(CVS株为Asn37,319;PV株为Asn37,158,247,319;HEP株为Asn37,158,204,319;Kelev株为 Asn37,319;Mokola株 Asn202,319),其中第Asn37位糖基化位点为基因I型RV共同拥有的,而Asn319位糖基化位点为多数野毒株和固定毒株共同拥有的。
糖蛋白神经毒性残基分析,ERA株、PV株和CVS株均为Arg333;HEP株为Glu333;Kelev株为Gln333;Mokola为Asp333。
2.4 G蛋白主要抗原表位分析 RV ERA株与SRV9、PV和CVS等标准毒株相比较,G蛋白在疏水性、Jameson-Wolf抗原表位和表面极性均有其明显的特点。Jameson-Wolf抗原表位分析表明,与PV-11相比,在175-183位氨基酸残基上抗原表位指数明显升高;CVS相比,在145-154、423-430、492-500位氨基酸残基上抗原表位指数明显升高,而在380-392位氨基酸残基上抗原表位指数明显降低;与SRV-9相比,在 185-195位、273-280位氨基酸残基上抗原表位指数明显降低。
另外,在推导的RV ERA株G蛋白序列N端260~267位氨基酸也存在一个非常保守的序列‘LHDFRSDE',此序列是G蛋白抗原表位V-线性表位的核心,该表位由位于254~275位的氨基酸残基组成,在目前所测序的毒株(包括固定毒株和分离株)中均非常保守。
3 小结与讨论
3.1 成功克隆和表达了狂犬病病毒ERA株G基因。糖蛋白位于狂犬病病毒分子表面,是病毒的保护性抗原,占病毒总蛋白的40%。其糖基化位点与神经毒性残基分析结果表明,由于该疫苗株存在Asn319位糖基化位点,与多数野毒株和固定毒株共同拥有的;并且,糖蛋白第333位氨基酸为神经毒性残基Arg333,因此全病毒有一定的潜在神经毒性,只可用于灭活疫苗的制备。由于RV ERA株糖蛋白有明显的优势抗原表位,因此可用G基因作为靶基因研制安全有效的基因工程疫苗。
3.2 狂犬病是人类和多种动物致死性中枢神经系统传染病。在我国狂犬病发生主要分布在南方部分省区,且近几年呈上升趋势,稳居我国法定报告传染病发病总数和死亡总数之第二位,病死率和死亡率则位居各传染病首位,犬是最主要的储存宿主和传播宿主。因此研制安全有效的兽用疫苗和建立特异敏感的快速诊断方法对于防制狂犬病是非常必要的。我们对RV ERA株进行了详细的分子生物学研究,对该毒株G、N等两种主要结构蛋白基因进行了克隆和序列分析,并进行了表达,其目的为进一步研制安全有效的基因工程疫苗和快速诊断试剂,奠定良好的基础。
[1]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:777-795.
[2]俞永新.狂犬病和狂犬病疫苗[M].北京:中国医药科技出版社,2001:1-16.
[3]Wiktor T J,Flamand A,Koprowski H.Use of monoclonal antibodies in diagnosis of rabies virus infection and differentiation of rabies and rabies-related viruses[J].J Virol Methods,1980,1:33-46.
[4]Rupprecht C E,Dietzschold B,Wunner W H,et al.Antigenic relationships of Ly ssaviruses.[M]//Baer G M.The natural history of rabies.Boca Raton:CRC Press,1991:69-100.
[5]Bourhy H,Kissi B.Molecular diversity of the Lyssavirus genus[J].Virology,1993,194:70-81.
[6]Heaton P R,Johnstone P,MacElhinney L M,et al.Hemi-nested PCR assay for the detection of six genotypes of rabies and rabiesrelated viruses[J].J Clin Microbiol,1997,35:2763-2766.
[7]Gould R A,Hyatt A D,Lunt R,et al.Characterization of a novel Ly ssavirus isolated from Pteropid bats in Australia[J].Virus Res,1998,54:165-187.
[8]Badrane H,Bahloul C,Perrin P,et al.Evidence of two Lyssavirus phylogroups with distinct pathogenicity and immunogenicity[J].J Virol,2001,75:3268-3276.
[9]Lentz T L,Wilson P T,Hawrot E,et al.Amino acid sequence similarity between rabies virus glycoprotein and snake venon curaremintic neuratoxins[J].Science,1984,226:847-848.
[10]Lodmell D L,Smith J S,Esposito J J.Cross-protection of mice against a global spectrum of rabies virus variants[J].Virology,1995,69(8):4957-4962.
[11]卢圣栋.现代分子生物学实验技术[M].北京:中国协和医科大学出版社,1993:382-386.
[12]萨姆布鲁克J,弗里奇E F,尼阿蒂斯 T.分子克隆实验指南[M].2版.金冬雁,黎孟枫,侯云德,等译.北京:科学出版社,1998:888-898.

