奶牛乳汁体细胞数的快速检测及其临床意义
杨红英,高 健,刘修权,苏敬良,韩 博
(1.宁夏吴忠市动物疾病预防控制中心,宁夏 吴忠 751100;2.中国农业大学动物医学院,北京 海淀 100193)
乳汁体细胞数是反映奶牛隐性乳房炎的一个重要指标,我国规定隐性乳房炎的判定标准为体细胞数大于50万/mL。目前,检测奶样体细胞数的方法包括间接计数法和直接计数法。间接计数法包括加州乳房炎检测法(CMT)及其衍生的北京乳房炎检测法(BMT)、上海乳房炎检测法(SM T)[1]等,均属定性计数,多依靠检测者的经验而定,结果不够精确。直接计数法包括体细胞电子计数法(ESCC)、桶奶细胞计数法(BMCC)、牛只细胞计数法(ICCC)等[2],可对SCC进行定量检测,但是检测费用高,使用不方便。便携式体细胞计数仪C-Reader[3]由韩国研制,具有价格低廉、轻巧便携、操作方便和快速准确等特点,能精确测定SCC。本试验旨在用便携式体细胞计数仪C-Reader,定量检测奶样中的SCC,以此快速判定奶牛隐性乳房炎,从而及时制定治疗方案,减少乳房炎引起的损失。
1 材料与方法
1.1 待检奶样 自2008年3月份至2008年8月份选择北京及河北地区10个牛场的111头无乳房炎症状奶牛,无菌采集428份乳汁,置于冰盒送回实验室,做SCC检测。
1.2 主要仪器 便携式体细胞计数仪C-Reader(韩国Digital Bio Technology公司),立式压力蒸汽灭菌器(上海博讯公司),电热恒温鼓风干燥箱DHX-9073B型(上海福玛设备有限公司),电热恒温培养箱(上海福玛设备有限公司),台式离心机(上海安亭科学仪器厂),光学显微镜(Olympus公司),超净工作台(苏州净化设备有限公司),奶样瓶(北京奶牛中心)。
1.3 培养基及相关试剂 普通琼脂培养基,麦康凯琼脂培养基,7.5%氯化钠甘露醇琼脂培养基,KF链球菌琼脂,营养肉汤培养基,肠杆菌科细菌生化编码鉴定管GYZ-15 e,葡萄球菌属细菌生化编码鉴定管TH-16 S(杭州天和微生物试剂有限公司),TSA琼脂,TSB肉汤(美国BD公司),靛基质,苯丙氨酸,硝酸盐还原试剂,葡萄糖酸盐,甲基红(MR),马尿酸盐,溴甲酚紫、溴麝香草酚蓝,液体石蜡、丙三醇等(杭州天和微生物试剂有限公司),BMT诊断液(北京奶牛中心),含5%去纤维绵羊血的TSA和普通琼脂平板均自行配制。
1.4 体细胞数检测 采集A牛场53份奶样,同时用BMT法和C-Reader对其体细胞数进行定性和定量检测。BMT法是根据测试盘上有无絮状物及沉淀程度来判定结果(判断标准见表1);C-Reader可直接显示出奶样中的体细胞数。
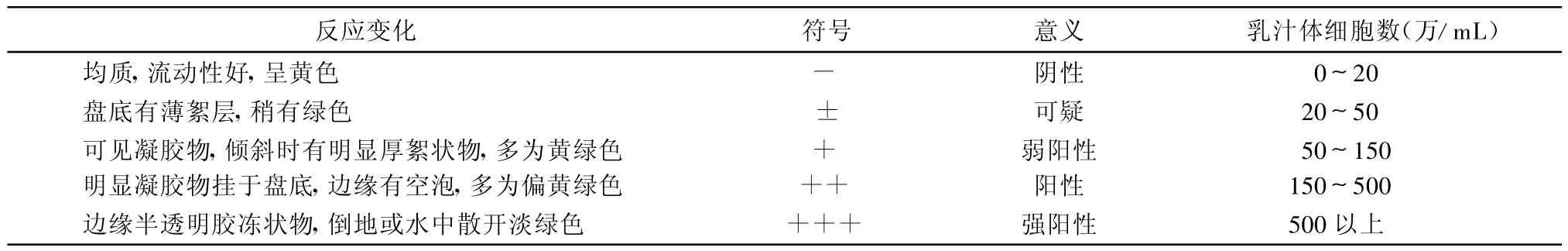
表1 BMT法判断隐性乳房炎的标准
1.5 隐性乳房炎奶样的致病菌分离鉴定 将每份隐性乳房炎奶样(SCC>50万/mL)5mL加入15mL离心管中,6000 r/min离心5 min,弃上清,无菌取0.1mL干酪样沉淀接种于5%去纤维绵羊血-TSA培养基,37℃培养24 h。挑取特征菌落于TSB肉汤中增菌培养18 h,然后分别接种于麦康凯琼脂培养基、7.5%氯化钠甘露醇琼脂培养基、KF链球菌琼脂培养基进行纯化培养。纯化培养物进行革兰染色镜检,初步判定致病菌的种属。挑选纯化好的单个菌落接种于微量发酵管中,37℃培养24~72 h,做生化鉴定。
2 结果与分析
2.1 BMT法与C-Reader法定性和定量检测53份奶样的SCC。见表2。

表2 A牛场乳汁BMT法和C-Reader计数法检测SCC (×105cells/mL)
从表2看出,53份奶样分别用C-Reader法和BMT法进行定量和定性检测,45份检测结果是相符的,相符率仅为84.9%。由于BM T法通常是检测者依其个人经验主观判断,因而使结果造成较大的误差。C-Reader法能客观精确地定量测定乳汁中的体细胞数,准确地反应隐性乳房炎的发病率。
2.2 北京及河北地区10个牛场的隐性乳房炎发病率 隐性乳房炎头发病率是至少有一个乳区为隐性乳房炎的奶牛头数占检测的所有奶牛数的百分比。乳区发病率指采集的隐性乳房炎的奶样占总奶样数的百分比。测试结果见表3、表4和图1。

表3 各牛场的隐性乳房炎头发病率
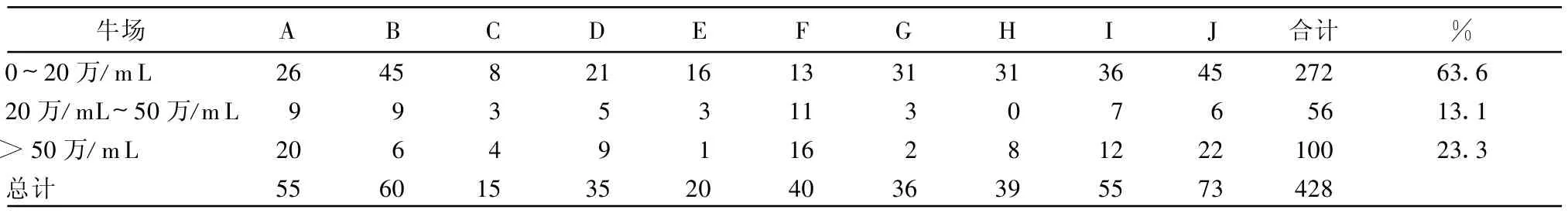
表4 各牛场体细胞数0~20万/mL、20万/mL~50万/mL及50万/mL以上的奶样数
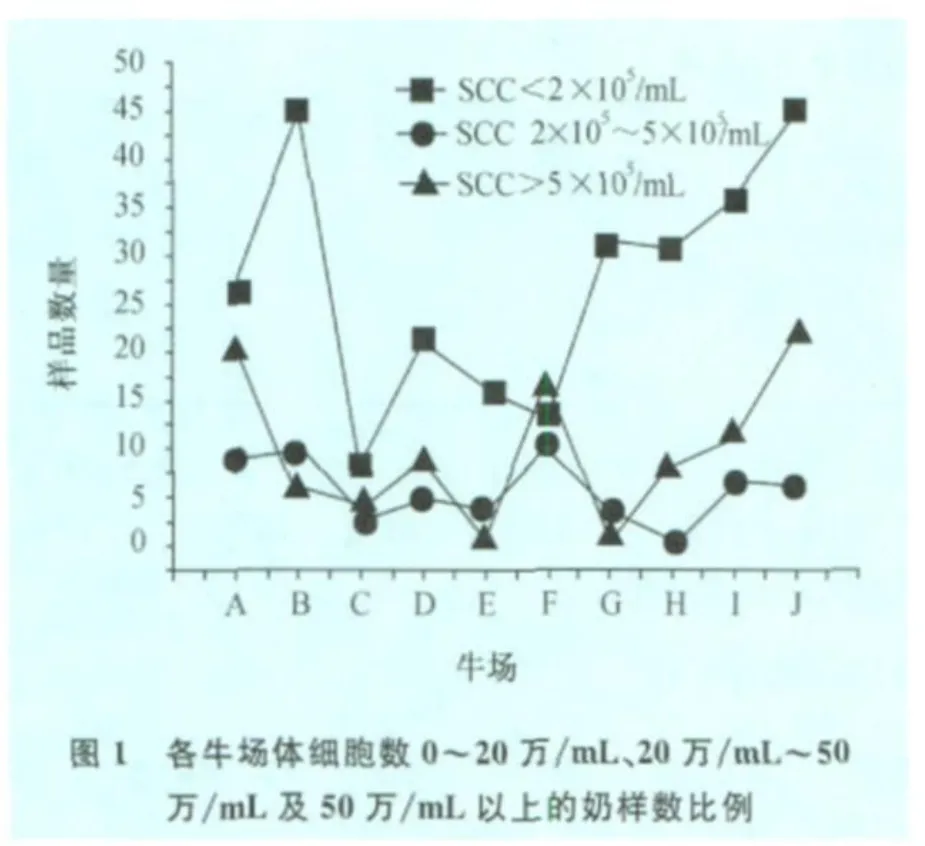
从表3和表4可知,北京及河北地区的隐性乳房炎头发病率为54.1%,乳区发病率为23.3%。比杨章平等报道的发病率低[4]。各牛场的发病率差异较大,乳区发病率比头发病率更能客观地体现出牛场的隐性乳房炎发病情况。由图1可知,除F牛场外,其他9个牛场体细胞数在0~20万/mL的奶样比例均明显高于体细胞数在20万/mL~50万/mL的奶样比例。10个牛场体细胞数0~20万/mL的奶样占63.6%,而20万/mL~50万/mL的奶样占13.1%,前者比例远高于后者。
2.3 奶牛隐性乳房炎致病菌的分离及鉴定 100份隐性乳房炎奶样接种5%去纤维绵羊血-TSA培养基,82份奶样细菌培养为阳性,阳性率为82.0%。其中,在5%去纤维绵羊血-TSA培养基上,64份奶样有1种特征性致病菌生长,占78.0%;15份奶样有2种特征性细菌生长,占18.3%;仅有3份奶样有3种特征性致病菌生长,占3.7%。
分离到的主要致病菌金黄色葡萄球菌、大肠杆菌、链球菌在5%去纤维绵羊血-TSA培养基、麦康凯琼脂培养基、7.5%氯化钠琼脂培养基和KF链球菌培养基上的形态特征和革兰染色结果见表5。

表5 乳汁分离菌株的平板培养特性及革兰染色结果
隐性乳房炎主要致病菌所占比例:经过致病菌的选择性培养和生化鉴定,对采集的100份隐性乳房炎乳样接种培养,致病菌培养阳性率为82.0%。在分离得到的103株致病菌中,鉴定出了7个种属的100株致病菌。包括金黄色葡萄球菌64株(64.0%),表皮葡萄球菌11株(11.0%),大肠杆菌8株(8.0%),无乳链球菌8株(8.0%),停乳链球菌2株(占2.0%),伤寒沙门菌 5株(占 5.0%),肺炎克雷伯氏菌2株(2.0%)。见图2。
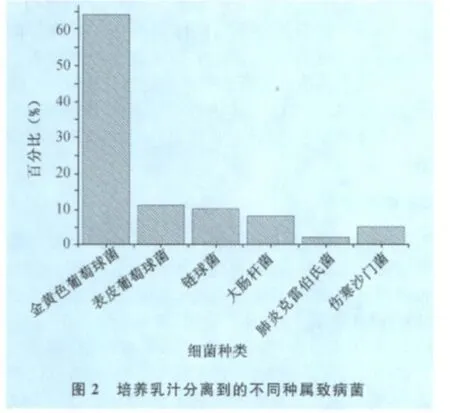
上述结果显示,在北京及周边牛场中,引起隐性乳房炎的最主要致病菌为金黄色葡萄球菌。这与李宏胜[5]报道的停乳链球菌占37.78%、大肠杆菌占24.34%、无乳链球菌占15.56%、金黄色葡萄球菌占13.33%、绿脓杆菌占4.44%、克雷伯氏菌占2.22%和变形杆菌占2.22%和易本驰[6]报道的葡萄球菌占35.63%,链球菌占14.94%,革兰阴性杆菌占49.43%差异较大。这主要与抗生素普遍应用使链球菌所占比例有较大程度的降低[7]和地域性对致病菌种属变化影响较大有关[8]。总之,本试验用C-Reader对北京及河北地区的奶牛隐性乳房炎进行了快速定量检测,并对引起隐性乳房炎的主要致病菌进行了分离及鉴定,指出北京及河北地区导致隐性乳房炎的致病菌主要是金黄色葡萄球菌。
[1]雷晓薇,王根林,韩兆玉.应用体细胞计数监测奶牛隐性乳房炎[J].畜牧与兽医,2003,35(12):35-37.
[2]欧阳五庆,唐光武,席文平,等.牛、羊隐性乳房炎快速诊断法研究-SMT法和BMT法的效能比较[J].黑龙江畜牧兽医,1995(5):12-14.
[3]Moon J S,Koo H C,Joo Y S,et al.Application of a new portable microscopic somatic cell counter with disposable plastic chip for milk analysis[J].J Dairy Sci,2007,90:2253-2259.
[4]杨章平,王健,丁焕峰,等.奶牛隐性乳房炎的发生规律的研究[J].中国奶牛,1998(1):18-21.
[5]李宏胜.我国部分地区个体奶牛场乳房炎流行病学调查[M].兰州:甘肃农业大学,2004:7.
[6]易本驰.奶牛隐性乳房炎的流行病学及病原调查[J].中国畜牧兽医,2006,33(12):37-38.
[7]Forsman P,Tilsala-Timisjarvi A,Alatossava T.Identification of staphylococcal and streptococcal causes of bovine mastitis using 16S-23S rRNA spacer regions[J].Microbiology,1997,143:3491-3500.
[8]Fournier C,Kuhnert P,Frey J,et al.Bovine staphylococcus aureus:association of virulence genes,genotypes and clinical outcome[J].Research in Veterinary Science,2008,85:439-448.

