复方地利乳膏的制备及含量测定
陈立,陈宇星,林佳(.福建医科大学省立临床医学院/福建省立医院,福州市35000;.福建中医学院药学系,福州市35008)
神经性皮炎是一种临床常见的皮肤功能障碍性疾病,具有明显的皮肤损害,症状主要表现为剧烈瘙痒,故可严重影响患者的生活质量。临床使用地塞米松磷酸钠与盐酸利多卡因进行皮下浅层局部注射给药治疗,疗效显著。其中地塞米松磷酸钠具有抗炎抗过敏的作用,可减轻和防止组织对炎症的反应,从而减轻炎症的表现;盐酸利多卡因作为公认的强效局部麻醉药,可阻断神经传导,用于皮肤局部镇痛及麻醉,减少剧烈瘙痒给患者带来的痛苦。但上述给药方法具有一定的局限性:(1)皮下浅层注射要严格掌握其深浅度,患者无法自行给药;(2)其为创伤性给药,部分患者会产生恐惧心理从而影响给药的依从性。因此,将地塞米松磷酸钠、盐酸利多卡因作为主成分制成乳膏,可直接涂于神经性皮炎的皮损部位[1],避免上述给药方式带来的局限性。为此,本文就其制备及含量测定方法报道如下。
1 材料
1.1 仪器
LC-2010AHT型高效液相色谱(HPLC)仪(日本岛津公司);pH计(瑞士Mettle-toledo公司);JB-2型溶液软膏搅拌器(上海崇明东平医药设备厂);KQ-500B型超声波清洗器(昆山市超声仪器有限公司);TU-1221型紫外-可见分光光度仪(北京普析通用仪器有限责任公司)。
1.2 试药
地塞米松磷酸钠标准品(批号:100016-200712,含量:91.1%)、盐酸利多卡因标准品(批号:100341-200301,含量:93.5%)均由中国药品生物制品检定所提供;复方地利乳膏(福建省立医院自制,批号:20090318、20090319、20090320,规格:每50 g含盐酸利多卡因0.5 g、地塞米松磷酸钠0.05 g);地塞米松磷酸钠原料药(天津天药药业股份有限公司,批号:DNa081001,含量:98.1%);盐酸利多卡因注射液(上海禾丰制药有限公司,批号:081206,规格:每5 mL含盐酸利多卡因0.1 g);三乙胺、甲醇、乙腈均为色谱纯;其它试剂为分析纯。
2 处方与制备
2.1 处方
盐酸利多卡因10 g、地塞米松磷酸钠1 g、单硬脂酸甘油酯70 g、液体石蜡100 g、蜂蜡25 g、硬脂酸80 g、甘油120 g、羟苯乙酯1 g、乳化剂辛基苯酚聚氧乙烯醚(OP)30 g、薄荷醇适量,纯化水加至1000 g。
2.2 制备
采用乳化剂后加法,称取处方量各成分置于同一容器中,加热至92~95℃,于搅拌器下搅拌,转速300~350 r·min-1;当温度降至80~84℃时,加入乳化剂OP,继续搅拌,待温度降至40℃以下时,加入薄荷醇,搅拌至冷凝,即得。
3 含量测定[2,3]
3.1 色谱条件与系统适用性试验
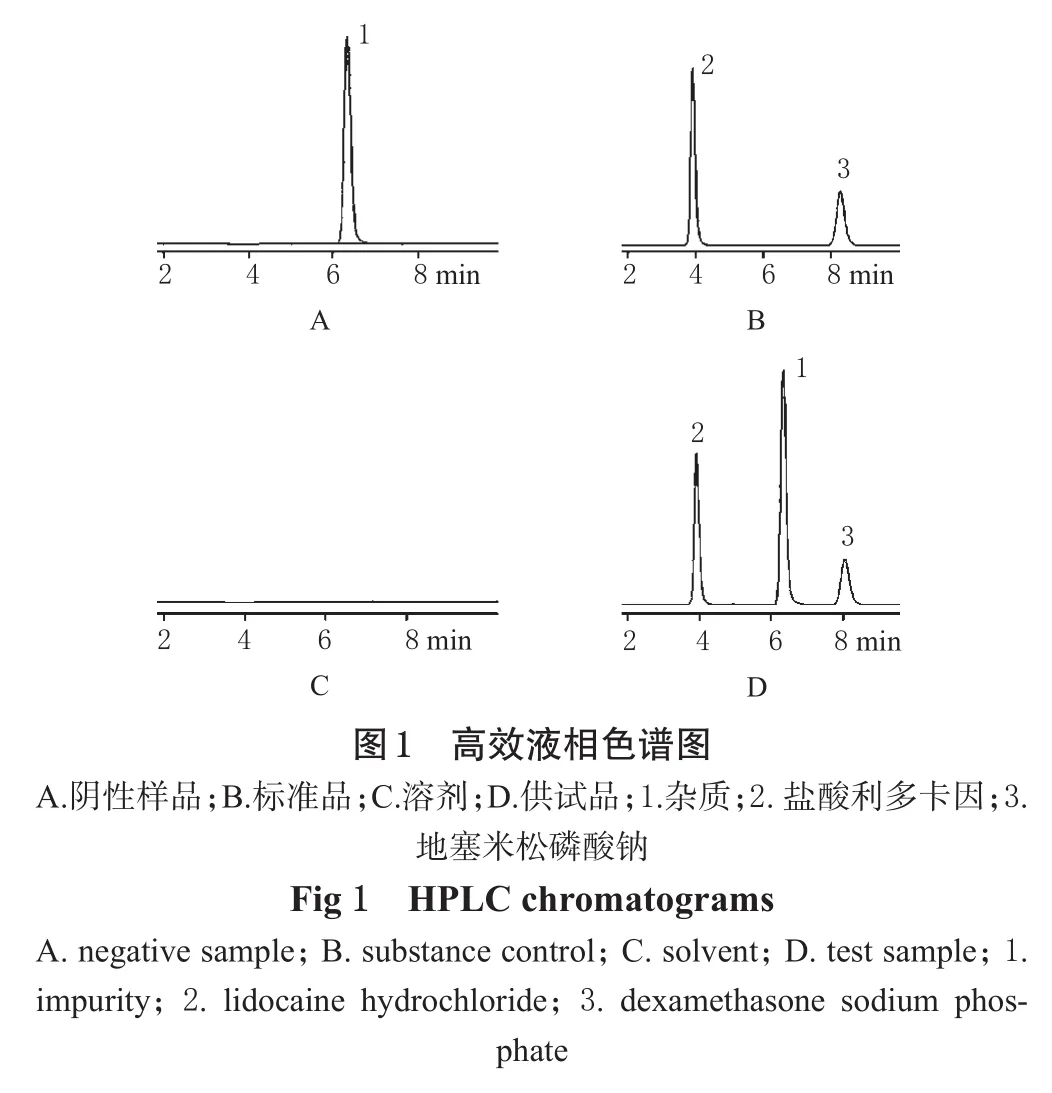
色谱柱:HYPERSIL ODS-2(250 mm×4.6 mm,5 μm);流动相:0.75%三乙胺溶液(磷酸调节pH至3.0)-甲醇-乙腈(45∶55∶5);检测波长:242 nm;进样量:20 μL;流速:1.0 mL·min-1。理论板数按地塞米松磷酸钠峰计大于5000,盐酸利多卡因大于3000,2主峰与杂质峰的分离度均大于4,2主峰间的分离度大于12。取“3.2”项下3种溶液以及溶剂(流动相)在该色谱条件下进样,色谱见图1。
3.2 溶液的制备
3.2.1 标准品溶液的制备:精密称取地塞米松磷酸钠标准品约10 mg,置于25 mL容量瓶中,加流动相稀释至刻度,摇匀,得甲液;精密称取盐酸利多卡因标准品约20 mg,置于50 mL容量瓶中,并从甲液中精密量取5 mL至上述容量瓶中,加流动相稀释至刻度,摇匀,作为标准品溶液。
3.2.2 供试品溶液的制备:精密称取样品约1 g,置于25 mL容量瓶中,加流动相适量,超声10 min后,加流动相至刻度;将其置于水浴中加热30 min后,冷却至室温;过滤,取续滤液作为供试品溶液。
3.2.3 阴性样品溶液的制备:按处方量制备不含2主药的空白基质,同“3.2.2”项下方法制备,得阴性样品溶液。
3.3 专属性试验
取溶剂(即流动相)与“3.2”项下3种溶液,按“3.1”项下色谱条件进行测定,色谱显示供试品溶液出现的2主峰与标准品溶液出现的2主峰的保留时间均一致,阴性样品溶液在2主峰位置处均未出现其它的杂质峰,说明此方法可避免其它成分和辅料的干扰,可用于样品中地塞米松磷酸钠与盐酸利多卡因的含量测定。色谱见图1。
3.4 线性关系考察
取同一份标准品溶液,以流动相稀释成含地塞米松磷酸钠32.38、36.43、40.47、44.52、48.58 μg·mL-1及盐酸利多卡因304.16、342.18、380.20、418.22、456.24 μg·mL-1的系列浓度溶液,按“3.1”项下色谱条件进样,记录色谱,以标准品浓度(C,μg·mL-1)为横坐标,峰面积(A)为纵坐标,进行线性回归,得地塞米松磷酸钠、盐酸利多卡因的回归方程分别为A地=32001C地-18536(r=0.9999)、A利=5291.1C利-27668(r=0.9999)。结果表明,地塞米松磷酸钠、盐酸利多卡因检测浓度的线性范围分别为32.38~48.58 μg·mL-1、304.16~456.24 μg·mL-1。
3.5 精密度试验
取同一份标准品溶液,按“3.1”项下色谱条件,连续进样6次,记录色谱,以峰面积计算。结果,得地塞米松磷酸钠、盐酸利多卡因的RSD分别为0.08%、0.21%,表明进样精密度良好。
3.6 重复性试验
取同一批样品共称取6份,按“3.2.2”项下方法制备供试品溶液,并按“3.1”项下色谱条件进行测定,以地塞米松磷酸钠与盐酸利多卡因的含量计算。结果,地塞米松磷酸钠、盐酸利多卡因的RSD分别为0.5%、0.3%(n=6),表明方法重复性良好。
3.7 稳定性试验
取样品1份,约1 g,按“3.2.2”项下方法制备供试品溶液,并按“3.1”项下色谱条件于0、2、4、6、24 h内进行测定,测得地塞米松磷酸钠、盐酸利多卡因的RSD分别为0.05%、0.07%,表明供试品溶液在24 h内稳定性良好。
3.8 回收率试验
取空白基质9份,约1 g,精密加入不同比例处方量的地塞米松磷酸钠、盐酸利多卡因标准品,按“3.1”项下方法测定含量,计算回收率,结果见表1。
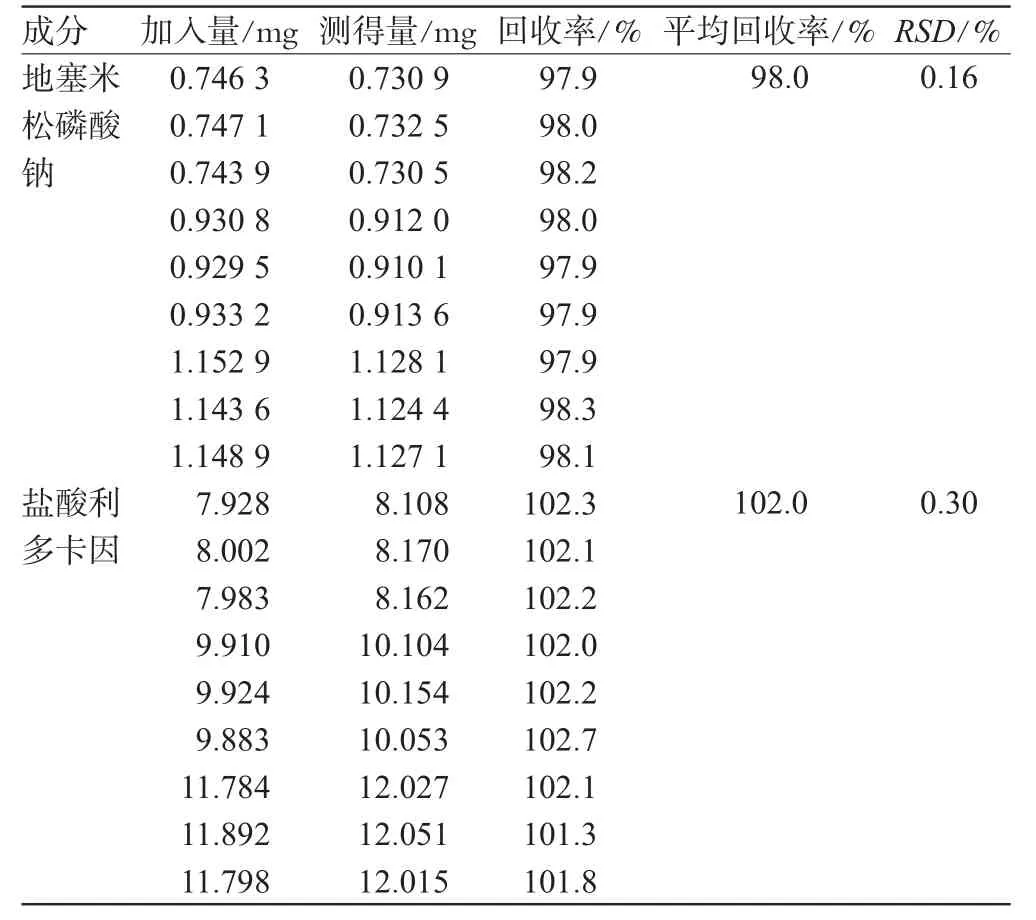
表1 回收率试验结果Tab 1Results of recovery test
3.9 样品含量测定
分别取3批样品,按“3.2.2”项下方法制备供试品溶液,再按“3.1”项下条件进样,测定并计算含量,结果见表2。

表2 样品标示含量测定结果Tab 2Determination of labeled contents of samples
4 讨论
4.1 处方设计
制剂中地塞米松磷酸钠具有抗炎、抗过敏、免疫抑制等作用,可减轻炎症表现;盐酸利多卡因具有较强的弥散力和组织穿透性,可抑制瘙痒与疼痛,且作用快,持续时间长,还可改善局部血流;薄荷醇具有止痒止痛、促透、增强麻醉的作用。三者相辅相成,在减轻炎症的同时,还能缓解瘙痒、皮损后疼痛的症状,另盐酸利多卡因的改善局部血流作用还可加快皮肤组织的修复。
本品在基质的选择上采用水包油(O/W)型乳膏基质,该基质质地细腻、有光泽感,具有适当的黏稠性,易均匀涂布于皮肤或黏膜上,不融化,但能软化。因O/W型乳膏基质具有易洗除、穿透性好、易发挥药效等作用而成为透皮给药的理想基质[4]。
本乳膏以硬脂酸与单硬脂酸甘油酯为辅助乳化剂,OP为主要乳化剂。OP制成的乳膏能形成一层乳化膜,增加乳膏的保湿作用,其稳定性高,不易受强电解质、无机盐类的影响,耐酸、耐碱、耐热方面均显示优良特性。因此,由其制得的乳膏稳定性好并具有光泽,表明OP是一种优良的乳化剂[5]。
4.2 乳膏制备
常规的O/W型乳膏的制备,是将乳化剂按其性质加入到相应的水相或油相中。为提高其乳化成功率,本品采用乳化剂后加法制备,即:当油相加入水相充分搅匀后,在搅拌下,加入OP。此法所制得的基质质地细腻、光泽性好,操作轻松、简便,工艺可控[6]。
由于薄荷醇遇热易挥发,故本品在制备过程中薄荷醇应以温度降至40℃时加入为宜。
搅拌速度也是制备乳膏的一个重要方面。搅拌速度过快易产生大量气泡,过慢又容易析出粗颗粒。曾有报道[7]提出:搅拌速度可按照基质中水相量的多少来调节:量多(水相量大于75%)以300~600 r·min-1为宜,量较多(水相量在65%~75%)以600~900 r·min-1为宜。本处方水相量为72%,考虑到试验阶段为小处方量,其转速降低为350 r·min-1,制得的乳膏质量良好、性质稳定;在显微镜下观察,乳滴均匀分布,偶见小水泡。
4.3 含量测定
在选择含量测定方法时,曾利用紫外分光光度法测定本品含量,此法简单且能在实验室现有条件下完成,但通过紫外扫描,发现2主分间存在干扰,无法测定。为寻找一种合适、简便的含量测定方法,经参考2005年版《中国药典》收载的地塞米松磷酸钠与盐酸利多卡因含量测定方法,拟改用HPLC法[8]。在HPLC法的预试验阶段,因考虑到2者的最大吸收波长比较接近,故选择梯度洗脱进行分离测定,结果,虽然2成分能够被分离开,但二者分离时间相差甚远,盐酸利多卡因在5 min时洗脱出柱,而地塞米松磷酸钠在20 min才开始洗脱分离。有关资料[9]显示,在流动相(三乙胺-甲醇-乙腈为55∶40∶5)下,地塞米松磷酸钠的出峰时间应在6 min左右。考虑到试验效率等方面问题,决定参考2005年版《中国药典》,采用2种流动相系统,对2组分分别进行测定[8]。结果发现,2主分在流动相(三乙胺-甲醇-乙腈为55∶40∶5)下也能被洗脱分离,且出峰时间减少;通过微调流动相的比例,发现增加甲醇的量有助于地塞米松磷酸钠提早出柱,对盐酸利多卡因则影响不大,故最终选择(三乙胺-甲醇-乙腈=40∶55∶5)作为流动相体系。在该流动相体系下,盐酸利多卡因在4 min出柱,地塞米松磷酸钠在8 min出柱;2个峰之间还存在一较大吸收的杂质峰,可能为羟苯乙酯。
用HPLC法测定本制剂中2成分含量,不仅专属性强,精密度、重复性均高,且方法准确、快速。经方法学验证,表明本法可用于复方地利乳膏的含量测定。
[1]刁雨辉,袁荣刚,周建平.复方利多卡因乳膏体外透皮吸收研究[J].中国药科大学学报,2002,33(6):489.
[2]沈少林.盐酸利多卡因乳剂的制备与质量控制[J].中国药房,2006,17(1):29.
[3]钱方,黄伟.HPLC法测定复方地塞米松乳膏中地塞米松的含量[J].药学服务与研究,2002,2(4):253.
[4]吕东.皮肤外用软膏基质变更的考虑要素[J].中国新药杂志,2008,17(12):1085.
[5]沈鸿,张继明.乳膏基质不同处方的筛选[J].中国医院药学杂志,2005,25(9):877.
[6]李艳民,郑林,林滔.3种乳化法对水包油型乳膏基质质量的影响[J].中国实用医药,2008,3(26):172.
[7]钟松阳.O/W乳膏基质配制方法的改进及质量考察[J].西北药学杂志,2002,17(2):75.
[8]国家药典委员会编.中华人民共和国药典(二部)[S].2005年版.北京:化学工业出版社,2005:185.
[9]范玉峰,詹新卫,胡守莲,等.HPLC法测定复方地塞米松丁卡因乳膏中醋酸地塞米松和盐酸丁卡因的含量[J].中国药事,2007,21(8):596.

