血友病A的基因诊断研究
李茹 韩瑾 李东至 廖灿
(广州市妇女儿童医疗中心,广东广州 510623)
血友病A(hemophilia A,HA)又称甲型血友病,是最常见的1种遗传性出血性疾病,在男性中的发病率为1/5 000~/10 000[1],约占先天性出血性疾病的85%。HA是由凝血因子VIII(F8)基因缺陷引起,导致凝血因子VIII含量不足或功能缺陷而造成凝血障碍,呈X连锁隐性遗传方式。根据患者血浆凝血因子VIII促凝活性及症状严重程度可分为轻、中、重3型,分别占 HA 患者的40%、10%和50%[2]。目前,HA尚无有效根治疗法,开展HA携带者检测和产前诊断,阻断致病基因传递,防止新的HA患儿出生,是降低HA发病率的有效办法。
为提高HA携带者和患者的检出率,本研究联合应用倒位PCR(inversion-PCR,I-PCR)、序列特异性PCR、高分辨熔解曲线分析法(high-resolution melting,HRM)、DNA测序等方法进行F8基因缺陷检测,对所有研究对象进行了直接基因诊断,现报道如下。
1 材料与方法
1.1 研究对象 7例HA患者及相关家系成员(包括患者5例,其中1例患者的母亲和1例患者的姐姐)和1例产前诊断样本均由广州市妇女儿童医疗中心遗传咨询门诊和血液科提供。
1.2 DNA提取 患者及家系成员取静脉血4 ml,1例产前诊断病例在孕27周时经腹穿刺抽取脐带血2 ml,均用EDTA抗凝。DNA提取采用血液基因组DNA提取试剂盒(天根生化科技有限公司,TIANGEN)。
1.3 检测方法
1.3.1 I-PCR检测内含子22倒位 引物设计和反应条件参照文献[3,4],根据扩增产物的片段长度进行判断。正常人的I-PCR产物片段为487 bp,内含子22倒位者产物片段为559 bp,倒位携带者产物片段为487 bp和559 bp 2条带。
1.3.2 PCR检测内含子1倒位 对内含子22倒位阴性者,进一步检测内含子1倒位。按文献[5]方法操作,分别扩增F8基因内含子1中的Int1h-1片段及F8基因外的Int1h-2片段,产物经琼脂糖凝胶电泳后观察电泳条带。对int1h-1片段,若PCR产物片段长为1908 bp为正常,1323bp为倒位,携带者有此2条带;对int1h-2片段,若产物片段长为1191 bp为正常,1776 bp为倒位,携带者有此2条带。
1.3.3 HRM和DNA测序检测点突变 对内含子22和1倒位阴性者,首先将男性患者的DNA与正常男性的DNA以1:1比例混合,引物设计和反应条件参照文献[6,7],PCR扩增F8基因所有外显子及外显子-内含子交界区,然后应用高分辨熔解曲线分析仪LightScanner进行突变扫描,对筛查阳性片段进一步作测序分析确定致病突变。
2 结果
2.1 F8基因内含子22倒位 4例HA患者扩增得到559 bp的片段,为第22内含子倒位者,这其中1位患者的母亲扩增得到487 bp和559 bp2个片段,为倒位携带者。结果见图1。此倒位携带者母亲于孕27周抽取脐带血进行产前诊断,胎儿性别为男性,I-PCR扩增产物片段为559 bp,诊断为HA患者。余1例HA患者及其姐姐未检出内含子22倒位。
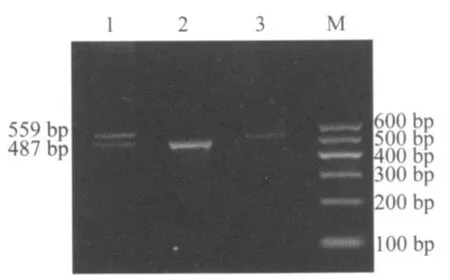
图1 I-PCR检测内含子22倒位电泳结果
2.2F8基因内含子1倒位 对未检出内含子22倒位的HA患者及其姐姐进行内含子1倒位检测。对int1h-1片段,PCR产物片段长1 908 bp,为正常;对int1h-2片段,PCR产物片段长为1 191 bp,为正常。因此排除内含子1倒位突变。结果见图2。

图2 PCR检测内含子1倒位电泳结果
2.3F8基因点突变 对上述内含子22和1倒位阴性的HA患者,采用HRM 进行突变扫描,结果显示第8外显子存在异常熔解曲线(图3),经直接测序分析鉴定为第329位密码子错义突变 TGT→TAT(图4),即 c.986G >A(p.Cys329Tyr)。此突变已在HAMSTeRS数据库有报导。该患者姐姐经检测确诊为此错义突变携带者(图4)。

图3 F8基因第8外显子HRM突变筛查结果
3 讨论
F8基因位于Xq28,大小约 186 kb,由26个外显子和25个内含子组成,mRNA大小约9kb,基因结构庞大。已知重型患者中近50%为内含子22的倒位突变[8],近年来发现内含子1倒位是仅次于内含子22倒位导致重型HA的常见原因[5,9]。除此之外,大部分患者则多为点突变,目前已知有797种(HAMSTeRS数据库),且无突变热点,多数散乱。
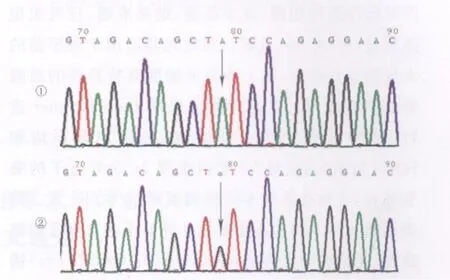
图4 F8基因第8外显子测序图部分序列
随着对血友病A分子基础的认识不断深入,该病的基因诊断技术也得到很大发展。F8基因突变的诊断方法主要分为2类:直接基因诊断和间接基因诊断。
血友病 A的直接基因诊断技术主要包括Southern 杂交、LD-PCR(long-distance PCR)、SSCP(single strand conformation polymorphism)、DGGE(denatured gradient gel electrophoresis)及DHPLC(denatured high performance liquid chromatography)等。对于最常见的内含子22倒位突变目前大多采用LD-PCR进行检测[10]。但 LDPCR专用酶及deaza-dGTP等的试剂价格昂贵,成本较高。近期出现的1种新技术即I-PCR,也用于检测第22内含子倒位,与LD-PCR相比,由于扩增产物片段较短,大大减小了扩增难度,而且该方法对DNA样本的要求较低[11]。其他突变种类则多为点突变,一般先采用SSCP、DGGE或DHPLC的方法筛查突变,然后经测序明确致病突变。
本研究采用I-PCR进行第22内含子倒位患者及携带者的检测,并成功完成了1例产前基因诊断。F8基因的突变筛查则采用HRM技术。HRM是近年来发展的1种用于突变扫描和基因分型的最新遗传学分析方法。它是1种高效稳健的post-PCR技术,不受突变碱基位点与类型的局限,无需序列特异性标记探针,PCR结束后直接运行熔解曲线分析,5分钟即可完成对样品的结果分析。这种方法因其操作简便快捷、成本低廉、结果准确,且可实现高通量(96或384孔板),因此尤其适用于测序前的大规模突变筛查,是1种高灵敏度高特异性的核酸突变筛查技术。本研究通过采用LightScanner进行HRM分析,可在2小时内(包括PCR反应和HRM分析)完成对F8基因全部26个外显子的突变筛查,且单孔单样本的检测成本仅为2.5元。筛查结果显示1例HA患者第8外显子存在异常熔解曲线,经测序确定为c.986G>A(p.Cys329Tyr)错义突变。致病突变和多态性位点都可以导致异常熔解曲线,因此应用HRM筛查得到异常熔解曲线时,须经测序以确定所检测到SNP(single nucleotide polymorphism)的性质。对于已知的SNP,可在数据库中检索以明确其性质;对于新发突变,还需在正常对照人群(家系中正常人及无血缘关系健康人)中作进一步筛查以确定其致病性。
血友病A的间接基因诊断即为家系连锁分析,主要依靠 RFLP(restrictionfragment length polymorphism)、STR(shorttandem repeat)、VNT R(variable number of tandem repeats)等多态性标记与致病突变等位基因的连锁关系及其向后代的传递情况进行诊断[12,13]。然而间接基因诊断存在显著局限性,如不能明确突变性质,可因基因内重组的发生而导致误诊,或家系成员无法提供多态信息等使诊断受到限制,对于新发、散在病例更无法诊断。
总的来说,由于现有技术的局限性,加上基因突变的多样性,部分家系在目前的条件下尚无法做出判断。特别是对于新突变造成的散发性血友病家系,诊断率更低。因此,HA的基因诊断不能只单独依靠1项检测手段。本研究即联合应用I-PCR、序列特异PCR、HRM、DNA测序技术实现了对所有研究对象的直接基因诊断。在临床实践中对于有先证者的家系,应首先对先证者依次进行以下检测:①采用I-PCR检测内含子22倒位;②排除内含子22倒位后,采用序列特异PCR检测内含子1倒位;③若排除以上2种倒位突变,则应用HRM进行点突变筛查,然后测序确定致病突变。在明确先证者致病突变后,再进一步对家系中其他患者和可能携带者进行检测。本研究所提出的HA的直接基因诊断策略,简便快捷、经济有效,可进一步提高现有诊断的有效率和准确性,在HA的基因诊断及产前诊断中具有较强的实用性,适于在临床推广应用。今后将进一步提高样本量来进行实践验证,逐步建立起一套完善的直接基因诊断体系,以提高血友病A的诊断率,并丰富中国人群血友病A的基因突变谱。
[1]Scriver CR,Beaudet AL,Sly WS,et al.The metabolic and molecular bases of inherited disease[M].7th ed.New Yo rk:McGraw-Hill,1995.
[2]Antonarakis SE,Rossiter JP,Young M,et al.Factor VIII gene inversions in severe hemophilia A:results ofan international consortium study[J].Blood,1995,86:2206-2212.
[3]Rossetti LC,Radic CP,Larripa IB,et al.Genotyping the hemophilia inversion hotspot by use of inverse PCR[J].Clin Chem,2005,51:1154-1158.
[4]Qi LY,Jin CL, Lin CK,et al.A pplication study on inversion diagnosis of F8 gene in hemophilia A[J].Zhonghua Yi Xue Yi Chuan Xue Za Zhi,2007,24:405-408.
[5]Bagnall RD,Waseem N,Green PM,et al.Recurrent inversion breaking intron l of the facto r VIII gene is a frequent cause of severe hemopilia A[J].Blood,2002,99:168-174.
[6]Laurie AD,Smith MP,George PM.Detection of Factor VIII Gene Mutations by High-Resolution M elting Analy sis[J].Clin Chem,2007,53:2211-2214.
[7]Lin SY,Su YN,Hung CC,et al.Mutation spectrum of 122 hemophilia A families from Taiwanese population by LDPCR,DHPLC,multiplex PCR and evaluating the clinical application of HRM[J].BMC Medical Genetics,2008,20:53.
[8]Lakch D,Kazazion HH,Antonarakis SE,et al.Inversions disrupting the factor VIII gene are a common cause of severe hemophilia A[J].Nat Genet,1993,5:236.
[9]Tizzano EF,Cornet M,Baiget M.Inversion of intron 1 ofthe factorVIIIgene fordirectmoleculardiag nosis of hemophilia A[J].Haematologica,2003,88:118-120.
[10]M antilla-Capacho JM,Beltrán-Miranda CP,Luna-Záizar H,et al.Frequency of intron 1 and 22 inversions of Factor VIII gene in Mexican patients with severe hemophilia A[J].Am J Hematol,2007,82:283-287.
[11]Rossetti LC,Radic CP,Larripa IB,et al.Genoty ping the hemophilia inversion hotspot by use of inverse PCR[J].Clin Chem,2005,51:1154-1158.
[12]陆晔玲,丁秋兰,戴菁,等.血友病携带者与产前基因诊[J].中国输血杂志,2008,21:259-264.
[13]张立,余元勋,吴竞生.血友病A基因诊断和产前诊断技术的研究进展[J].中国优生与遗传杂志,2007,15:4-6.

