补阳还五汤对血管性痴呆大鼠学习记忆功能及海马组织ERK2与CaMKⅡβ蛋白表达的影响*
唐敬龙, 高维娟, 李玉明, 钱涛, 张泓波, 李君, 谢志
(承德医学院病理生理学教研室,河北 承德 067000)
大脑对缺血缺氧十分敏感,其中反复脑缺血再灌注损伤和长期慢性低灌流是引发血管性痴呆(vascular dementia,VD)的主要原因。而海马CA1区被认为是学习记忆等高级神经活动的重要部位,是脑缺血最敏感的区域之一,故脑海马CA1区常被用来作为缺血缺氧损伤研究的模型[1]。在缺血性脑血管疾病的发生发展过程中,细胞外信号调节激酶2(extracellular signal-regulated kinase,ERK2)能调控海马神经元的生长、发育、分化,参与海马神经元的可塑性;钙/钙调素依赖性蛋白激酶Ⅱβ(calcium/calmodulin-dependent protein kinaseⅡβ,CaMKⅡβ)蛋白则参与突触构建过程,增强长时程增强效应(long-term potentiation,LTP),促进学习记忆的恢复。益气活血中药补阳还五汤是中医治疗脑缺血再灌注损伤的经典方剂,已经证实其有显著的抗VD作用[2],但其分子机制尚未阐明,本实验通过观察补阳还五汤对VD大鼠CA1区ERK2与CaMKⅡβ蛋白表达的影响,探讨补阳还五汤对VD大鼠学习记忆的影响及其对海马神经元保护的分子机制。
材料和方法
1 材料
1.1 试剂仪器 补阳还五汤(由黄芪、当归尾、芍药、川芎、桃仁、红花、地龙组成 )由北京同仁堂医药公司承德分公司提供;戊巴比妥钠为进口分装;兔来源ERK2、兔来源CaMKⅡβ购自Cell Signaling Technology;兔来源β-actin购自Santa Cruz Biotechnology;羊抗兔IgG购自Proteintech;发光液购自Thermo;Morris水迷宫(Morris Water Maze,MWM)由中国医学科学院生产。
1.2 实验动物与分组 成年SD雄性大鼠60只,体重220g±20g,由北京维通利华实验动物技术有限公司提供,许可证号为SCXK(京)2007-0001,SPF级。通过水迷宫试验筛选出智力水平相当的大鼠,并随机分为假手术组、模型组、补阳还五汤组和尼莫地平组(阳性药物对照),每组15只。
2 方法
2.1 VD动物模型制备 采用改良的Pulsinelli’s 4血管阻断 (four-vessel occlusion,4VO)方法制备VD动物模型[3]:大鼠于术前12 h禁食,4 h禁水,戊巴比妥钠(45-50 mg/kg)腹腔注射麻醉。将大鼠伏卧固定于固定台上,行背侧颈正中切口,逐层钝性分离暴露双侧第1颈椎横突翼小孔,用直径0.5 mm的电凝针烧灼双侧翼小孔内的椎动脉,造成永久性闭塞。24 h后再将大鼠麻醉,仰卧固定,行腹侧颈正中切口,钝性分离双侧颈总动脉,以“4”号丝线穿线牵拉颈总动脉,用微动脉夹夹闭双侧颈总动脉5 min,共夹闭3次,每次间隔1 h。假手术组只做皮肤切口和组织分离处理,不进行椎动脉烧灼和颈总动脉夹闭,皮肤缝合后正常饲养。模型组大鼠造模后自然饲养;补阳还五汤组和尼莫地平组大鼠按上述方法造模后分别灌服补阳还五汤(50 g·kg-1·d-1)和尼莫地平(20 mg·kg-1·d-1),持续灌服 30 d。
2.2 大鼠行为学检测 采用Morris水迷宫法进行大鼠学习记忆功能的测定。(1)定位航行实验(place navigation)分别在术后7 d、14 d、28 d将大鼠从标记的4个入水点依次朝向池壁轻轻放入水中,记录其在90 s内寻找到并爬上平台的搜索持续时间即逃避潜伏期(escape latency,EL)。若大鼠90s内尚未找到平台,则将其引导至平台停留15 s,放回笼中。取3 d的平均成绩作为测试的成绩。(2)空间探索实验(space navigation)定位航行结束后撤除平台,让大鼠在水池中游90 s来寻找平台,记录大鼠90 s内跨越平台次数,取3 d的平均成绩作为测试的成绩。
2.3 取材、固定、HE染色 术后第30 d,水迷宫实验结束后,每组取5只大鼠用戊巴比妥钠(45-50 mg/kg)腹腔注射麻醉大鼠后仰卧固定,快速开胸,暴露心脏,直视下左心室插管入升主动脉,剪开右心耳,以生理盐水约500 mL经升主动脉灌注冲洗后,再灌注4%多聚甲醛溶液(pH7.4)500 mL,持续2 h后开颅取脑,并将脑组织置于4℃4%多聚甲醛中浸置4-6 h后,截取视交叉至大脑横裂的部分,PBS漂洗3次,每次1 h,4℃冰箱过夜,将固定好的脑组织予以常规脱水,透明,浸蜡,包埋,连续冠状切片,片厚4 μm,用于HE染色。染色方法:石蜡切片常规用二甲苯脱蜡,经逐级乙醇脱水后,苏木素、伊红染色,中性树胶封片。
2.4 海马CA1区神经元计数 HE切片采用Mivnt图像分析软件系统进行拍照。显微镜观察海马CA1区神经元并进行计数,每张切片选6个不同子午线方向视野行各层细胞计数,取其平均值。
2.5 ERK2与CaMKⅡβ蛋白的检测 术后第30 d,水迷宫实验结束后,每组取10只大鼠用戊巴比妥钠(45-50 mg/kg)麻醉,取海马放入液氮,于立体镜下切除CA1之后转存到-70℃冰箱中。待所有标本收集完毕后将样品立即放到4℃预冷的匀浆器中,先用PBS匀浆至清澈,弃上清,加裂解缓冲液中,裂解40 min。之后12000 r/min离心15 min取上清液分装。用BCA试剂盒测定蛋白质含量。将提取蛋白样品加入等体积的2×loading buffer混匀,在100℃沸水中煮3 min,变性,-80℃保存,备用。以12%SDS聚丙烯酰胺凝胶电泳分离蛋白质,ERK2蛋白按每孔蛋白上样量为30 μg,CaMKⅡβ蛋白按每孔蛋白上样量为50 μg按积层胶80 V,分离胶120 V条件(恒压)进行电泳,直至溴酚蓝移动至胶底部终止电泳。转膜前先用甲醇激活PVDF膜(1 min),按阴极近胶、阳极近膜的位置准备好转膜装置,4℃条件下300 mA(恒流)转膜2.5 h,将凝胶上的蛋白质转移到PVDF膜上。转膜结束后,用5%TBST脱脂奶粉封闭液封闭PVDF膜2 h,后加入兔抗ERK2多克隆抗体(1∶1000稀释)、CaMKⅡβ多克隆抗体(1∶1000稀释)、β -actin(1∶600稀释)4℃ 过夜。TBST洗3次,15 min×1次,10 min×2次,Ⅱ抗用生物素标记羊抗兔 IgG(1∶2000稀释)孵育1 h,TBST洗3次,5 min×3次,经ECL发光试剂盒显影,X射线底片曝光。以β-actin为内参照。实验重复6次。将蛋白印迹显影图像扫描。用Quantity One分析软件进行半定量分析,将ERK2与CaMKⅡβ蛋白灰度值与内参照β-actin灰度值比较,所得比值表示各组样品ERK2与CaMKⅡβ蛋白的表达水平。
3 统计学处理
结 果
1 补阳还五汤对大鼠水迷宫逃避潜伏期的影响
假手术组大鼠在术后7 d、14 d、28 d的逃逸潜伏期分别为(26.65±1.23)s、(12.96 ±1.13)s、(8.44±1.10)s;与之比较,模型组大鼠在各个时点的逃逸潜伏期[(63.57 ±2.14)s、(59.45 ±2.01)s、(54.25 ±1.83)s]均明显延长(P<0.05);与模型组相比,补阳还五汤组[(38.62 ±2.07)s、(21.36 ±1.23)s、(12.91±1.31)s]和尼莫地平组[(40.11 ±2.04)s、(22.58 ±1.65)s、(13.63 ±1.46)s]在术后第 7 d、14 d、28 d逃避潜伏期均显著缩短(P<0.05);补阳还五汤组和尼莫地平组相比,大鼠在术后各个时点逃避潜伏期均无明显区别(P>0.05),见图1。

Figure 1.The effect of Buyinghuanwu decoction on the escape latency of rats in Morris water maze at different time points..n=15.*P<0.05 vs sham group;#P<0.05 vs VD group.图1 补阳还五汤对大鼠水迷宫逃避潜伏期的影响
2 补阳还五汤对大鼠水迷宫跨越平台次数的影响
假手术组大鼠在术后第7 d、14 d、28 d跨越平台次数在90s内分别为(7.94±0.72)次、(12.83±0.80)次、(15.89±0.82)次;与之相比,模型组大鼠在各个时点的跨越平台次数[(3.13±0.28)次、(5.62±0.33)次、(6.33±0.48)次]均显著减少(P<0.05);与模型组相比,补阳还五汤组[(6.75±0.61)次、(11.55±0.69)次、(14.92±0.72)次]和尼莫地平组[(6.42±0.58)次、(10.63±0.69)次、(13.71±0.70)次]在术后第 7 d、14 d、28 d跨越平台次数均显著增多(P<0.05);补阳还五汤组和尼莫地平组相比,大鼠在术后各个时点跨越平台次数均无明显区别(P>0.05),见图2。

Figure 2.The effect of Buyanghuanwu decoction on times of striding over platform of rats in Morris water maze at different time points..n=15.*P<0.05 vs sham group;#P <0.05 vs VD group.图2 补阳还五汤对大鼠水迷宫跨越平台次数的影响
3 补阳还五汤对大鼠海马CA1区神经元形态的影响
术后30d,假手术组表现为正常组织形态,海马CA1区神经元排列整齐,均匀,细胞结构完整,见图3A;而模型组CA1区海马神经细胞排列欠规则,界限不清楚,正常细胞结构消失,胞核区域浓染,出现凝固性坏死,细胞脱失明显,见图3B;补阳还五汤组及尼莫地平组大部分海马神经元细胞接近正常,核膜轮廓清晰,核仁清楚,排列规则,见图3C、D。
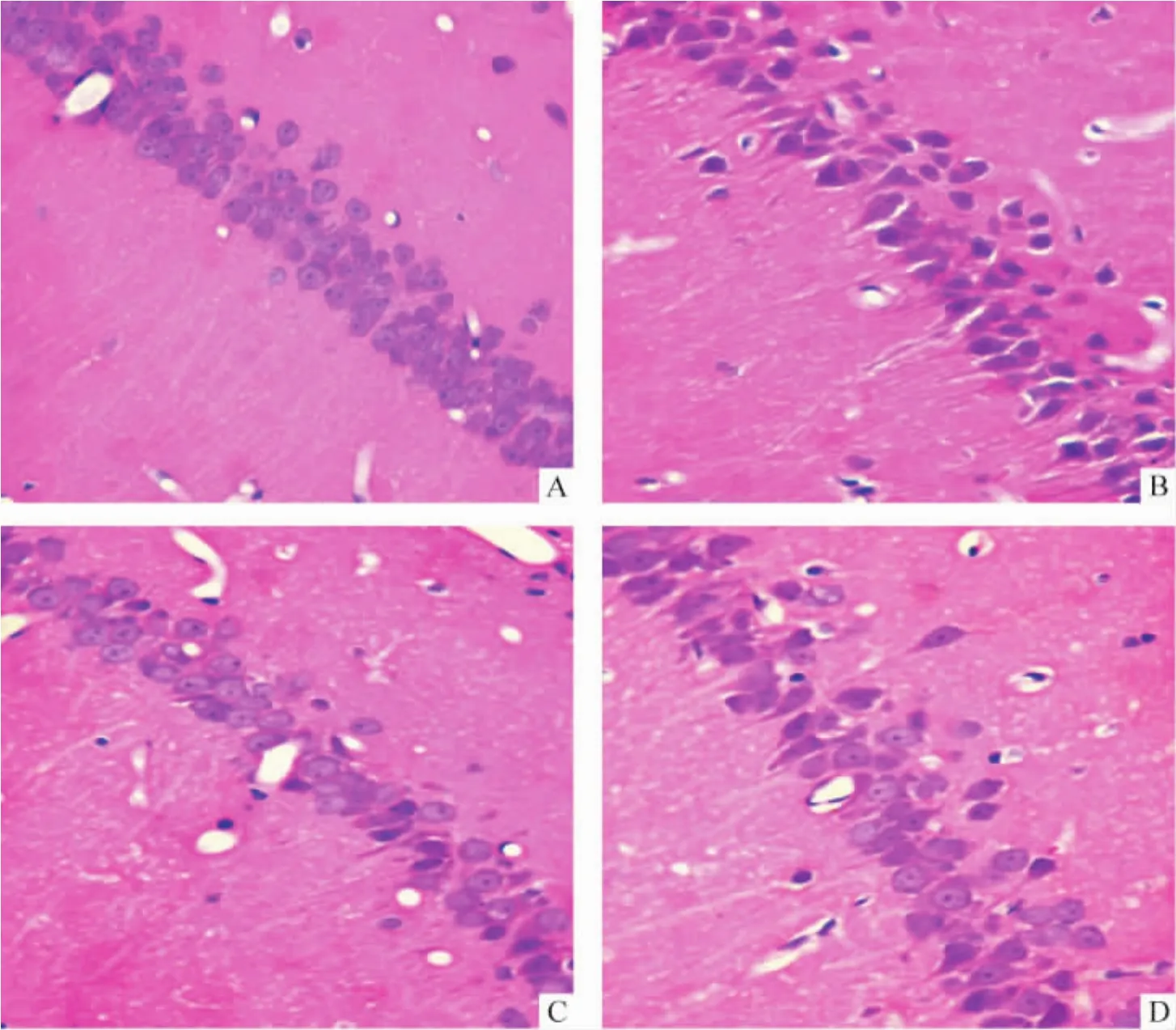
Figure 3.The effect of Buyanghuanwu decoction on morphological changes in hippocampal CA1 of rats 30 d after operation(×400).A:sham group,the neurons were in neat rows,integral structure;B:model group,cells showed irregular arrangement,coagulation necrosis and obvious deletion;C:VD+Buyanghuanwu decoction group,the neurons were in neat rows,integral structure and close to those in sham group;D:VD+nimodipine group,the neurons were in neat rows,integral structure and close to those in sham group.图3 术后30 d补阳还五汤对大鼠海马CA1区形态学的影响
4 补阳还五汤对大鼠海马CA1区神经元数目的影响
术后30 d,进行细胞计数显示:与假手术组(48.56±3.23)比较,模型组大鼠海马神经元数目(16.33±1.08)明显减少(P<0.05);补阳还五汤组(45.92±3.06)和尼莫地平组(43.19±2.87)大鼠海马神经元数目明显多于模型组(P<0.05);补阳还五汤组与尼莫地平组比较无明显差别(P>0.05),见图4。
5 补阳还五汤对大鼠海马组织神经元胞浆蛋白ERK2表达的影响
术后30 d,对蛋白条带平均灰度值进行分析结果显示:与假手术组(1.01±0.09)比较,模型组(0.53±0.07)大鼠海马ERK2蛋白在术后28 d表达显著减少(P<0.05),而补阳还五汤组(0.99±0.08)和尼莫地平组(0.93±0.08)ERK2蛋白的表达则明显高于模型组(P<0.05),且补阳还五汤组和尼莫地平组相比,蛋白表达无显著差异(P>0.05),见图5。
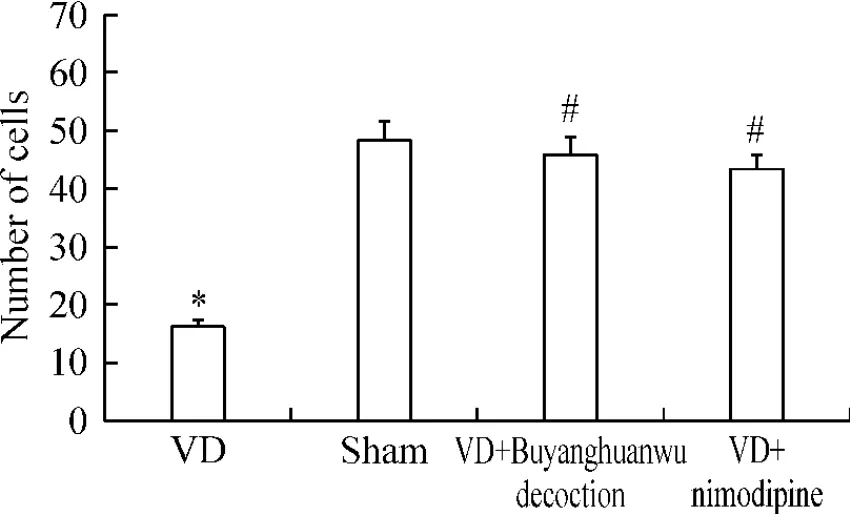
Figure 4.The effect of Buyanghuanwu decoction on the numbers of hippocampal CA1 neurons of rats 30 d after operation..n=5.*P<0.05 vs sham group;#P<0.05 vs VD group.图4 术后30 d补阳还五汤对大鼠海马CA1区神经元数目的影响
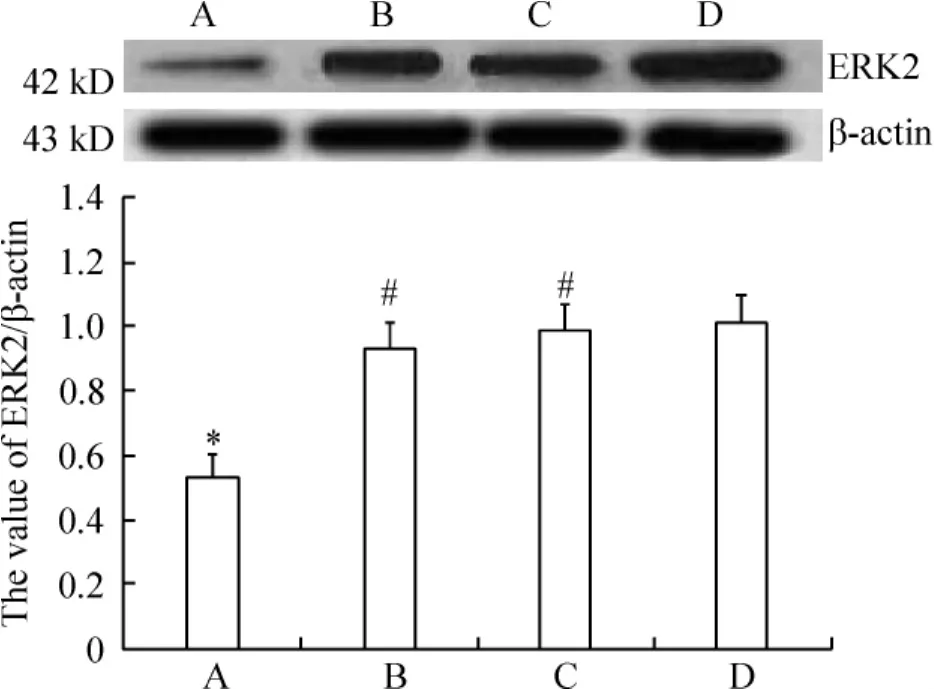
Figure 5.The effect of Buyanghuanwu decoction on the expression of ERK2 in hippocampal CA1 neurons of rats 30 d after operation.A:VD group;B:VD+nimodipine group;C:VD+Buyanghuanwu decoction;D:sham group..n=10.*P<0.05 vs sham group;#P<0.05 vs VD group.图5 术后30 d补阳还五汤对大鼠海马组织神经元ERK2蛋白表达的影响
6 补阳还五汤对大鼠海马组织神经元CaMKⅡβ蛋白表达的影响
术后30 d,对蛋白条带平均灰度值进行分析结果显示:与假手术组(1.12±0.04)比较,模型组(0.56±0.03)大鼠海马CaMKⅡβ蛋白在术后28 d表达显著减少(P<0.05),而补阳还五汤组(1.01±0.04)和尼莫地平组(1.00±0.05)CaMKⅡβ蛋白的表达则明显高于模型组(P<0.05),补阳还五汤组和尼莫地平组相比,CaMKⅡβ蛋白表达无显著差异(P>0.05),见图6。
讨 论
VD是由脑血管疾病所致的智能及认知功能障碍临床综合征。最终导致神经细胞损伤、学习记忆能力下降。ERK2是细胞内丝氨酸/苏氨酸蛋白激酶,调控神经细胞的生长、分化和损伤修复[4],保护受损神经元。VD还与CaMKⅡβ密切相关,Okamoto等[5]发现 CaMKⅡβ亚基的285-542和344-542氨基酸位点突变导致其蛋白激酶活性丧失,从而影响信号通路转导,造成突触构建障碍。
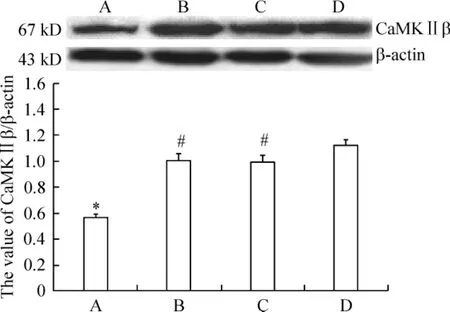
Figure 6.The effect of Buyanghuanwu decoction on the expression of CaMKⅡβ in hippocampal CA1 neurons of rats 30 d after operation.A:VD group;B:VD+nimodipine group:C:VD+Buyanghuanwu decoction;D:sham group..n=10.*P<0.05 vs sham group;#P<0.05 vs VD group.图6 术后30 d补阳还五汤对大鼠海马组织神经元CaMKⅡβ蛋白表达的影响
近年来,国内进行了大量的实验研究,证实益气活血中药有显著的抗VD作用[6-9]。而补阳还五汤是益气活血中药中的经典方剂,由黄芪、当归尾、芍药、川芎、桃仁、红花、地龙组成,本方重用黄芪,补益元气,瘀去络通,为君药。实验证实黄芪有扩张血管、改善微循环等作用[10]。当归尾活血通络而不伤血,用为臣药。赤芍、川芎、桃仁、红花协同当归尾以活血化瘀,地龙通经活络,力专善走,周行全身,以行药力,亦为佐药[11]。此外补阳还五汤干预后明显减低VD大鼠钙离子通道的开放时间和开放率[12],减轻钙超载对神经细胞的损伤,改善微循环。尼莫地平是二氢吡啶类钙离子通道阻滞剂,有解除脑血管痉挛,改善微循环等作用。临床上可用于治疗轻重度VD[13]。本实验以尼莫地平为阳性对照药物。
本实验给予补阳还五汤干预治疗后,Morris水迷宫实验显示:随时间的延长各组大鼠的EL均有不同程度的缩短,垮台次数有不同程度的增多,这与水迷宫训练次数的增加促进大鼠的学习记忆有关系。但是假手术组大鼠的EL缩短和跨越平台次数增多较模型组显著,表明正常大鼠学习、记忆功能较模型组好。此外,VD大鼠的EL缩短幅度与垮台次数增加幅度小,表明其学习记忆能力随时间的延长而降低,提示脑损害逐渐加重。HE染色及细胞计数均证实,补阳还五汤对VD大鼠的缺血再灌注损伤有一定的保护作用,改善学习记忆。Western blotting实验证实,模型组大鼠海马CA1区ERK2蛋白表达下调,使ERK2与下游转录因子(如CREB)结合能力下降,影响下游基因的转录、翻译、合成等水平,使ERK2蛋白总量减少,导致受损细胞因不能被修复而死亡[4]。CaMKⅡβ蛋白表达下调,降低AMPA受体的电导作用,使LTP难以维持[14],同时CaMKⅡβ向突触后膜移动减少,使突触构建能力下降,无法激活细胞核内基因表达及新突触的形成[15],从而使PSD间隙变宽,信息传递时间延长,减弱学习记忆能力。
综上所述,应用促进ERK2与CaMKⅡβ蛋白表达的药物可能成为治疗VD的有效方法之一。本实验给予补阳还五汤治疗30 d后能显著上调ERK2与CaMKⅡβ蛋白的表达(P<0.05),显著改善大鼠学习记忆能力,这为治疗血管性痴呆提供了新选择。
[1]Davis RJ.Signal transduction by the JNK group of MAP kinases[J].Cell,2000,103(4):221 -229.
[2]廖春来,佟 丽,沈剑刚.补阳还五汤抗脑缺血的实验研究进展[J].中国药物与临床,2003,3(3):176 -178.
[3]Schmidt- Kastner R,Paschen W,Ophoff BG,et al.A modified four-vessel occlusion model for inducing in complete forebrain ischemia in rats[J].Stroke,1989,20(7):938-646.
[4]Cobb MH.MAP kinase pathways[J].Prog Biophys Mol Biol,1999,71(3-4):479-500.
[5]Okamoto K,Narayanan R,Lee SH,et al.The role of CaMKⅡ as an F-actin-bundling protein crucial for maintenance of dendritic spine structure[J].PNAS,2007,104(15):6418-6423.
[6]Gao WJ,Xue JF.Effect of cerebral ischemia-reperfusion injury on choline acetyltransferase activity related to study and memory in rat hippocampal tissue[J].Chinese Jour-nal of Clinical Rehabilitation,2005,9(24):242 -243.
[7]高维娟,钱 涛,丛 斌,等.益肾降浊汤对小鼠脑缺血再灌注后细胞能荷的影响[J].中国老年学杂志,2005,25(3):12 -13.
[8]高维娟,钱 涛,丛 斌.益肾降浊汤对脑缺血再灌注大鼠海马EAA含量的影响[J].中西医结合心脑血管病杂志,2003,1(6):319 -321.
[9]高维娟,钱 涛,丛 斌.益肾降浊汤对脑缺血再灌注大鼠海马NE、5-HT含量的影响[J].中国药理学通报,2003,19(5):587 -589.
[10]叶冬青,高维娟,闫凤霞,等.黄芪注射液抑制缺氧缺糖/复氧复糖大鼠海马神经元 JNK3 mRNA的表达[J].中国病理生理杂志,2009,25(9):1756 -1761.
[11]陈 冬,杨洁红.补阳还五汤抗脑缺血作用的研究进展[J].中华中医药学刊,2010,28(1):72 -74.
[12]关 莉,闫福曼,张哓东,等.补阳还五汤对全脑缺血模型大鼠再灌注不同时点皮质神经细胞钙超载的影响[J].安徽中医学院学报,2008,27(4):45 -48
[13]Pantoni L,Del Ser T,Soglian AG,et al.Efficacy and safety of nimodipine in subcortical vascular dementia:a randomized placebo - controlled trial[J].Stroke,2005,36(3):619-624.
[14]唐敬龙,高维娟.谷氨酸NMDA受体与学习记忆的关系[J].中国老年学杂志,2009,29(18):2408-2410.
[15]Wang Z,Edwards JG,Riley N,et al.Myosin Vb mobilizes recycling endosomes and AMPA receptors for postsynaptic plasticity[J].Cell,2008,135(3):535-548.

