通心络对缺氧预适应小鼠脑组织细胞凋亡因子表达的影响*
吴相春, 来 静, 李爱然, 贾振华, 王洪涛
(1河北医科大学中西医结合教研室,河北 石家庄 050017;2河北中西医结合医药研究院络病研究室,河北 石家庄 050035;3石家庄市第三医院急诊科,河北 石家庄 050017)
低氧或缺氧是心、肺、脑血管病等常见病患者的基本病理过程。预适应是生物界中普遍存在的生物自我保护机能,缺氧预适应具有强大的保护和防御作用,效果极其肯定,但确切机制仍不明确。既往研究证实通心络具有明显的保护血管和神经的作用,但确切机制仍不明确。细胞凋亡是机体维持细胞群体数量稳态的重要手段,细胞凋亡失调是心脑血管疾病的重要发病机制。本研究观察缺氧预适应小鼠自身凋亡机制的变化以及通心络的干预作用并对其机制进行探讨。
材料和方法
1 材料
1.1 动物 标化动物雄性昆明小鼠80只,购于北京大学医学部实验动物科学部,许可证号为SCXK(京)2006-0008。
1.2 试剂及仪器 缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)抗体,购自 Abcam;B细胞白血病/淋巴瘤相关抗原相关X蛋白(Bcl-associated X,Bax)、B细胞白血病/淋巴瘤相关抗原2(B-cell leukemia/lymphoma 2,Bcl-2)抗体,购自Santa Cruz;120 mL广口瓶120个;秒表 20个;橡胶塞60个。
1.3 药物 通心络超微粉,为棕褐色粉末,味苦,1.46 g生药/g干粉,石家庄以岭药业有限公司提供。
2 方法
2.1 动物分组 按体重随机分为缺氧预适应组(以下简称对照组)和通心络组,每组40只。每组小鼠分别进行重复缺氧暴露0次(H0),缺氧1次(H1),缺氧3次(H3),缺氧5次(H5)。
2.2 给药剂量及方法 根据通心络超微粉提高小鼠缺氧耐受性的时效、量效关系实验研究结果[1],确定通心络组剂量为 1.52 g 生药·kg-1·d-1,用0.5%羧甲基纤维素钠(CMC-Na)配制成浓度为:0.152 kg生药/L混悬液,按0.1 mL/10 g动物体重灌胃。空白对照组,按0.1 mL/10 g动物体重用0.5%CMC-Na溶液灌胃。于实验前5 d开始给药,末次给药1 h后实验,实验周期为5 d。
2.3 缺氧预适应方法 参照吕国蔚等[2]的方法,在室温18-22℃下,将小鼠称质量后放入含有新鲜空气、经过标定的约120 mL广口瓶内,以橡皮塞密封、计时,一旦动物出现喘呼吸时(小鼠在缺氧末期出现紫绀,翻正反射消失,痉挛样动作和喘呼吸,喘呼吸后即呼吸停止)立即取出,并随即转移到另一容积相似、含有新鲜空气的广口瓶内密闭、记时,如此重复5次。各次换瓶从密闭开始到喘呼吸出现的时间为“原始耐受时间”,以min为单位。
2.4 取材方法 缺氧实验结束后,动物立即断头取血,即刻取脑并于液氮中速冻后于-80℃超低温冰箱中冻存。
2.5 观察指标
①标准耐受时间 参照吕国蔚等[3]的方法依下式算出相当于100mL有效空气量下的“标准耐受时间”T=原始耐受时间 ×100/(120-小鼠体重/0.94),比较各次的耐受时间。
② Western blotting方法检测脑组织 HIF-1α、Bax、Bcl-2的蛋白表达 从超低温冰箱中取出鼠脑,液氮中迅速研磨,加适量裂解液冰上裂解30 min,12000×g离心30 min,取上清液分装。利用BCA法进行总蛋白定量。加2×上样缓冲液配制样本,100℃加热10 min变性,从上述各组样品中分别120 μg的蛋白上样,用12%的 SDS-聚丙烯酰胺凝胶电泳。电泳结束后,用电转印仪将凝胶中的蛋白质转印到硝酸纤维素膜上。将转印后的膜依次与Ⅰ抗(抗HIF-1α单克隆抗体,1∶1000稀释;Bax抗体、Bcl-2抗体1∶200稀释)和Ⅱ抗(与辣根过氧化物酶标记的山羊抗小鼠或山羊抗兔IgG,北京中山生物技术有限公司,1∶10000稀释);孵育,化学发光显影(化学发光检测试剂盒,Thermo Scientific产品)。实验结果采用Quantity One软件分析,扫描灰度值,以目的蛋白与内参照β-actin的比值表示。
3 统计学处理
结 果
1 2组小鼠缺氧标准耐受时间的变化
与第1次缺氧比较,2组小鼠随着缺氧次数的增加,缺氧耐受时间明显增加(P<0.01或P<0.05)。与对照组比较,通心络组各次的缺氧耐受时间明显增加,差异显著(P<0.01或P<0.05),见表1。
表1 各组小鼠缺氧耐受时间的变化Table 1.Hypoxic tolerance time of mice in two groups(min..n=10)

表1 各组小鼠缺氧耐受时间的变化Table 1.Hypoxic tolerance time of mice in two groups(min..n=10)
##P<0.01 vs H1in the same group;△P<0.05 vs H3in the same group;*P<0.05,**P <0.01 vs control group at the same hypoxia exposure times.H1:hypoxia exposure once;H3:hypoxia exposure 3 times;H5:hypoxia exposure 5 times;control group:hypoxia preconditioning group.TXL:Tongxinluo(a Chinese medicine)group.
Control 15.57 ±2.00 41.69 ±9.04## 51.44 ±14.38##△TXL 18.01 ±2.37* 68.34 ±13.22##** 85.87 ±6.95##△**
2 2组小鼠HIF-1α表达的变化
2组小鼠在缺氧前脑组织有极少量HIF-1α表达,2组之间无明显差异(P>0.05);随缺氧次数增加,HIF-1α表达逐渐增强。与缺氧前比较,对照组缺氧1次有增加,但无明显差异;缺氧3次、缺氧5次明显增加,差异显著(P<0.01或P<0.05)。通心络组,缺氧1次、3次、5次HIF-1α表达均比缺氧前明显增加(P<0.01或P<0.05)。与对照组比较,通心络组各次缺氧HIF-1α表达更加明显,差异显著(P<0.01或P<0.05)。提示通心络组较对照组提前刺激机体表达HIF-1α;能够明显增加缺氧预适应小鼠HIF-1α的表达,见图1。
3 2组小鼠Bax的表达变化
缺氧前小鼠脑组织有少量Bax表达,2组之间无明显差异。通心络组缺氧1次和3次,对照组缺氧1次、3次和5次Bax表达均比缺氧前增强,而2组缺氧3次和缺氧5次,较缺氧1次明显减少,差异显著(P<0.01或P<0.05)。与对照组比较,通心络组各次缺氧小鼠Bax表达明显减弱,差异显著(P<0.01或P<0.05)。通心络组5次缺氧时Bax表达与缺氧前比较无明显差异(P>0.05),见图2。
4 2组小鼠Bcl-2表达变化
2组小鼠在缺氧前脑组织有少量Bcl-2表达,通心络组Bcl-2表达高于对照组(P<0.05);随着缺氧次数增加,2组Bcl-2表达均逐渐增强,差异显著(P<0.01或P<0.05)。与对照组比较,通心络组各次缺氧Bcl-2表达更加明显,差异显著(P<0.01或P <0.05),见图3。

Figure 1.The expression of HIF-1α in cerebral tissues by Western blotting..n=3.#P<0.05,##P<0.01 vs H0in the same group;*P <0.05,**P <0.01 vs control group at the same hypoxia exposure times.H0:no hypoxia exposure;H1:hypoxia exposure once;H3:hypoxia exposure 3 times;H5:hypoxia exposure 5 times.control:hypoxia preconditioning group.TXL:Tongxinluo(a Chinese medicine)group.图1 脑组织HIF-1α表达的变化
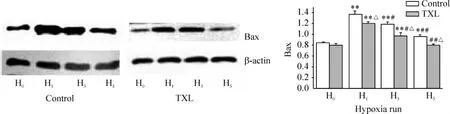
Figure 2.The expression of Bax in cerebral tissue of mice by Western blotting..n=3.*P<0.05,**P<0.01 vs H0in the same group;#P<0.05,##P<0.01 vs H1in the same group;△P<0.05 vs control group at the same hypoxia exposure times.H0:no hypoxia exposure;H1:hypoxia exposure once;H3:hypoxia exposure 3 times;H5:hypoxia exposure 5 times.control:hypoxia preconditioning group.TXL:Tongxinluo(a Chinese medicine)group.图2 脑组织Bax表达的变化比较

Figure 3.The expression of Bcl-2 in cerebral tissues of mice by Western blotting..n=3.*P<0.05,**P<0.01 vs H0in the same group;#P<0.05,##P<0.01 vs H1in the same group;△P<0.05 vs control group at the same hypoxia exposure times.H0:no hypoxia exposure;H1:hypoxia exposure once;H3:hypoxia exposure 3 times;H5:hypoxia exposure 5 times.control:hypoxia preconditioning group.TXL:Tongxinluo(a Chinese medicine)group.图3 脑组织Bcl-2表达的变化比较
讨 论
适应是机体在内外环境的变化中,通过改变自身的机能、形态和结构以适应其变化,从而更好地生存下去。小鼠的缺氧耐受时间随缺氧暴露次数增加而显著延长[3]。动物整体缺氧耐受时间是衡量缺氧耐受的一个重要指标[4]。本研究结果显示,随着缺氧次数的增加,小鼠耐受缺氧的时间逐次增加。与对照组比较,通心络干预后,小鼠的耐缺氧时间明显增加。提示机体对缺氧等刺激具有强大的耐受能力,缺氧预适应小鼠通过自身适应机制可以提高机体的缺氧耐受性,而通心络能够提高缺氧预适应小鼠的自适应能力,提高缺氧预适应小鼠的缺氧耐受性。
目前,人类对缺氧所触发的机体许多适应和不适应的系统反应认识还很少[5]。1991年首次发现HIF-1,作为诱导低氧反应基因和修复细胞氧内环境稳定的核心调节因子及其所诱导的一系列低氧反应效应基因或靶基因的表达,研究发现HIF-1可以诱导下游靶基因如血管内皮生长因子(VEGF)、Bcl-2等的转录,从而产生一系列代偿反应,促进细胞的生长和代谢[6]。缺氧诱导HIF-1高表达可显著减轻缺氧时HepG2细胞的损伤程度[7]。本研究结果显示:随着缺氧次数的增加,脑组织HIF-1α蛋白表达逐次增强。提示缺氧预适应小鼠通过自身的调节,逐渐达到自身的平衡稳态。而与对照组比较,通心络组较对照组能够提前刺激机体表达HIF-1α,能够明显增加缺氧预适应小鼠各次缺氧HIF-1α的表达,表明通心络具有提高机体自调节能力的作用。
Baranova等[8]研究证实,在缺氧缺血急性期HIF-1α可促进细胞凋亡,但随后这种损伤作用就被其调节的靶基因(促红细胞生成素、VEGF等)的正面作用所取代。内源性VEGF可以上调凋亡相关基因Bcl-2表达,防止毛细血管内皮细胞凋亡,对缺血脑组织可能具有神经保护作用。缺氧预适应可以增强Bcl-2和降低caspase-3的表达[9]。缺氧预适应可以通过稳定线粒体膜电位、升高Bcl-2和VEGF,促进ERK和AKT磷酸化,抑制间质干细胞凋亡而对心肌起保护作用[10]。本研究结果显示:随着缺氧次数的增加脑组织Bcl-2蛋白表达逐次增强,Bax蛋白在1次缺氧时明显增强,在3次、5次缺氧时逐渐降低,提示机体具有自我调节能力。而与对照组比较,通心络组各次缺氧脑组织Bcl-2蛋白表达增加,Bax下降,提示通心络能够提高机体抗凋亡的作用。
既往多项研究证实通心络对血管内皮细胞、神经元具有保护作用,而内皮细胞的保护对于心脑血管疾病的防治具有重要意义。本研究结果提示机体通过激发自身的调节机制,抑制促凋亡因子的产生,促进抗凋亡因子的表达,使机体逐渐达到自身的平衡稳态。通心络能够明显增强缺氧预适应小鼠脑组织抗凋亡因子的表达,抑制缺氧预适应小鼠脑组织促凋亡因子的表达,调节细胞凋亡失调的状态而达到相对平衡状态,从而参与脑保护机制。提示通心络能通过提高机体的自调节作用,而提高机体自适应能力。通心络具有益气活血、通络止痛的功效,方中含有人参、全蝎、蜈蚣、水蛭、土鳖虫、蝉蜕、赤芍、冰片等药物,现代药理研究证实通心络组方中的主要药物均具有不同程度抗缺氧作用,人参总皂苷可以显著增强小鼠大脑皮质HIF-1α蛋白表达水平,减轻小鼠大脑皮质的损伤程度,具有显著的保护作用[11]。人参皂苷Rb1能够减轻缺氧诱导的细胞损害和海马神经元损伤程度[12]。水蛭提取物有明显抑制缺氧诱导的新生大鼠大脑皮层神经细胞凋亡的作用,对大脑皮层神经细胞的缺氧性损伤具有明显的保护作用[13]。冰片能够透过血脑屏障,作为引药能明显加强川芎嗪的抗急性缺氧作用[14]。通心络显著的抗缺氧能力可能是方中药物综合作用的体现,为临床心脑血管疾病的治疗提供了实验依据。
[1]吴相春,来 静,吴以岭,等.通心络超微粉提高小鼠缺氧耐受性的时效、量效研究[J].辽宁中医杂志,2009,36(11):1986-1987.
[2]吕国蔚,史美棠,李 凌.急性重复缺氧对小鼠缺氧耐受性的影响及其机制的初步探讨[J].中国病理生理杂志,1992,8(4):425-429.
[3]谢胜男,李 昕,李尧华,等.急性重复低氧对小鼠脑组织血氧饱和度、线粒体功能以及ATP水平的影响[J].中国病理生理杂志,2008,24(4):755-758.
[4]Zhang SXL,Miller JJ,Gozal D,et al.Whole body hypoxic preconditioning protects mice against acute hypoxia by improving lung function[J].J Appl Physiol,2004,96(1):392-397.
[5]Grocott MP,Martin DS,Levett DZ,et al.Arterial blood gases and oxygen content in climbers on Mount Everest[J].N Engl J Med,2009,360(2):140 -149.
[6]Powell FL,Fu Z.HIF-1 and ventilatory acclimatization to chronic hypoxia[J].Respir Physiol Neurobiol,2008,164(1-2):282-287.
[7]蒋春华,罗勇军,黄庆愿,等.缺氧诱导因子-1α基因转染对缺氧损伤HepG2细胞的保护作用[J].中国病理生理杂志,2010,26(1):1-6.
[8]Baranova O,Miranda LF,Pichiule P,et al.Neuronspecific inactivation of the hypoxia inducible factor 1α increases brain injury in a mouse model of transient focal cerebral ischemia[J].J Neurosci,2007,27(23):6320-6332.
[9]张颜波,吕国蔚,杨明峰,等.低氧预适应小鼠皮层Bcl-2和 caspase-3的表达变化[J].生理学报,2008,60(2):249-253.
[10]Wang JA,Chen TL,Jiang J,et al.Hypoxic preconditioning attenuates hypoxia/reoxygenation-induced apoptosis in mesenchymal stem cells[J].Acta Pharmacol Sin,2008,29(1):74-82.
[11]王万银,沈 慧,赵 敏,等.人参总皂苷对缺氧小鼠脑皮质HIF表达影响[J].中国公共卫生,2008,24(6):711-712.
[12]柯荔宁,王 玮,赵小贞,等.人参皂苷Rb1抗SD大鼠海马神经元的缺氧损伤作用[J].山西医科大学学报,2009,40(8):688-692.
[13]林明宝,黄 湘,张 进.水蛭提取物对体外培养大鼠大脑皮层神经细胞缺氧性凋亡的影响[J].华西药学杂志,2008,23(5):543-545.
[14]王 晖.冰片加强川芎嗪抗小鼠急性缺氧作用[J].中药药理与临床,2006,16(4):13-15.

